
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Строение и механизмы роста различных типов мицеллярных структурСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
По мере увеличения концентрации и химического потенциала ПАВ усиливается взаимодействие между молекулами (ионами) ПАВ в растворе, возрастает доля агрегированного вещества. Поначалу преобладают мелкие, все увеличивающиеся в числе агрегаты (ассоциаты), но по достижении некоторой концентрации, называемой критической концентрацией мицеллооброзования(ККМ), происходит переход к образованию значительно более крупных и компактных агрегатов— мицелл, которые оказываются термодинамически более устойчивыми. К образованию агрегатов, как уже говорилось в предыдущем пункте, способны мицеллообразующие (коллоидные)ПАВ (ионные и неионные), молекулы которых не только хорошо сбалансированы, но и обладают сильными полярными группами, а также пространственной структурой, подходящей для упаковки в мицеллы. Введение таких ПАВ в воду вызывает два эффекта – адсорбцию и мицеллообразование. Это хорошо отражает кривая σ(с) представленная на рисунке 1. На участке кривой до точки с снижение σ свидетельствует о самопроизвольном переходе молекул ПАВ на поверхность раздела, их концентрировании на границе раздела фаз и образовании адсорбционного слоя, ориентированного углеводородными радикалами в неполярную фазу. При этом снижается запас свободной энергии (в форме свободной поверхностной энергии). С повышением концентрации ПАВ и увеличением адсорбции происходит уплотнение адсорбционного слоя (точки а, в). В точке с возможность снижения свободной энергии путем адсорбции исчерпывается, т.к. достигается предельная адсорбция с максимально плотной упаковкой адсорбционного слоя. При дальнейшем повышении концентрации ПАВ минимизация энергии Гиббса системы может быть реализована лишь за счет структурных изменений в объеме раствора: молекулы спонтанно образуют ассоциаты – мицеллы.
При этом, как и в случае адсорбции, углеводородные радикалы переходят из воды в неполярную фазу – углеводородное ядро мицелл (прямая мицелла) Схематическое изображение прямой мицеллы представлено на рисунке2. Происходит фазовое разделение раствора на микроуровне или самоорганизация молекул (ионов) ПАВ с образованием наноразмернойпсевдофазы. Этот процесс имеет коллективный характер, т.е. мицелла образуется не путем постепенного прибавления отдельных мономерных молекул к растущему агрегату, а путем одновременного объединения многих молекул в крупный агрегат, равновесный с молекулярным раствором.
Рисунок 2 -Схематическое изображение мицеллы ПАВ в воде или в полярной среде (прямая мицелла)
У некоторых ПАВ настолько выражены гидрофобные (олеофильные) свойства, что они нерастворимы в воде, но растворяются в неполярных средах. Такие маслорастворимые ПАВ также способны к мицеллообразованию, но в этом случае возникают мицеллы с противоположной ориентацией молекул (обратные мицеллы). Полярные группы объединяются в гидрофильное (олеофобное) ядро, а углеводородные радикалы обращаются в сторону родственной им неполярной среды, образуя олеофильную оболочку, которая экранирует внутреннюю гидрофильную часть мицеллы от контакта с гидрофобной углеводородной средой. Обратная мицелла представлена на рисунке 3.
Процесс мицеллообразованиявыгоден термодинамически. При постоянстве температуры и давления это выигрыш в энергии Гиббса который слагается из двух конкурирующих эффектов: энтальпийного (теплового)
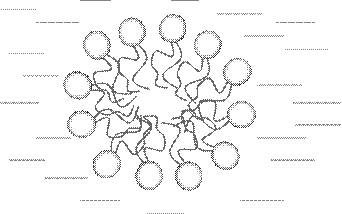
Однако в процессемицеллообразования определяющую роль играет энтропийныйэффект, обусловленный изменением состояния молекул не толькоПАВ, но и воды (растворителя). В случае сильного разбавленияэнтропийный член очень велик за счет энтропии смешения,которая для разъединенных молекул ПАВ выше, чем приих ассоциации. Поэтому в разбавленном растворе образованиемицелл маловероятно. В достаточно концентрированном раствореэнтропия смешения уже не так велика, и в действие вступаетгидрофобный эффект, связанный с энтропией воды, — он-тои приводит к массовому возникновению прямых мицелл. Если посмотреть на мицеллообразование с кинетическойточки зрения, то также видна важность достижения определеннойконцентрации ПАВ. Мицелла состоит, по крайней мере, из;десятков молекул и, чтобы она образовалась, необходимо илиодновременное столкновение такого числа молекул или, что болеереально, постепенный рост молекулярного агрегата путемпоследовательных столкновений. Вероятность обоих этих событийвозрастает с увеличением концентрации ПАВ в растворе.Существенным моментом является то, что когда образованиемицелл становится практически возможным, образование ихпредшественников — более мелких промежуточных агрегатовтермодинамически менее выгодно и, следовательно, они возникаюти увеличиваются в размере путем флуктуаций, как в обычныхфазовых переходах. Посколькумицеллообразование характеризуется определеннымэнергетическим барьером, то, как и в обычных фазовых процессах,в принципе, может существовать состояние пересыщенияраствора ПАВ по отношению к мицеллообразованию. При увеличении концентрации ПАВ в растворе выше ККМ происходит постепенной изменение их размера и формы. При этом наблюдается общая закономерность: с повышением концентрации ПАВ увеличивается размер и степень асимметризации мицелл. На рисунке 4 б показаны исходные симметричные сферические мицеллы, которые самопроизвольно перестраиваются вначале в слабо асимметричные эллипсоидальные мицеллы, которые по мере роста вдоль длинной оси превращаются в цилиндрические, что показано на рисунке 4в. Концентрация, при которой совершается переход от сферических к асимметричным несферическим мицеллам, называется критической концентрацией асимметризации мицелл (или ККМ2). Величина ККМ2 обычно в сотни раз превышает ККМ.На рисунке 4 г видно, что при дальнейшем увеличении концентрации ПАВ образуют крупные агрегаты гексагональной структуры, в которых цилиндрические частицы расположены параллельно друг другу. В концентрированных растворах, то есть когда С ПАВ >> ККМ, гексагональные структуры преобразовываются в предельно асимметричные ламеллярные (пластинчатые) мицеллы – протяженные бимолекулярные слои молекул ПАВ ориентированных параллельно друг другу и образующих чередующиеся слои полярных групп и углеводородных радикалов, что показано на рисунке 4 д.

Рисунок 4- Упрощенная схема структурных превращений в растворах мицеллообразующих ПАВ по мере роста концентрации Люминесценция Люминесценция–испускание фотонов в результате перехода молекулы из основного в электронно-возбужденноесостояние. Этот процесс делится на два типа в зависимости от природы основного и возбужденного состояний. В синглетном возбужденном состоянии электрон на энергетически более высокой орбитали и второй электрон на орбитали с более низкой энергией имеют противоположную ориентацию спинов, то есть спины электронов спарены. В триплетном же состоянии спины электронов не спарены, то есть их спины имеют одинаковую ориентацию. При возвращении электрона из возбужденного синглетного состояния в основное ориентация его спина не должна меняться. Флуоресценция - это испускание фотонов в результатевозвращения спаренного электрона на более низкую орбиталь. Такие переходы квантово-механически разрешены, которым характерны скорости испускания ~10-8 с-1. Время затухания флуоресценции~10-8 с (10 нс). Время жизни - это средний период времени, в течение которого флуорофор находится в возбужденном состоянии. Фосфоресценция - это испускание, происходящее при переходе между состояниями различной мультиплетности. В основном этот процесс представленпереходомиз возбужденного триплетного в синглетное основное состояние. Мультиплетностью состояния называют величину T= 2S + 1, где S — суммарный электронный спин данного состояния. Так, для синглетных состояний T=1 и S=0, для триплетных — T=3 и S=1 Такие переходы не разрешены, и константы скорости испускания малы. Диапазон времени затухания фосфоресценции — от 10-3 с до 1 с, что зависит от вклада других процессов дезактивации. В веществах, проявляющих значительную флуоресценцию, электроны в основном делокализованы и формально расположены на сопряженных двойных связях. Флуоресцентные спектральные данные обычно представляют в виде спектров испускания. Спектр испускания флуоресценции — это зависимость интенсивности флуоресценции от длин волн (в нанометрах) или волновых чисел (в см-1). Поглощение и испускание света хорошо иллюстрирует диаграмма уровней энергии, предложенная Яблонским, изабражёная на рисунке 5. Каждый из этих уровней энергии состоять из множества колебательных энергетических уровней, обозначаемых 0, 1, 2 и т. д. Переходы между электронными уровнями обозначены вертикальными линиями. Возбуждение флуорофора, как правило, происходит до некоторого высшего колебательного уровня состояний (S1 либо S2). 3а некоторыми редкими исключениями, для молекул в конденсированной фазе характерна быстрая релаксация на самый нижний колебательный уровень состояния S1. Этот процесс называется внутренней конверсией и происходит за
Рисунок 5-Диаграмма Яблонского
Поскольку типичные времена затухания флуоресценции близки к 10-8 с, внутренняя конверсия обычно полностью заканчивается до процесса испускания. Испускание флуоресценции осуществляется из термически равновесного возбужденного состояния. Термическое равновесие достигается за время порядка 10-12 с. Спектр поглощения молекулы отражает колебательную структуру возбужденных электронных состояний, а спектр испускания - колебательную структуру основного электронного состояния. В большинстве случаев электронное возбуждение не сильно изменяет расположение колебательных уровней энергии. В результате этого колебательные структуры, проявляющиеся в спектрах поглощения и испускания, сходны. Молекулы в состоянии S1 могут также подвергаться конверсии в первое триплетное состояние Т1. Конверсия из S1 в Т1 называется интеркомбинационной конверсией. Испускание из Т1 называемое фосфоресценцией, обычно сдвинуто в сторону больших длин волн (меньших энергий) по сравнению с флуоресценцией. Переход из Т1 в основное состояние запрещен, в результате чего константа скорости такого испускания меньше соответствующей константы для флуоресценции на несколько порядков.
|
||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-09-20; просмотров: 661; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.214 (0.008 с.) |



 иэнтропийного
иэнтропийного  :
:
 10-12 с.
10-12 с.



