
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Специальный физический практикумСодержание книги
Поиск на нашем сайте СПЕЦИАЛЬНЫЙ ФИЗИЧЕСКИЙ ПРАКТИКУМ «ОПРЕДЕЛЕНИЕ ПАРАМЕТРОВ МОЛЕКУЛЯРНЫХ БИОСИСТЕМ» Специальный физический практикум «Определение параметров молекулярных биосистем» МИЦЕЛЛООБРАЗОВАНИЕ В ВОДНЫХ РАСТВОРАХ ПОВЕРХНОСТНО-АКТИВНЫХ ВЕЩЕСТВ Цель: Изучить свойства ПАВ и найти ККМ ионогенного ПАВ методом люминесцентной спектроскопии.
БЕЗЫЗЛУЧАТЕЛЬНЫЙ ПЕРЕНОС ЭНЕРГИИ ЭЛЕКТРОННОГО ВОЗБУЖДЕНИЯ В РАСТВОРЕ ОБРАТНЫХ МИЦЕЛЛ Цель: наблюдать изменение скорости переноса при различных гидродинамических радиусах мицеллы
ВЛИЯНИЕ НЕКОТОРЫХ ГИДРОФОБНЫХ ЛИГАНДОВ НА СПЕКТРАЛЬНЫЕ ХАРАКТЕРИСТИКИ ГЕМОГЛОБИНА Цель: наблюдать конформационные изменения, приводящие к образованию белковых агрегатов, которые более интенсивно рассеивают свет. ИССЛЕДОВАНИЕ ВЛИЯНИЯ ТЕМПЕРАТУРЫ НА ОПТИЧЕСКИЕ СВОЙСТВА РАСТВОРОВ ОКСИГЕМОГЛОБИНА Цель: Изучить оптические свойства растворов оксигемоглобина модифицированного воздействием различных температур. ОСМОТИЧЕСКАЯ УСТОЙЧИВОСТЬ ЭРИТРОЦИТОВ
Цель: Изучить механизмы изменения проницаемости биологических мембран и найти осмотическую устойчивость и хрупкость эритроцитов
ОПРЕДЕЛЕНИЕ РАЗМЕРОВ ЭРИТРОЦИТОВ
Цель: Изучить дифракцию лазерного излучения на круглом диске. Определить размер эритроцита крови. Лабораторная работа 1 МИЦЕЛЛООБРАЗОВАНИЕ В ВОДНЫХ РАСТВОРАХ ПОВЕРХНОСТНО-АКТИВНЫХ ВЕЩЕСТВ Цель: Изучение свойств ионогенных ПАВ и нахождение ККМ методом люминесцентной спектроскопии.
1.1. Мицеллообразование. Общая характеристика поверхностно-активных веществ и явления мицеллообразования
Энергетическое состояние молекул (или других частиц) жидкости в объемной фазе и на границе раздела фаз неэквивалентно. Внутри фазы частица со всех сторон окружена равновероятно по химической природе другими частицами, в чистой жидкости, например, себе подобными частицами. Силы межмолекулярных взаимодействий, одинаково действующих во всех направлениях, дают суммарную силу F 2 = 0 (рис 1). На границе раздела фаз «жидкость-воздух» или «жидкость - насыщенный пар» силы межмолекулярных взаимодействий частиц с молекулами газовой фазы и с молекулами со стороны объёма жидкой фазы не равны. В этом случае на частицу в поверхностном слое действует суммарная сила межмолекулярных взаимодействий F 1, направленная по нормали к поверхности вглубь объемной фазы (рис.1).
по сравнению с их числом в единичном объёме внутри фазы. Например, плотность воды в поверхностном монослое ниже плотности воды на 15 %, для других жидкостей это понижение составляет 3-7%. Если жидкость представляет собою раствор, то концентрация растворённого вещества в поверхностном слое также может отличаться от его объёмной концентрации. Изменение концентрации вещества в поверхностном слое по сравнению с объёмной называется адсорбцией. Адсорбция может быть положительной и отрицательной в зависимости от свойств растворенного вещества и растворителя. Например, неорганические кислоты, соли, сильные основания не только хорошо растворяются в воде, но и подвергаются электролитической диссоциации, что является следствием сильных межмолекулярных взаимодействий растворённого вещества и растворителя. Такие вещества проявляют отрицательную адсорбцию – их концентрация в поверхностном слое ниже, чем в объёме. Понижение плотности чистой жидкости в поверхностном слое есть следствие отрицательной автоадсорбции. Существует обширный круг соединений, молекулярное строение которых является дифильным (их называют также амфифильными). Это вещества, состоящие из функциональных частей разной природы - неполярного углеводородного фрагмента (радикалы R) и какой-либо полярной группы. Полярными могут являться группы СООН, СОО-, ОН-, сульфатная (-OSO3-), сульфонатная (-SO3-), группы, содержащие азот (-NН2 и другие). В отношении воды полярный фрагмент амфифильного вещества является гидрофильным (любящим воду), а неполярный – гидрофобным. Из-за особенности структуры такие вещества в воде растворяются ограниченно и в растворе обладают способностью концентрироваться в поверхностном слое, для них характерна положительная адсорбция, а сами они называются поверхностно-активными веществами (ПАВ). Чтобы подчеркнуть структурную особенность ПАВ, их принято схематично обозначать следующим образом:
Расположение таких молекул в поверхностном слое энергетически наиболее выгодно при условии погружения гидрофильных групп в водную фазу, а гидрофобных углеводородных цепей - в воздух или менее полярную фазу. При малой концентрации адсорбированных молекул в поверхностном слое тепловое движение нарушает их ориентацию, и молекулы в основном лежат на поверхности. Повышение концентрации ПАВ и насыщение адсорбционного слоя приводит к вертикальной ориентации углеводородных групп и образованию «молекулярного частокола» (рис.2). В этом состоянии площадь, занимаемая молекулой, определяется лишь площадью полярной группы, общей для всех членов гомологического ряда.
Число молекул в мицелле, m, называют числом агрегации. Оно может иметь значения от 20 до 100 и более. Равновесие между мицеллами, содержащими m молекул ПАВ, и раствором ПАВ молекулярной дисперсии можно описать подобно химической реакции с константой равновесия К.
m ПАВ К = [(ПАВ) m ]/ [ПАВ]m. (1) Образование мицелл обратимо, так как они распадаются при разбавлении мицеллярных растворов на молекулы или ионы диссоциируемого ПАВ. Концентрация, при которой мицеллы начинают образовываться, называют критической концентрацией мицеллообразования. Сферические мицеллы характеризуются узким распределением частиц по размерам. При увеличении концентрации ПАВ происходит переход мицеллы из одной формы в другую (цилиндрическую, дискообразную и т.д.). Эффективность моющего действия при стирке сильно зависит от наличия мицелл в растворе. Образованию мицелл способствует понижение температуры, увеличение молекулярной массы и концентрации ПАВ, наличие в растворе электролитов. При определенной концентрации моющая способность растворов достигает максимума; дальнейшее увеличение концентрации ПАВ не приводит к увеличению моющей способности раствора. Уменьшение концентрации ПАВ в растворе также снижает моющую способность. Следовательно, по ККМ можно определять максимальное количество ПАВ, необходимое для наиболее эффективного моющего воздействия CMC. Так, при домашней стирке и в прачечных оптимальные концентрации моющих веществ составляют: для домашней стирки хлопчатобумажных тканей -2-3 г/л, в прачечных -1-2 г/л; для стирки шерстяных и шелковых тканей - 0,7- 2,5 г/л. К мицеллам относят также частицы в растворах поверхностно-активных веществ (ПАВ), называемых лиофильными коллоидами. Например, мицеллы додецилсульфата в воде. Мицеллы могут существовать в состояниях с различными равновесными структурами и в различных внешних формах, устойчивых при различных концентрациях ПАВ в мицеллярном растворе. Такая способность мицелл называется полиморфизмом мицелл.
1.1.2. Термодинамические факторы мицеллообразования Рассмотрим более подробно причины, вызывающие самопроизвольную агрегацию молекул ПАВ в мицеллярные структуры. С точки зрения термодинамики движущей силой мицеллообразования является увеличение энтропии системы в целом (термодинамическая система включает растворитель и растворенное вещество). Основным фактором, приводящим к стабилизации мицелл, являются гидрофобные взаимодействия. Под их действием система принимает такую структурную организацию, при которой сводятся к минимуму контакты между неполярными участками ПАВ и водой. Эти силы имеют в основном энтропийную природу и связаны с ограничениями, налагаемыми на упаковку молекул воды вокруг неполярных фрагментов. Рассмотрим это более подробно. Структура чистой воды стабилизирована, прежде всего, водородными связями. Когда какой-либо ион, например Cl-, попадает в воду, происходит его сольватация, при этом молекулы воды образуют вокруг него гидратную оболочку. С точки зрения энтропии любое упорядочение молекул невыгодно, но этот фактор с избытком компенсируется сильными электростатическими взаимодействиями между ионом и молекулой воды. Поэтому изменение энергии Гиббса в процессе растворения соли в воде отрицательно. Когда в воде растворяется неполярное вещество, структура воды вокруг каждой молекулы также нарушается. Молекулы воды стремятся ориентироваться таким образом, чтобы сохранились межмолекулярные водородные связи. Те молекулы воды, которые непосредственно контактируют с молекулами растворенного неполярного вещества, соседствуют с меньшим числом себе подобных молекул, и в системе возникают значительные структурные напряжения. При этом в данном случае компенсирующие электростатические взаимодействия отсутствуют. Невыгодные взаимодействия между неполярным растворяемым веществом и водой – это и есть те гидрофобные взаимодействия, под действием которых неполярные вещества стремятся свести к минимуму контакты с водой. Рассмотрим теперь, что произойдет при растворении в воде дифильной молекулы ПАВ. Под влиянием гидрофобного эффекта углеводородная часть молекулы ПАВ выталкивается из воды, чтобы насколько возможно избежать с ней контакта, и в результате образуются мицеллы (рис.3). Удаление из воды углеводородных цепей дифильных ПАВ в мицеллы снижает структурные напряжения в воде. Организация углеводородной части мицеллы сопровождается уменьшением энтропии, но изменение структуры воды связано с увеличением энтропии, в результате чего энтропия системы в целом увеличивается. Следует отметить, что способностью к мицеллообразованию обладают не все дифильные ПАВ. Это явление зависит от двух факторов. Один из них − длина гидрофобной части молекулы. Поскольку гидрофобность пропорциональна площади поверхности контакта между водой и неполярным фрагментом, то чем длиннее углеводородная цепь ПАВ, тем значительнее нарушения структуры воды из-за увеличения площади контакта, тем больше склонность ПАВ к мицеллообразованию. С другой стороны, для образования мицеллярных систем ПАВ существенную роль играет способность полярных групп экранировать углеводородное ядро от контакта с водой. Эта способность определяется собственными размерами полярных групп и их характером взаимодействия с растворителем, в частности гидратируемостью. Такие полярные группы, как -СОО-, -SO3-, -OSO3-, [(R)4 N]+, хорошо гидратируются и обладают большой экранирующей способностью. А, дифильные вещества с одной небольшой полярной группой, например, спирты жирного ряда, не способны к мицеллообразованию, даже при наличии длинной углеводородной цепи. Другими словами, способностью к мицеллообразованию обладают лишь те дифильные вещества, которые имеют оптимальные соотношения между гидрофильной и гидрофобной частями молекулы. В научной литературе это называют гидрофильно-липофильным балансом (ГЛБ). По природе гидрофильной группы дифильные вещества различают на ионогенные ПАВ, диссоциирующие в водных растворах с образованием ионов, и неионогенные, то есть не склонные к диссоциации. Ионогенные ПАВ классифицируют на: а) анионоактивные, которые при диссоциации образуют поверхностно-активные анионы с углеводородными группами, например, cоли карбоновых кислот (мыла) СН3(СН2)nCН2СООNа D СН3(СН2)nCН2СОО- + Nа+, соли алкилсульфокислот СН3(СН2)nCН2ОSO3 Nа D СН3(СН2)nCН2ОSO3-+ Nа+; б) катионоактивные, образующие ПАВ катионного характера, например, соли алкиламмония, которые диссоциируют по схеме: [R1R2R3R4N]+А- D [R1R2R3N] + + А-, где А- какой либо анион; в) амфолитные (амфотерные) ПАВ, которые в зависимости от среды проявляют катионоактивные, анионоактивные или неионогенные свойства, например, аминокислоты кислая среда щелочная среда N+H3CHRCOOH D N+ H3CHR COO-D NH2CHRCOO-. катионные свойства неионогенные свойства анионные свойства
Среди неионогенных ПАВ к мицеллообразованию склонны такие вещества, в молекулах которых содержится значительное число полярных фрагментов в углеводородной цепи (полиоксиэтилированные вещества, производные сахаридов, глюкозидов). Растворимость таких веществ в воде обуславливают их межмолекулярные взаимодействия с растворителем посредством полярных групп, как, например, это показано для алкилполиэтиленгликолей:
O O O H H H
1.1.3. Количественные характеристики состояния поверхности, адсорбции и мицеллообразования
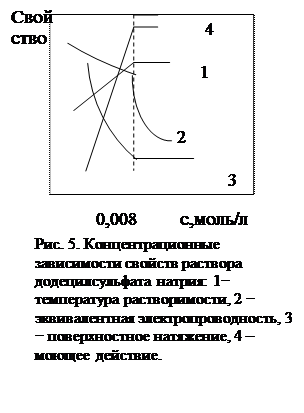
Обратимся вновь к рис.1. Сила F 1, действующая на единицу длины границы раздела двух фаз, называется силой поверхностного натяжения или поверхностным натяжением, g, дин/см. В ранней литературе для обозначения поверхностного натяжения используется символs. Как уже было сказано, под действием силы F 1 на границе жидкость-газ молекулы жидкости втягиваются внутрь жидкой фазы, уменьшая площадь поверхности. Следовательно, для образования поверхностного слоя (увеличения площади поверхности) необходимо совершить работу, связанную с преодолением силы поверхностного натяжения.. Поэтому поверхностное натяжение рассматривают как обратимую работу по созданию единицы поверхности. Поверхностное натяжение количественно отражает силу межмолекулярных взаимодействий в жидкости относительно газовой фазы. Чем более полярной является жидкая фаза, тем сильнее в ней межмолекулярные взаимодействия, тем выше значения g (s), например, при 200С gводы, этанола и гексана соответственно равны 72,75; 22,03; 18,42 мДж/м2. Между поверхностным натяжением, адсорбцией ПАВ и его объёмной концентрацией (ci) существует связь. Поверхностное натяжение уменьшается при повышении концентрации ПАВ. Из рис. 4, где в качестве примера приведена изотермическая зависимость поверхностного натяжения водного раствора от концентрации масляной кислоты, видно, что эта зависимость имеет вид плавно нисходящей кривой. Однако для растворов мицеллообразующих ПАВ снижение g является более резким, и уже при концентрациях порядка 10-2 – 10-3 моль/л наблюдается излом (рис. 5, кривая 3). Подобный характер имеют концентрационные зависимости и других физико-химических свойств растворов мицеллообразующих ПАВ - температур равновесия с твёрдой фазой, удельной и эквивалентной электропроводности, осмотического давления, моющего действия и др.(рис. 5). Такое изменение свойств связано с существенным качественным изменением состояния системы в растворе – переходом ее из гомогенного состояния молекулярной дисперсии в состояние мицеллярной дисперсии.
Концентрация ПАВ, при которой начинается мицеллообразование, называется критической концентрацией мицеллообразования (ККМ). Причем, под ККМ следует понимать не точку, а узкую концентрационную область, в пределах которой интенсивно происходит мицеллообразование. При концентрациях меньших ККМ все количество ПАВ находится в молекулярно растворенном состоянии, и мицелл в системе практически нет (рис.6). При достижении ККМ в узкой области концентраций вблизи ККМ начинается образование мицелл, и при дальнейшем увеличении количества ПАВ (с 0) все вновь вводимое вещество переходит в мицеллярное состояние, повышая концентрацию мицелл (с миц), тогда как концентрация молекулярно растворенного ПАВ (с м) остается почти неизменной, с м» ККМ» const, рис. 6. Это и является причиной не только возникновения излома на концентрационных зависимостях физических свойств, но и практического постоянства некоторых из них после достижения ККМ. В частности, это наблюдается на кривой g= f (с). Величина поверхностного натяжения g определяется концентрацией ПАВ в молекулярной форме в соответствии с фундаментальным уравнением Гиббса (2). Практическое постоянство концентрации молекулярно растворенного вещества в области ККМ отвечает условию g = const (рис.5, кривая 3).
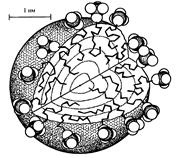
Геометрия мицелл В широком интервале концентраций выше ККМ молекулы ПАВ объединяются в сферические мицеллы, так называемые мицеллы Гартли (рис. 2) с некоторым оптимальным числом агрегации m. Радиус такой мицеллы имеет значение, близкое к длине углеводородной цепи. Например, радиус устойчивой сферической мицеллы олеата натрия С17Н33СООNa составляет» 2,5 нм, что соответствует m, равному нескольким десяткам (от 20 до 100). Образование мицелл с большими числами агрегации с сохранением сферической формы становится термодинамически невыгодным, поскольку неизбежно должно сопровождаться включением полярной группы в объем мицеллы. Поэтому с ростом содержания ПАВ в системе при с 0 >>ККМ наряду с увеличением концентрации сферических мицелл постепенно происходит изменение их формы. Сферические мицеллы переходят в эллипсоидальные, цилиндрические, палочкообразные, ленточные, пластинчатые мицеллы (последние получили название мицелл Мак-Бена). На рис.7 приведена структура мицеллы Мак-Бена.
1.1.5. Фазовая диаграмма конденсированных состояний двойных систем «ПАВ − вода»
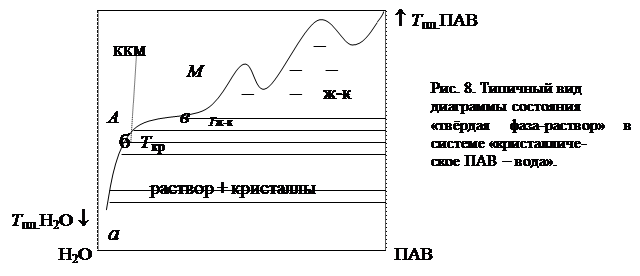
При достижении ККМ резко увеличивается растворимость ПАВ, и температура фазового перехода очень слабо зависит от концентрации (рис. 5, кривая 1). На рис.8 схематично приведен полный вид типичной диаграммы растворимости (кристаллизации) кристаллических ПАВ при температурах выше 0оС в воде. Кривая «абв» есть кривая растворимости, пунктирная линия ККМ – зависимость критической концентрации мицеллообразования от температуры. Её наклон свидетельствует о слабой зависимости ККМ от температуры. Так как величина ККМ связана с равновесным процессом (1) и его константой равновесия, то такая температурная зависимость есть следствие невысокого значения энтальпийного фактора в функции Гиббса мицеллообразования. Пересечение линии ККМ с кривой растворимости называют точкой Крафта (Т Кр.). Участок кривой аб соответствует равновесию «раствор ПАВ молекулярной дисперсии – кристаллы ПАВ», участок бв - мицеллярной растворимости; при более высоких концентрациях ПАВ растворимость их резко падает и система до высоких температур находится в состоянии жидких кристаллов (область, обозначенная «ж-к»). Причем, в этой области составов в системе образуются кристаллогидраты, о чём свидетельствуют точки максимума на кривой растворимости. Область «А» на диаграмме соответствует гомогенным состояниям раствора ПАВ молекулярной дисперсии, область»М» - мицеллярному раствору. При температурах ниже Т ж-к справа от кривой «абв» находится гетерогенная область существования раствора и кристаллов. Мицеллообразование может происходить только выше температуры Т Кр, ниже точки Крафта растворимость ПАВ мала, меньше, чем ККМ, поэтому в растворах ПАВ, для которых точка Крафта лежит в области повышенных температур (выше 50-800 С), в обычных условиях мицеллообразование не наблюдается.
Точка Крафта - нижний температурный предел мецеллообразования ионогенных ПАВ, обычно она равна 283-293 К; при температурах ниже точки Крафта растворимость ПАВ недостаточна для образования мицелл. Точка помутнения - верхний температурный предел мецеллообразования неионогенных ПАВ, обычные ее значения 323-333 К; при более высоких температурах система ПАВ - растворитель теряет устойчивость и расслаивается на две макрофазы (коацервация). Мицеллы ионогенных ПАВ при высоких т-рах (388-503 К) распадаются на более мелкие ассоциаты-димеры и три-меры (демицеллизация). Для многих ПАВ существуют температурные пределы мицеллообразования. Так, ниже точки Крафта - температуры, соответствующей тройной точке, где в равновесии находятся истинный (молекулярный) раствор ПАВ, мицеллярная фаза (иногда ее наз. квазифазой) и макрофаза ПАВ в твердом кристаллическом или гелеобразном аморфном состоянии существование мицелл термодинамически невыгодно. При температурах ниже точки Крафта в равновесии с насыщенным раствором ПАВ находится только твердая макрофаза, выше точки Крафта — только мицеллы, которые обладают свойствами жидкой фазы. В узкой области температур вблизи тройной точки увеличение концентрации ПАВ может несколько сместить эту точку в сторону более высоких температур. Большинство неионогенных ПАВ не имеет точки Крафта, т. к. вплоть до температуры замерзания водной среды они сохраняют жидкое или жидкообразное состояние. Однако для них есть верхний температурный предел мицеллообразования — точка помутнения. Гидрофильность и, следовательно, растворимость неионогенных ПАВ сильно уменьшается при высоких температуpax вследствие дегидратации. Усиленное помутнение связано с увеличением размера мицелл и расслоением системы на две фазы из-за дегидратации полярных групп мицелл при повышении температуры. Поэтому при постепенном нагревании водные растворы неионогенных ПАВ внезапно мутнеют в узком температурном интервале, а затем расслаиваются на две макрофазы. Точки Крафта и точки помутнения для некоторых мицеллообразующих ПАВ: Ионногенные ПАВ
Неионогенные ПАВ
С приближением к точке помутнения концентрационная область существования мицелл сужается и степень агрегации (число молекул в мицелле) увеличивается. Выше точки помутнения мицеллы в системе отсутствуют. При малых концентрациях (до нескольких %) точка помутнения не зависит от содержания вещества в растворе. Она понижается с уменьшением длины полиэтиленоксидных цепей в молекулах неионогенных ПАВ, а также при добавлении в раствор солей.
Рис. 9. Фазовая диаграмма системы лаурат калия-вода в области разбавленных р-ров. Р-область истинной р-римости в равновесии с твердой фазой: М-область мицеллообразования. 1-кривая истинной р-римости ПАВ; 2-кривая мицеллообразования; 3 кривая перехода мицеллярной системы в гель или жидкокристаллич. фазу; 4-точка Крафта.
ККМ ионогенных ПАВ мало зависит от температуры. Неглубокий минимум вблизи 25 градусов сопоставим с аналогичным минимумом растворимости углеводородов в воде. Неионогенные ПАВ ведут себя по-другому. Обычно обнаруживают монотонное, гораздо более сильное снижение ККМ с увеличением температуры.
Рис.10.Температурная зависимость ККМ додецилсульфат натрия (верхняя кривая) и пента (этиленгликоль) монодецилового эфира (нижняя кривая)
Две группы методов определения ККМ:
Все экспериментальные методы определения ККМ (их известно более 70) разделяют на две группы. К одной группе относят методы, не требующие введения в систему ПАВ - растворитель дополнительных компонентов. Это - построение изотерм поверхностного натяжения s(с) или s(lg с); измерение удельной электрической проводимости (электрического сопротивления) раствора ПАВ или эквивалентной электропроводности электролита l =f( Вторая группа методов измерения ККМ основана на добавлении в растворы дополнительных компонентов и их солюбилизации (коллоидном растворении) в мицеллах ПАВ, которую можно регистрировать с использованием спектральных методов, флуоресценции, и др. Теория мицеллообразования согласно так называемой псевдофазной модели, мицеллообразование рассматривается как процесс, аналогичный фазовому переходу, при котором происходит резкий переход от молекулярно-дисперсного состояния ПАВ в растворителе к ассоциированному в мицеллы ПАВ при ККМ. Мицеллы рассматриваются как предельная высокодисперсная фаза ("псевдофаза"), а ККМ - как такая концентрация, при которой химический потенциал ПАВ в растворе становится равным химическому потенциалу этого вещества, ассоциированного в мицеллы. Концентрация неассоциированных молекул ПАВ, соответствующая истинному раствору, остается постоянной и равной ККМ при любом колличестве ПАВ в растворе. Эта модель удобна для описания ряда макроскопические свойств растворов ПАВ и их зависимостей от концентрации, однако она не позволяет определять размер и форму мицелл. Установлена корреляция между поверхностной (межфазной) активностью ПАВ, его способностью снижать поверхностное и межфазное натяжение (на границе раствора с воздухом или др. жидкостью) и ККМ. Чем больше поверхностная активность ПАВ, тем большая склонность к мицеллообразованию характерна для этого ПАВ и тем ниже ККМ. Согласно этим данным, ККМ - это концентрация, при которой термодинамическая активность неассоциированных молекул ПАВ, его поверхностная активность на различных субстратах достигает предельного значения (в отличие от молекул ПАВ мицеллы поверхностно неактивны). Из ряда экспериментальных зависимостей состав - свойство возможно представление о ККМ как о предельной концентрации, характеризующей свойства мицелл при бесконечном разбавлении системы ПАВ - растворитель.
Степень оксиэтилирования
По аналогии с зависимостью ККМ от длины углеводородного радикала получено уравнение, связывающее ее со степенью оксиэтилирования неионогенных ПАВ:
где A и B – эмпирические постоянные, зависящие от длины углеводородного радикала и температуры; nе – степень оксиэтилирования ПАВ. Данное уравнение справедливо как для индивидуальных ПАВ, так и для смесей полимергомологов лишь до определенного значения степени оксиэтилирования, после чего эта зависимость не соблюдается. Обобщенное выражение, отражающее влияние величины как гидрофильной, так и гидрофобной частей молекул ПАВ:
В нем учитывается известное противоречие в действии оксиэтиленовой цепочки на мицеллообразование – с одной стороны, увеличивающей гидрофильность ПАВ и, следовательно, повышающей ККМ, с другой – приводящей к росту длины молекулы, что должно вызывать снижение ККМ. Для определения изменения в значении ККМ, приходящееся на одну окисиэтиленовую группу, можно использовать выражение:
Анализ этой зависимости позволяет утверждать, что вклад одной оксиэтиленовой группы в изменение ККМ обратно пропорционален квадрату степени оксиэтилирования и поэтому быстро убывает с ростом последней. Увеличение количества метиленовых групп в углеводородном радикале повышает инкремент (вклад) группы окиси этилена. Для инкремента одной метиленовой группы из получаем выражение:
показывающее, что влияние длины углеводородного радикала снижается с ростом оксиэтиленовой цепочки [8].
Электролит
Сильное влияние на ККМ ионных ПАВ оказывают дополнительные вещества, растворяемые в воде вместе с ПАВ, особенно добавление электролитов. Рисунок 3 иллюстрирует влияние добавок электролита (NaCl) на ККМ мицеллообразующего анионного ПАВ с таким же противоионом. Введение инертного электролита приводит к нескольким следствиям: – при добавлении электролита ККМ резко снижается (на один порядок); – с увеличением длины углеводородного радикала в молекуле мицеллообразующего ПАВ возрастает влияние электролита на ККМ; – при высоких концентрациях электролита ККМ гораздо сильнее зависит от длины углеводородной цепи, чем в отсутствии соли; – значения ККМ неионогенных ПАВ от добавления электролитов практически не зависят.
Концентрация водного раствора NaCl: С=0 (1), 10 (2), 30 (3), 100 (4), 300 (5) ммоль/л
Ринусок 13 – Зависимость ККМ (Сккм) растворов алкилсульфатов натрия от числа атомов углерода (n) в углеводородной цепи радикала
Сильное влияние на ККМ оказывает введение спиртов (рисунок 4), которые вызывают значительное снижение ККМ. Спирты менее полярны, чем вода, они распределяются между мицеллами. Чем длиннее углеводородный радикал молекулы спирта, тем выгоднее ее включение в состав мицеллы. При этом, соответственно, уменьшается агрегатное число – число молекул (ионов) ПАВ, необходимое для образования мицеллы.
а – этанол (1), пропанол (2), н–бутанол (3); б – изопентанол (1), н–гексанол (2), н-гептанол (3); в – н–октанол (1), н–нонанол (2), н–деканол (3).
Рисунок 14 – Зависимость критической концентрации мицеллообразования (Сккм) додеканоата калия от концентрации (С) спиртов в водном растворе
рис.5. Влияние добавок хлорида натрия на ККМ алкисульфатов.
На рисунке представлены данные для простейшего, но очень важного случая введения инертного 1:1 – электролита в раствор одновалентного ПАВ. При этом наблюдаются следующие закономерности. 1. Введение соли приводит к сильному понижению ККМ, которое может составлять порядок величины. 2. Эффект умеренный для короткоцепочечных ПАВ и намного сильнее для длинноцепочечных ПАВ. 3. Как следстивие при высоких концентрациях соли изменение ККМ с ростом числа атомов углерода в цепи проявляется сильнее, чем в отсутствие электролита. Скорость изменения ККМ при высоких концентрациях соли становится подобна скорости изменения ККМ для НПАВ. 4. Влияние добавленной соли на величину ККМ сильно зависит от величины зарядов ионов. Наиболее сильно ККМ зависит от заряда вводимого противоиона. 5. Простые соли оказывают слабое влияние на ККМ НПАВ; возможно незначительное уменьшение или увеличение ККМ. Другие низкомолекулярные растворенные вещества вызывают изменение ККМ в разной степени в зависимости от их полярности. Более частым и интересным случаем является понижение ККМ, наблюдаемое при добавлении ряда водорастворимых незаряженных веществ. Степень понижения ККМ зависит от полярности растворимого вещества, что можно убедительно показать на примере простых спиртов. Спирты менее полярны, чем вода и распределяются между объемом раствора и мицеллами. Причем чем выше сродство спирта к мицеллам, тем больше молекулы спирта их стабилизируют. С увеличением длинны алкильной цепи возрастает невыгодность растворения в воде и выгодность локализации молекул спирта в мицеллах. Таким образом, действуют любые другие неионные дифильные вещества, в том числе НПАВ, приводя к понижению ККМ.
Температура
Температура - еще один фактор, влияющий на ККМ. При низких температурах растворимость ионногенных ПАВ в воде очень мала и достижение ККМ невозможно. При
|
||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-09-20; просмотров: 702; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.108 (0.012 с.) |

 В результате этого явления молекулы поверхностного слоя «втягиваются» внутрь жидкости, уменьшая площадь поверхности. При этом число частиц в единице объёма в приповерхностном слое может быть иным
В результате этого явления молекулы поверхностного слоя «втягиваются» внутрь жидкости, уменьшая площадь поверхности. При этом число частиц в единице объёма в приповерхностном слое может быть иным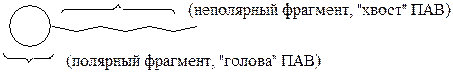
 Для поверхностно-активных веществ с числом углеродных атомов в неполярной группе молекулы от двенадцати и выше наряду с положительной адсорбцией при концентрациях, близких к тем, когда происходит адсорбционное насыщение поверхностного слоя, в объёмной фазе образуются ассоциаты молекул ПАВ. Эти ассоциаты называют мицеллами, а само явление - мицеллообразованием. Ассоциаты ПАВ, образованные в водной среде, называют прямыми мицеллами, а в масляной - обратными. При формировании прямых мицелл углеводородные цепи молекул ПАВ объединяются в компактное углеводородное ядро. Полярные группы обращены в сторону водной фазы и образуют гидрофильную оболочку (рис.3).
Для поверхностно-активных веществ с числом углеродных атомов в неполярной группе молекулы от двенадцати и выше наряду с положительной адсорбцией при концентрациях, близких к тем, когда происходит адсорбционное насыщение поверхностного слоя, в объёмной фазе образуются ассоциаты молекул ПАВ. Эти ассоциаты называют мицеллами, а само явление - мицеллообразованием. Ассоциаты ПАВ, образованные в водной среде, называют прямыми мицеллами, а в масляной - обратными. При формировании прямых мицелл углеводородные цепи молекул ПАВ объединяются в компактное углеводородное ядро. Полярные группы обращены в сторону водной фазы и образуют гидрофильную оболочку (рис.3).
 (ПАВ) m,
(ПАВ) m,
 H H H
H H H RCH2 CH2ö CH2 CH2 ö ········ CH2CH2öCH2 CH2 OH ·····:ОН2
RCH2 CH2ö CH2 CH2 ö ········ CH2CH2öCH2 CH2 OH ·····:ОН2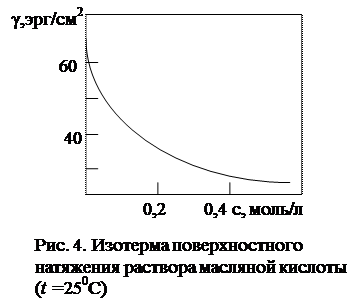
 Количество вещества в мицеллярной форме может превышать его количество в виде молекулярной дисперсии в несколько порядков. Поэтому мицеллы являются своеобразным накопителем вещества для поддержания постоянства концентрации ПАВ в растворе при его расходовании, например в процессах стабилизации золей, эмульсий, при использовании ПАВ как компонентов моющих средств. Поэтому определение значений ККМ практически очень важно, так как помогает создавать оптимальные концентрации ПАВ при их использовании в различных целях.
Количество вещества в мицеллярной форме может превышать его количество в виде молекулярной дисперсии в несколько порядков. Поэтому мицеллы являются своеобразным накопителем вещества для поддержания постоянства концентрации ПАВ в растворе при его расходовании, например в процессах стабилизации золей, эмульсий, при использовании ПАВ как компонентов моющих средств. Поэтому определение значений ККМ практически очень важно, так как помогает создавать оптимальные концентрации ПАВ при их использовании в различных целях.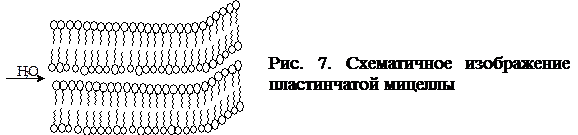
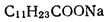
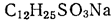
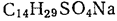


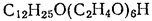

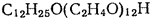

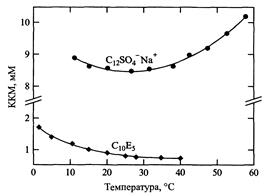 Зависимость свойств НПАВ от температуры вообще отличается от аналогичных зависимостей, установленных для ПАВ других классов. Давление мало влияет на ККМ вплоть до очень высоких значений.
Зависимость свойств НПАВ от температуры вообще отличается от аналогичных зависимостей, установленных для ПАВ других классов. Давление мало влияет на ККМ вплоть до очень высоких значений.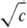 ); измерение частотной зависимости электропроводности электролита в переменном поле (эффект Вина); изучение оптических свойств: показателя преломления раствора, светорассеяния в видимой области спектра; дифракционные методы, основанные на рассеянии рентгеновского излучения или нейтронов (особенно малоугловые измерения); изучение спектров поглощения и спектров ЯМР. Возможно определение ККМ калометрическими методами: по удельной теплоте разбавления, а также по изменению температуры замерзания раствора или понижению давления пара. Наиблее четко ККМ определяется при построении зависимости растворимости ПАВ от величины 1/Т (обратной т-ры). Существует целый ряд методов, основанных на процессах переноса: измерениях коэффициента диффузии или вязкости, изучении электрофоретической подвижности, ультрафильтрации и коэффициента седиментации. Просты и надежны методы потенциометрического титрования и поглощения ультразвука.
); измерение частотной зависимости электропроводности электролита в переменном поле (эффект Вина); изучение оптических свойств: показателя преломления раствора, светорассеяния в видимой области спектра; дифракционные методы, основанные на рассеянии рентгеновского излучения или нейтронов (особенно малоугловые измерения); изучение спектров поглощения и спектров ЯМР. Возможно определение ККМ калометрическими методами: по удельной теплоте разбавления, а также по изменению температуры замерзания раствора или понижению давления пара. Наиблее четко ККМ определяется при построении зависимости растворимости ПАВ от величины 1/Т (обратной т-ры). Существует целый ряд методов, основанных на процессах переноса: измерениях коэффициента диффузии или вязкости, изучении электрофоретической подвижности, ультрафильтрации и коэффициента седиментации. Просты и надежны методы потенциометрического титрования и поглощения ультразвука. , (7)
, (7) . (8)
. (8) . (9)
. (9) , (10)
, (10)





