Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Влияние некоторых гидрофобных лигандов наСодержание книги
Поиск на нашем сайте СПЕКТРАЛЬНЫЕ ХАРАКТЕРИСТИКИ ГЕМОГЛОБИНА На материале статьи Мартынюк В. С., Цейслер Ю. В. Влияние некоторых гидрофобных лигандов на спектральные характеристики гемоглобина. Ученые записки Таврического национального университета им. В. И. Вернадского - Серия «Биология, химия», Том 17 (56). 2004. № 1. С. 150-155. Цель: наблюдать конформационные изменения, приводящие к образованию белковых агрегатов, которые более интенсивно рассеивают свет. Теоретический материал В проведенных ранее исследованиях было установлено, что взаимодействие гидрофобного лиганда хлороформа с гем-содержащим белком - цитохромом С, - при медленном установлении равновесия, в так называемых «мягких» условиях, приводит к формированию «голубого» сдвига в области пика Соре [1]. При этом было обнаружено, что воздействие слабым переменным магнитным полем ускоряет формирование указанного спектрального сдвига, на основании чего был сделан вывод об усилении связывания хлороформа с белками [2,3]. Для объяснения обнаруженных явлений было предложено два альтернативных механизма формирования спектральных сдвигов [1]. Первый предполагаемый механизм основывается на том, что хлороформ, связываясь с белком по гидрофобному механизму, оказывает денатурирующее действие на пространственную структуру молекулы белка, в результате чего открывается доступ полярным молекулам воды к хромофорам, исходно находящимся в гидрофобном окружении внутри белковой глобулы. Данный механизм основывается на общеизвестном факте о разрушающем действии хлороформа на биологические структуры. Второе объяснение спектральных изменений также основывается на представлениях о том, что хлороформ связывается в гидрофобных полостях молекулы белка, однако сильного денатурирующего воздействия такое взаимодействие не оказывает, о чем свидетельствовали незначительное снижение активности фермента – цитохрома С, насыщенного хлороформом [1], а также данные других авторов, полученные на моделях с разными белками и разными углеводородами [3,4,5]. Поэтому в данном случае в качестве причины формирования «голубых» сдвигов предполагали частичную полярность молекулы хлороформа, характеризующуюся не нулевым дипольным моментом. Выяснение механизма взаимодействия гидрофобных низкомолекулярных веществ с белками требует проведения исследований на других белковых моделях использованием разных веществ гидрофобной природы. В связи с этим целью данной работы было проведение сравнительного анализа влияния хлороформа и бензола на спектры оптического поглощения гемоглобина. МАТЕРИАЛЫ И МЕТОДЫ Материалом исследования служил раствор гемоглобина в концентрации 3⋅10-5 М/л, который получен путем гемолиза эритроцитов. В данном исследовании, так же как и в ряде предыдущих работ [1,2], в качестве базовой экспериментальной модели было использовано явление насыщения растворов белка низкомолекулярными лигандами гидрофобной природы. Объектом исследования служил гемоглобин, насыщаемый хлороформом и бензолом. О связывании гидрофобных лигандов с белком судили по характерным изменениям спектра поглощения гемоглобина в области пика Соре. Насыщение растворов гемоглобина хлороформом и бензолом осуществляли в стеклянных бюксах путем наслаивания 3 мл раствора белка на 1,5 мл низкомолекулярного лиганда c последующей инкубацией образцов при комнатной температуре. Инкубацию образцов проводили в течение 2 часов, по окончании которой регистрировали интегральные спектры растворов гемоглобина, насыщенных хлороформом и бензолом. Дифференциальные спектры получали как разность между интегральными спектрами растворов нагруженного углеводородами и нативного белка. Математическую обработку результатов проводили в соответствии с общепринятыми правилами вариационной статистики. Для оценки достоверности различий использовали t-критерий Стьюдента.
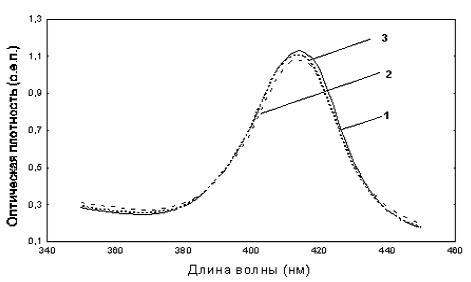
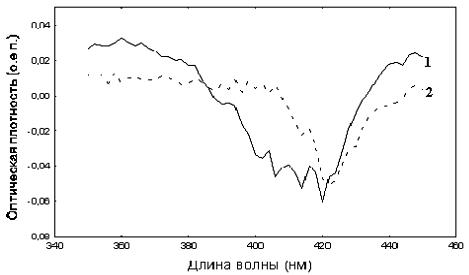
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ На рисунке 1 представлены интегральные спектры поглощения гемоглобина в области поглощения гема 350-450 нм (полосы Соре) с максимумом оптической плотности в контрольных образцах на длине волны λmax = 415 нм. Как видно, насыщение раствора гемоглобина хлороформом приводит к снижению значений оптической плотности в области максимума поглощения в среднем на 5 %. Данное явление в литературе известно как гипохромный эффект [7]. Однако анализ дифференциальных спектров (рис. 2) показал, что на фоне общего снижения оптической плотности имеет место сдвиг пика Соре в область более коротких длин волн, что приводит к формированию «голубого» сдвига на дифференциальном спектре с характерным минимумом в области 418-420 нм. Подобное явление спектрального сдвига основной полосы поглощения гема в коротковолновую область при насыщении белка хлороформом было обнаружено ранее в исследованиях на модели с цитохромом С [1]. Поэтому данные, полученные в настоящем исследовании указывают на общие закономерности процесса взаимодействия хлороформа с белками, в частности с гем-содержащими. Отдельный интерес представляет изучение взаимодействия бензола с гемоглобином, так как бензол, в отличие от хлороформа, характеризуется отсутствием дипольного момента, а также используется в качестве неспецифического лиганда, позволяющего оценить объем гидрофобных полостей белков [8]. Как видно из рисунка 1 при взаимодействии бензола с гемоглобином имеет место менее выраженное снижение оптической плотности в области пика Соре. Одновременно с этим отсутствие выраженного гипохромного эффекта позволяет четко регистрировать смещение полосы Соре в длинноволновую область в виде «голубого» сдвига с минимумом в области 420-422 нм (рис. 2).
Рис 1. Интегральные спектры водных растворов гемоглобина через 2 часа инкубации: 1- растворы чистого белка; 2- растворы белка, инкубированного с хлороформом; 3- растворы белка, инкубированного с бензолом.
Рис. 2. Дифференциальные спектры водных растворов гемоглобина через 2 часа инкубации: 1- растворы белка, инкубированного с хлороформом; 2- растворы белка, инкубированного с бензолом.
Рис. 2. Дифференциальные спектры водных растворов гемоглобина через 2 часа инкубации: 1- растворы белка, инкубированного с хлороформом; 2- растворы белка, инкубированного с бензолом.
Таким образом, полученные данные указывают на то, что при насыщении гемоглобина хлороформом и бензолом происходит изменение параметров среды, окружающей гем. Согласно установившимся представлениям о спектральных сдвигах в биополимерах [7], «голубой» сдвиг связан с переходом хромофора в более полярную среду. Таковой для белков в первую очередь является полярный растворитель – вода. В работе [1] было высказано предположение о том, что одной из причин формирования «голубого» сдвига также может быть образование в гидрофобных полостях белковой молекулы слабополярной фазы хлороформа (дипольный момент молекулы хлороформа µхлороформ = 1.06 D). Однако, в экспериментах с бензолом также регистрируется «голубой» сдвиг, что тоже указывает на усиление взаимодействия гема с полярной фазой. Следует заметить, что молекула бензола связывается в гидрофобных полостях белковых молекул, но имеет нулевой дипольный момент. Основываясь на этих фактах, можно сделать вывод о том, что в обоих случаях «голубой» спектральный сдвиг в исследуемых модельных условиях формируется в результате усиления взаимодействия гема с полярными молекулами воды. Об этом также свидетельствует сходство основных параметров дифференциальных спектров (табл.). Связывание углеводородов и их производных в гидрофобных полостях белковых молекул индуцирует изменения пространственной структуры макромолекулы и тем самым открывает доступ молекулам воды к внутренним гидрофобным полостям, в которых располагаются порфириновые структуры. Таблица
|
||
|
Последнее изменение этой страницы: 2016-09-20; просмотров: 359; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.108 (0.007 с.) |