Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Генетический контроль развитияСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Очевидно, что генетический контроль развития существует, так как набор генов, получаемый организмом при оплодотворении, обеспечивает развитие из зиготы особи совершенно конкретного вида. Каким образом гены определяют процесс развития? Это центральный и очень сложный вопрос, некоторые аспекты которого уже удалось прояснить, но для всеобъемлющего и убедительного ответа на него данных явно недостаточно. Главный прием изучения генетики индивидуального развития - использование мутаций. Выявив мутации, изменяющие онтогенез, проводят сравнение фенотипов мутантных особей с нормальными. Это помогает понять, как данный ген влияет на развитие. В настоящее время в биологии развития используется ряд новых методик, среди которых, например, техники knock out (делеции гена) или knock down (селективного подавления экспрессии гена с помощью мРНК-антагониста), метод FISH (применение меченых фрагментов ДНК для выявления определенных молекул мРНК и их распределения в клетке и зародыше). Использование этих и ряда других подходов позволяет выяснить помимо функции генов в развитии, время и место их действия, определить наличие взаимодействия между генами и его характер. Дифференцировка клеток и опосредованная ею постепенная прогрессирующая последовательная и закономерная дифференциация частей развивающегося зародыша осуществляется, как было сказано ранее, благодаря дифференциальной активности генов (см. п. 8.2.5). Так как у эукариот регуляция экспрессии генов носит многоуровневый характер, то «включение» того или иного гена и его транскрипция еще не означают выхода кодируемого им признака в клеточный фенотип. Процесс формирования большинства признаков очень сложен и зависит от активности продуктов не одного, а многих генов, градиента распределения генных продуктов в развивающемся зародыше, а также от особенностей их взаимодействия друг с другом. Анализ генетического контроля затрудняется несколькими моментами. Прежде всего, тем, что роль генов неодинакова. Часть их экспрес-сируется практически во всех клетках, определяя жизненно важные функции и отвечая, например, за синтез тРНК или ДНК-полимеразы, без которых невозможно функционирование ни одной клетки - гены «домашнего хозяйства». Другая часть - гены «роскоши» - непосредственно участвует в детерминации, дифференцировке и морфогенезе, т.е. функция их более специфическая, и их активность проявляется в определенных клеточных популяциях (см. п. 3.1.3). Для анализа генетического контроля необходимо, кроме того, знать место первичного действия конкретного гена, что позволяет различать случаи относительной, или зависимой, плейотропии от прямой, или истинной, плейотропии. В случае относительной плейотропии, как, например, при серповидноклеточной анемии, существует одно первичное место действия мутантного гена - гемоглобин в эритроцитах, а все остальные наблюдаемые при ней симптомы, такие как нарушение умственной и физической деятельности, сердечная недостаточность, местные нарушения кровообращения, увеличение и фиброз селезенки и многие другие, возникают как следствие аномального гемоглобина. При прямой плейотропии все разнообразные дефекты, возникающие в различных тканях или органах, вызывает непосредственное действие продукта одного и того же гена именно в этих разных местах. Если рассматривать развитие с точки зрения реализации генетической информации, то оно представляется как многоступенчатый динамический процесс с постоянно меняющимися спектрами экспрессирующих-ся генов в зависимости от стадии онтогенетической дифференцировки. Важно понимать, что в каждый момент развития число вовлеченных в этот процесс генов очень велико - многие сотни и даже тысячи, которые располагаются на разных хромосомах или/и в пределах одной хромосомы. Это предполагает очень четкую координацию их экспрессии на протяжении всего онтогенетического развития и существования уже сформированного дифференцированного организма. Таким образом, становится понятным применение термина «программа развития», что подразумевает наличие строго упорядоченной и скоординированной во времени и пространстве экспрессии огромного числа генов. Все больше экспериментальных подтверждений получает концепция, согласно которой продукты генов предшествовавших стадий развития активируют новые генные наборы и/или репрессируют отдельные гены в последующие стадии. Такой тип взаимодействия генов определяют как каскадный, что подчеркивает преемственность в экспрессии генов ранних и более поздних стадий (рис. 8.39).
Рис. 8.39. Каскадное взаимодействие генов
Преемственность генов в развитии может быть продемонстрирована на примере эмбриогенеза плодовой мушки дрозофилы. Ее эмбриональное развитие регулируется иерархической системой из трех классов генов: генов с материнским эффектом, генов сегментации и гомео-зисных генов. Гены с материнским эффектом активны в организме самки. Их продукты запасаются в яйце и уже после оплодотворения определяют пространственные оси эмбриона: продольную (передне-заднюю) и дорсально-вентральную оси. К этому классу генов относятся bicoid и nanos, о которых речь шла в разделе 8.2.6. Продукты генов с материнским эффектом, как правило, являются ДНК-связывающими белками, которые в качестве факторов транскрипции активируют или блокируют экспрессию генов зародыша, в том числе генов сегментации. Продукты генов сегментации - также транскрипционные факторы, они контролируют образование сегментов, из которых состоит насекомое. Их подразделяют на несколько групп: gap -гены, pair-rule гены и гены сегментарной полярности, образующих согласованную систему, благодаря активности которой эмбрион подразделяется на все более мелкие сегменты. Сегментационные гены последовательно активируются в процессе индивидуального развития (рис. 8.40). gaр-гены (от англ. gap - брешь). Они экспрессируются до 11-го деления зиготы и «делят» зародыш на широкие полосы. Их транскрипция стимулируется продуктами генов с материнским эффектом. Мутации генов группы gap приводят к потере нескольких прилежащих друг к другу сегментов тела, в результате чего в рисунке сегментации образуется пустота, или брешь. На фоне специфического распределения продуктов gaр-генов и под их влиянием активируются pair-rule гены (или гены «правила парности»), которые «дробят» зародыш на так называемые парасегменты - каждый из них по ширине равен двум возникающим позже сегментам тела личинки. Мутации в группе генов pair-rule, экспрессируе-мых в период 11-12-го деления, приводят к потере каждого второго сегмента. Продукты pair-rule генов, в свою очередь, запускают экспрессию генов сегментарной полярности. Их активность в зародыше дрозофилы выявляется впериод 13-го деления. Эти гены детерминируют границы конкретных сегментов зародыша и создают пространственную дифференцировку внутри каждого сегмента. У мутантов по генам сегментной полярности определенные части сегментов заменены структурами, представляющими зеркальные отражения прилежащих половин сегментов.
Рис. 8.40. Последовательное уточнение судьбы клеток в течение эмбриогенеза у дрозофилы: а - продукты генов с материнским эффектом; б - продукты gap-генов; в - продукты pair-rule генов; г - продукты генов сегментарной полярности Все гены сегментации, последовательно активируемые в ходе эмбриогенеза, оказывают друг на друга взаимные влияния через кодируемые ими продукты (рис. 8.41). Следствием их экспрессии является активация гомеозисных генов. Это большой класс генов, которые считаются ключевыми в развитии и обеспечивают качественную спецификацию сегментов, т.е. определяют, какой конкретно сегмент - головы, груди или брюшка - и с какими структурами должен быть сформирован.
Рис. 8.41. Схема взаимодействия генов, контролирующих сегментацию в раннем развитии дрозофилы
Название этой группы генов происходит от термина «го-меозис» который ввел в 1894 г. один из классиков генетики У. Бэтсон. Под «гомеозисом» он понимал превращение одной части тела в другую. Мутации по гомеозисным генам могут изменить структуру какого-либо сегмента или его придатков, например вызвать образование на голове мухи конечностей вместо антенны или аристы (рис. 8.42), но не изменяют количество или полярность сегментов. Гомеозисные гены относятся к селекторным генам, т.е. таким, которые активируют или, напротив, подавляют другие гены, продукты которых уже прямо вовлечены в процесс формирования различных органов. Гомеозисные гены кодируют белки - факторы транскрипции, скоординированно регулирующие транскрипцию генов начальных звеньев генетических фор мообразовательных программ. Их белки-продукты, в свою очередь, влияют на экспрессию большого числа нижестоящих генов-мишеней, участвующих в реализации генетической программы образования конкретной структуры или органа. Таким образом, гомеозисные гены определяют выбор дифференцировки целого участка тела развивающегося организма. Белковые продукты гомеозисных генов содержат специфическую последовательность из 60 остатков аминокислот - гомеодомен, обладающую высоким сродством к некоторым последовательностям нуклеотидов ДНК, с помощью которой они связываются с этими сайтами ДНК и таким образом влияют на экспрессию других генов. Так, у дрозофилы белковый продукт гомеозисного гена Antennapedia активирует гены, которые определяют структуру второго грудного сегмента, содержащего ноги и крылья, и репрессирует гены, вовлеченные в формирование глаз и антенн. Гомеодомен кодируется последовательностью из 180 п.н., называемой гомеобокс, которую содержит каждый из гомеозисных генов. Гомеобокс впервые был обнаружен в составе генов, контролирующих развитие, в частности, в составе гомеозисных генов, у дрозофилы. Однако многие гены, содержащие гомеобокс, не являются гомеозисными. Таким образом, гомеобокс - это особая последовательность нуклеотидов, а гомеозисность - это потенциальная возможность образования гомеозисной мутации.
Рис. 8.42. Гомеозисная мутация у дрозофилы: а - норма; б - муха с мутацией. 1 - глаз; 2 - ариста; 3 - антенна; 4 - ротовой аппарат
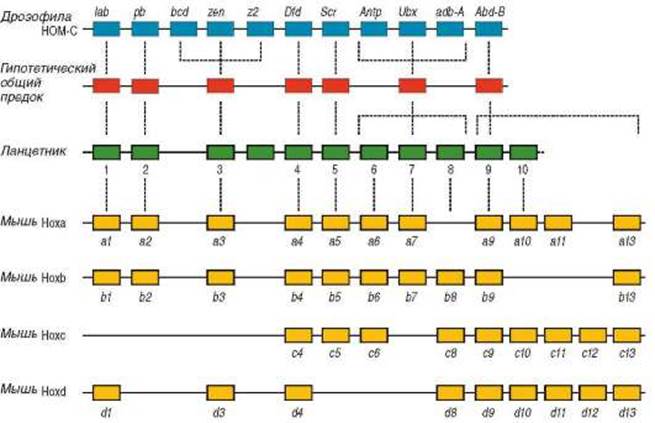
Гомеозисные гены дрозофилы образуют два комплекса, локализованные на третьей хромосоме. Гены каждого комплекса в хромосоме расположены очень близко друг к другу, формируя кластеры. Комплекс Antennapedia (ANT-C), содержит 5 генов (labial (lab), Deformed (Dfd), Sex comb reduced (Scr) и Antennapedia (Antp)) и определяет развитие головы и передних грудных сегментов мухи. Второй комплекс - Bithorax, включающий 3 гена (Ultrabithorax (Ubx), AbdominalA (abdA) и Abdominal's (abdB)), контролирует развитие задних грудных (торакальных) и брюшных сегментов (рис. 8.43). Мутации в гене Antennapedia приводятк образованию конечностей на голове мухи вместо антенн. Мутация, подавляющая активность гена Ultrabithorax, приводит к образованию второй пары крыльев вместо жужжалец.
Рис. 8.43. Гомеозисные гены дрозофилы
После того как были открыты и изучены гомеозисные гены дрозофилы, сходные гены были найдены у всех других животных от стрекающих, например медуз, до человека. Число кластеров гомеозисных генов в ходе эволюции менялось (рис. 8.44). В различных таксонах гомеозисным генам были даны разные названия, что привело к путанице в номенклатуре. Так, в случае некоторых первичноротых гомеозисные гены, как было показано у дрозофилы, составляют два кластера Antennapedia и Bithorax, которые вместе называют HOM-C (гомеозисный комплекс, Homeotic Complex). В случае вторичноротых (в частности, у человека и большинства других позвоночных) гомеозисные гены называют Hох-генами и в геноме выявлено четыре их кластера: HoxA, HoxB, HoxC и HoxD. У первичноротых гомеозисные гены также часто называют Hox-генами, несмотря на то что это и не вполне верно. Хотя гомеозисные гены позвоночных являются копиями генов пер-вичноротых, эти копии не идентичны. В результате накопления мутаций белки, кодируемые ими, выполняют различные функции. Кроме того, у разных групп позвоночных некоторые гены утрачены или дуплициро-ваны (рис. 8.45). Несмотря на изменения, накопленные в ходе эволюции в гомео-зисных генах животных, принадлежащих к разным таксонам, последовательность нуклеотидов в их гомеобоксах высоко консервативна. Функциональная равнозначность кодируемых ими белков, содержащих гомеодомен, может быть доказана тем фактом, что развитие мухи с соответствующими гомеозисными генами курицы протекает нормально. Несмотря на то что общий предок курицы и мухи существовал около 670 млн лет назад, гомеозисные гены кур аналогичны таковым у мух до такой степени, что могут заменить друг друга.
Рис. 8.44. Изменение числа кластеров гомеозисных генов в эволюции у некоторых групп животных
Рис. 8.45. Отличия кластеров гомеозисных генов у животных У человека 39 гомеозисных генов, сгруппированных, как сказано выше, в 4 кластера (семейства) - А, В, С и D (рис. 8.46). Внутри каждого кластера наблюдаются значительные вариации в кодируемых аминокислотных последовательностях, но последовательности, кодируемые паралогами (т.е. генами, занимающими одно и то же положение в каждом кластере), очень похожи. Так, например, А10 более похож на С10 и D10, чем на А9 или А11. Это означает, что паралоги несут очень похожие, но не обязательно идентичные функции.
Рис. 8.46. Экспрессия гомеозисных генов в эмбриональном развитии дрозофилы и человека
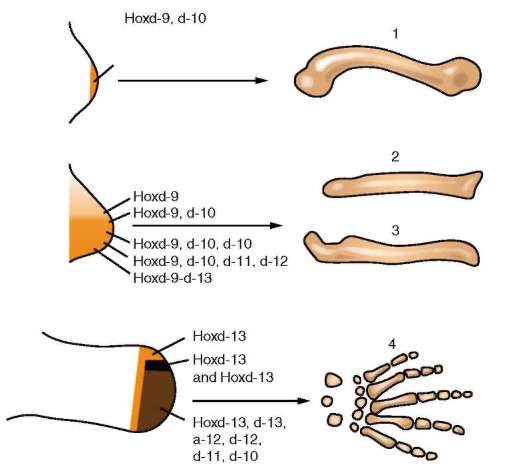
Было бы ошибкой думать, что определенный Hох-ген, связываясь с регуляторными последовательностями 10-20 других генов, включает их или выключает. В реальности этот ген в разных частях эмбриона может транскрибироваться с различными скоростями, благодаря альтернативному сплайсингу он может кодировать целое семейство белков. Белки-продукты этого гена взаимодействуют с несколькими другими транскрипционными факторами и совместно регулируют экспрессию конкретного гена-мишени. Вследствие этого общий эффект продуктов данного Hох-гена может варьировать в широких пределах. Гомеозисные гены интересны еще и тем, что наблюдается отчетливая (хотя и не абсолютная) корреляция между их положением вдоль хромосомы (от 3' к 5' концу цепи ДНК) и их экспрессией от переднего к заднему концу тела зародыша: гены, расположенные ближе к 3'-концу цепи ДНК, экспрессируются ближе к переднему концу тела (см. рис. 8.46). Эта закономерность, названная коллинеарностью, прослеживается у многих представителей животного мира от пресноводной гидры до млекопитающих. Она указывает на общность эволюционного происхождения передне-задней оси у всех представителей животного царства. Исследования по расшифровке геномов разных животных, выполненные в течение последних лет, показали, что упорядоченность расположения Hox-генов в хромосомах отнюдь не является общим признаком. Выяснилось, что, например, у иглокожих первые три Hox-гена находятся прямо перед последним четырнадцатым, а начинается кластер с пятого гена. У нематод и оболочников Hox-гены вообще не образуют кластеров, и последовательность их расположения в хромосомах не соблюдается вовсе. Это свидетельствует о том, что в ряде случаев порядок экспрессии Hox-генов в различных частях эмбриона не соответствует порядку расположения этих генов в хромосоме. Таким образом, можно сделать вывод, что последовательность включения Hox-генов зависит, помимо их места на хромосоме, еще от каких-то дополнительных факторов. Установлено также, что Hox-гены не экспрессируются строго один за другим в прилежащих участках тела. Часто отмечается транскрипция сразу с нескольких Hox-генов в одном и том же участке зародыша - перекрывание экспрессии, и при этом в задних районах Hox-гены более активны, чем в передних (рис. 8.47). Стали известны некоторые детали регуляции самих Hox-генов. Между этими генами расположены участки ДНК, прежде считавшиеся бессмысленными. Как оказалось, они кодируют короткие молекулы ре-гуляторных РНК - микроРНК. Некоторые из них усиливают или ослабляют экспрессию Hox-генов, другие косвенно влияют на работу иных транскрипционных факторов. В экспериментах показано, что эти ми-кроРНК могут регулировать как соседний, так и отдаленные Hox-гены. Выявлено также, что у многих животных, включая человека, большинство мРНК Hox-генов предсинтезированы уже в созревающей яйцеклетке и предимплантационных зародышах. Преформированный набор мРНК многих Hox-генов сохраняется в зародыше до начала гаструляции и нейруляции. Предобразованные мРНК у млекопитающих выявлены на стадии регионализации нервной пластинки. Таким образом, показано, что в онтогенетическом развитии Нох-гены, как и ряд других генов, функционируют с опережением. Кодируемые Нох-генами белки, подобно многим другим транскрипционным факторам, участвуют в регуляции не только раннего развития, но функционируют также и на более поздних его этапах в клетках ряда органов и тканей. Так, было установлено, что появление определенных белков кластера НохС в нервных клетках спинного мозга направляет их дифференциров-ку в соответствии с функциями конкретного участка мозга. При анализе места и времени появления каждого белка из кластера НохС в отдельных двигательных нейронах было выполнено подробное картирование локализации этих нервных клеток в передних рогах спинного мозга. В результате оказалось, что внутри каждого фрагмента, обеспечивающего иннервацию отдельной части организма, например конечности, имеется по крайней мере 50 различных типов нейронов. Для каждого типа выявлена четкая схема экспрессии Hox-генов, в соответствии с которой осуществляется дифференцировка двигательных нейронов и их соединение с иннервируемыми мышцами. Первоначально экспрессия генов кластера HoxC приводит к подразделению групп нейронов по участкам позвоночного столба, затем определяется, с какими мышцами - на внешней или на внутренней стороне конечности - будут связаны эти группы, и, наконец, выделяются популяции нервных клеток, связанные с конкретными мышцами. Эти результаты получили подтверждение в экспериментах с изменением схемы экспрессии Hox-генов в нейронах спинного мозга, что привело к образованию нервных клеток другого типа, которые стали связываться с другими мышцами.
Рис. 8.47. Активность Hox-генов при формировании отделов конечности: А-В - последовательные стадии развития конечности; 1 - плечевая кость, 2 -лучевая кость; 3 - локтевая кость; 4 - пястные кости и пальцы
Стабильность дифференцированного состояния - краеугольный камень развития. Установленное на ранних этапах, оно должно сохраняться на протяжении всего онтогенеза. В поддержании достигнутого благодаря экспрессии гомеозисных генов дифференцированного состояния клеток участвуют два генных комплекса: Polycomb и Trithorax. Впервые они были обнаружены у дрозофилы. Исследования показали, что эти генные комплексы сохраняют сформированный рисунок экспрессии гомеозисных генов, локально изменяя конформацию хроматина. Белки генов группы Polycomb подавляют экспрессию, а продукты генов Trithorax, напротив, сохраняют активность транскрипции гомео-зисных генов. К настоящему времени установлено, что эта система регуляции активности гомеозисных генов очень консервативна в процессе эволюции. Для всех генов комплексов Polycomb и Trithorax дрозофилы существуют гомологичные гены у млекопитающих. Более того, найдены и сходные регуляторные элементы, взаимодействуя с которыми белки, кодируемые этими комплексами, предотвращают изменения транскрипционной программы, характерной для конкретного типа клеток. Предполагается, что эта система регулирует активность и многих других генов, помимо гомеозисных, что свидетельствует о фундаментальности данного онтогенетического механизма. Установление роли гомеозисных генов в развитии - крайне непростая задача. Очевидно, что любая их мутация, которая существенно влияет на функцию ключевых в раннем эмбриогенезе транскрипционных факторов, будет летальной, и, вероятнее всего, эмбрион погибнет вскоре после оплодотворения. Это делает практически невозможным обнаружение такой мутации. Поэтому вниманию генетиков доступны лишь те из них, которые затрагивают более поздние стадии эмбриогенеза и имеют относительно умеренное влияние на развитие. У человека идентифицированы лишь немногие изменения в этих генах. Показано, что мутации гена Нохd13 могут вызывать синполидактилию (наличие более пяти сросшихся пальцев, рис. 8.48), гена Нохa13 - приводят к формированию синдрома кисть-стопа-гениталии (аномальные большие пальцы, небольшие ступни, удвоение женских половых органов).
Рис. 8.48. Синполидактилия
Мутации или делеции генов Hoxd3, НохЬ4, Hoxd9, проявляются тяжелыми аномалиям скелета. Парная делеция генов Ноха2 и Ноха3 вызывает дефекты развития костно-мышечной системы лица, шеи, аномалии развития тимуса, щитовидной железы. Другая группа транскрипционных факторов, важных для раннего развития, - белки семейства Рах. Гены, их кодирующие, также принадлежат к семейству гомеобокссодержащих. Эти белки действуют как регуляторы органогенеза, а кроме того, необходимы для поддержания плюрипотентности (мультипотентности) популяций стволовых клеток, т.е. их способности дифференцироваться во множество специализированных типов клеток. Особенность белков Pax - наличие последовательности, состоящей из 128 аминокислотных остатков, которая образует два района для связывания с ДНК («раired box» - Рах). Считают, что эти белки связываются с энхансерными последовательностями ДНК и модифицируют таким образом транскрипционную активность ряда «подчиненных» генов. У человека, и вообще у млекопитающих, имеется девять генов Рах. Гены Рах1 и Рах9 экспрессируются при развитии позвоночного столба, зачатков конечностей и тимуса, где они демонстрируют перекрывающиеся рисунки экспрессии. У мышей мутации в генах Pax1 и Pax9 вызывают дефекты скелета, а мутации в Pax9 могут также приводить к отсутствию тимуса и паращитовидной железы. У человека мутации гена Pax9 вызывают олигодонтию - неразвитие шести и более постоянных зубов. Ген Pax3 экспрессируется у млекопитающих в дорзальной части нервной трубки - области, в которой формируются мигрирующие клетки нервного гребня. Мутации данного гена приводят к нарушению развития этих клеток и появлению у человека болезни Гиршспрунга (отсутствие нервных клеток в мышечном и подслизистом сплетениях толстой кишки и нарушение вследствие этого ее перистальтики) и синдрома Ва-арденбурга (глухота, частичный альбинизм и другие нарушения). Совместная экспрессия генов Pax3 и Pax7 отмечается в предшественниках мышечных клеток, что необходимо для их дифференцировки в клетки (волокна) скелетных мышц. Функция гена Pax6 является ключевой в развитии глаз и носа. У людей, гетерозиготных по мутации этого гена, может наблюдаться ани-ридия (отсутствие радужной оболочки глаза) и катаракта (помутнение хрусталика). Полагают, что транскрипционный фактор, кодируемый геном Pax2, участвует в процессе дифференцировки клеток почек. Белок гена Pax5 известен как специфический транскрипционный фактор В-лимфоцитов. Считают, что его синтез необходим в ходе нейрогенеза, сперматогенеза и дифференцировки В-лимфоцитов. Как и гомеозисные гены, гены, сходные с Pax, также обнаруживаются в геномах животных разных таксонов. Так, ген дрозофилы eyeless близок к гену Pax6 млекопитающих и участвует в регуляции развития глаз. Замена гена eyeless у дрозофилы соответствующим мышиным геном приводит к формированию у мухи нормального глаза, что указывает на консервативность структуры этих генов. Важным результатом данного эксперимента является тот факт, что при инициации геном мыши развивается глаз, характерный для дрозофилы. Это свидетельствует о том, что гены Pax6 и eyeless лишь «запускают» программу формирования структуры, в реализации которой участвуют многие другие гены организма, которые и определяют, какой конкретно глаз будет сформирован. По расчетам, в процессе формирования глаз у животных принимает участие примерно 2500 генов, действующих каскадно. Более того, активируя ген eyeless в необычном месте в организме дрозофилы, получали развитие глаза на брюхе, на лапках, на крыле и в любом другом месте (рис. 8.49).
Рис. 8.49. Формирование глаза дрозофилы в атипичных местах под действием гена eyeless: 1 - на лапе; 2 - на антенне
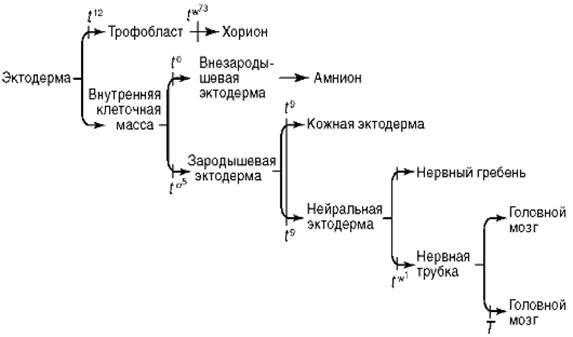
Таким образом, выявляется некоторая общая закономерность генетической регуляции индивидуального развития. Оно во многом определяется иерархией генов, кодирующих транскрипционные факторы. Эти белки, инициируя одну стадию развития, влекут за собой активацию других генов и синтез новых транскрипционных факторов, которые регулируют следующую стадию, активируя очередную группу генов, но оказывая при этом регулирующее влияние и на предыдущие. В результате формирование конкретных структур управляется целыми генными сетями. Ключевые гены, инициирующие специфическую программу развития определенной структуры или органа, т.е. активирующие конкретную генную сеть (сетевой принцип генетической регуляции), образно названы «гены-господа» или «мастер-гены», а запускаемые ими структурные гены-мишени, образующие каскад, - «гены-рабы». Примерами скоординированной экспрессии генов, приводящей к формированию той или иной морфологически сложной структуры, могут служить программа развития поджелудочной железы, запускаемая геном pdf-1, развития селезенки благодаря активации гена Нох11, развития сердца, инициируемая геном Crypto. Известны «гены-господа» и для формирования отдельных зародышевых листков. Так, мутация гена casanova блокирует развитие энтодермы, а генов Brachiury и zeta-globin - мезодермы. Наконец, считают, что и специализированные ткани, и типы клеток формируются по «разрешающему сигналу» соответствующих ключевых генов. Таким геном, например, для созревания альвеолярного эпителия является Wn17. Весьма интересный пример генетического контроля развития - функционирование сложного гена T-локуса у мышей (см. п. 4.3.3.2). Он представлен 117 аллелями, большинство из которых рецессивны и обозначаются буквой t с дополнительными индексами. Весь ряд рецессивных аллелей t разделяется на восемь групп, которые могут быть комплементарны друг другу, т.е. гетерозиготные зародыши, в генотипе которых находятся аллели t из разных групп, не погибают. В гомозиготном состоянии аллели каждой из восьми групп обусловливают разного рода дефекты (рис. 8.50). Первичное нарушение, лежащее в основе всех эффектов, всего лишь одного локуса пока не выяснено. Однако очевидно, что локус T играет первостепенную роль на самых ранних стадиях развития и в морфогенезе эктодермы мышиного зародыша, и организма в целом. Известны также пять доминантных мутаций T -локуса. Один из таких доминантных аллелей - Brachiury, о котором было сказано выше. Таким образом, генетический контроль онтогенеза очевиден. Многочисленные исследования последних лет добавили многое для его понимания, но до формирования целостного представления еще очень далеко. Однако уже сейчас ученые пришли к выводу о существовании ряда универсальных закономерностей генетической регуляции индивидуального развития. Они обсуждались в данном разделе. Одна из них - «опережающее» функционирование генов в ходе онтогенеза. Как отмечалось, многие продукты синтезируются в развивающемся зародыше заранее, задолго до того, как они будут востребованы. Это, в частности, вещества, которые участвуют в разметке плана строения организма (продукты генов сегментации, гомеозисных генов), в осуществлении эмбриональной индукции (индуцирующие вещества и их ингибиторы). Другая закономерность - существование генных сетей в развитии органов или структур - каскадов структурных генов, часто инициируемых активацией одного ключевого гена и организованных по иерархическому принципу. Другими словами, основу индивидуального развития составляет взаимодействие генов, их системное, а не автономное функционирование (см. независимое наследование признаков Г. Менделя - менделизм классической генетики, сальтаторный характер генных мутаций, феномен ге-нокопирования в практике медико-генетического консультирования).
Рис. 8.50. Аллели локуса T мыши, блокирующие развитие производных эктодермы на различных стадиях Средовой контроль развития Средовые факторы оказывают значительное влияние на процессы развития. В эмбриогенезе млекопитающих выделяют три группы таких факторов (см. п. 4.3.1.1). Во-первых, это среда самого развивающегося организма, во-вторых, - среда материнского организма и, наконец, внешняя среда в обычном ее понимании (внеорганизменная среда). Приведем примеры влияния каждой группы. Воздействие среды самого развивающегося зародыша можно наблюдать при дифференциации глазного пузыря. В его стенке, прилегающей к покровному эпителию, затруднено снабжение тканей кислородом и происходит накопление продуктов метаболизма. Именно это и определяет его преобразование в сетчатку. В стенке пузыря, обращенной к мозгу, продукты жизнедеятельности активно удаляются, и кислород имеет свободный доступ к ткани, обеспечивая ее дифференциацию в пигментную оболочку. Изменение гормонального статуса развивающегося организма также влияет на ход эмбриогенеза. При сравнении трех линий мышей, отличающихся по уровню гормона коры надпочечников - кортизола, было выявлено его воздействие на темпы роста небных отростков верхней челюсти и, таким образом, на формирование твердого неба. У одной из линий несращение твердого неба наблюдалось в 100% случаев, у второй - в 17% случаев. У гибридной линии, имеющей промежуточные показатели уровня кортизола, с расщелиной твердого неба рождалось 40% мышат. Вторая группа средовых факторов, влияющих на организм на протяжении всего периода эмбрионального развития, отражает состояние материнского организма. Так, недостаток витаминов группы В у матери может быть причиной дефектов в строении печени и сердца плода, витамина С - дефектов нервной системы. Заболевание матери краснухой в начале беременности приводит к возникновению пороков сердца, органов зрения и слуха, нарушению срастания верхнечелюстных и небных костей. В случае недостаточности у матери функции щитовидной железы происходит гипертрофия (чрезмерное увеличение) ее у эмбриона, что ведет к нарушению деятельности этой железы у ребенка в постна-тальном онтогенезе. Следующий пример характеризует влияние последней из указанных групп - факторов внеорганизменной среды. К подобным воздействиям может быть отнесен, например, недостаток кислорода во вдыхаемом воздухе в условиях высокогорья. В этом случае развивающийся организм не получает достаточно кислорода для осуществления метаболических процессов (гипоксия), следствием чего могут быть тяжелые поражения головного мозга, а в некоторых случаях и гибель. Таким образом, совершенно очевидно существование генетического и средового контроля развития, однако результат онтогенеза особи зависит не только от влияния этих факторов, но и от действия системных интегрирующих механизмов развития и способности к эмбриональной регуляции, присущей самому зародышу.
|
||||
|
Последнее изменение этой страницы: 2016-07-15; просмотров: 1745; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.119.118.237 (0.011 с.) |