Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Основные концепции в биологии индивидуального развитияСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте В предыдущих главах были рассмотрены генетические закономерности, определяющие формирование определенного фенотипа, изложено основное содержание стадий онтогенеза, последовательно и закономерно сменяющих друг друга. Все эти сведения не дают, однако, ответа на вопрос, почему и каким образом генотип реализуется в фенотип в виде тех или иных клеточных и системных процессов, в виде сложных пространственных и упорядоченных во времени онтогенетических преобразований. При сравнении зиготы и половозрелой особи, которые, по сути, являются двумя разными онтогенетическими стадиями существования одного и того же организма, обнаруживаются очевидные различия, касающиеся по крайней мере размеров и формы. Начиная с XVII в. ученые пытались познать и объяснить процессы, приводящие к этим количественным и качественным изменениям особи. Первоначально возникла гипотеза, согласно которой онтогенез рассматривали лишь как рост расположенных в определенном пространственном порядке предсуществующих структур и частей будущего организма. В рамках этой гипотезы, получившей название преформизма, каких-либо новообразований или преобразований структур в индивидуальном развитии не происходит. Логическое завершение идеи преформизма заключается в допущении абсурдной мысли о «заготовленности» в зиготе и даже в половых клетках прародителей структур организмов всех последующих поколений, как бы вложенных последовательно наподобие деревянных матрешек. Альтернативная концепция эпигенеза была сформулирована в середине XVIII в. Ф.К. Вольфом, впервые обнаружившим новообразование нервной трубки и кишечника в ходе эмбрионального развития. Индивидуальное развитие стали связывать целиком с качественными изменениями, полагая, что структуры и части организма возникают как новообразования из бесструктурной яйцеклетки. В XIX в. К. Бэр впервые описал яйцо млекопитающих, в том числе и человека, а также зародышевые листки и обнаружил сходство плана строения зародышей различных классов позвоночных - рыб, амфибий, рептилий, птиц, млекопитающих. Он же обратил внимание на преемственность в этапах развития - от более простого к более сложному. Бэр рассматривал онтогенез не как предобразование, не как новообразование структур, а как их преобразование, что вполне согласуется с современными представлениями. Выяснение конкретных клеточных и системных механизмов таких преобразований составляет основную проблему современной биологии развития. Увеличение массы тела особи, т.е. ее рост, и появление новых структур в ходе ее развития, называемое морфогенезом, нуждаются в объяснении. Рост и морфогенез подчиняются законам, которые обусловливают приуроченность конкретных процессов онтогенеза к определенному месту зародыша и периоду эмбриогенеза. Отдельные стадии индивидуального развития отличаются также определенной скоростью протекания с характерным качественным и количественным результатом. Биология развития изучает пути генетического контроля индивидуального развития и особенности реализации генетической программы в фенотип в зависимости от условий. Под условиями понимают различные внутриуровневые и межуровневые процессы и взаимодействия: внутригеномные (внутригенетические), клеточные, межклеточные, тканевые, внутриорганные, организменные, популяционные, экологические. Можно сказать, что усилия исследователей в области биологии развития концентрируются вокруг стержневой проблемы генетической предопределенности и лабильности онтогенетических процессов, что в известном смысле на ином уровне познания возвращает нас к идеям преформизма и эпигенеза (неопреформизма и эпигенеза). Не менее важны исследования конкретных онтогенетических механизмов роста и морфогенеза. К ним относятся следующие клеточные механизмы: пролиферация, или размножение клеток, миграция, или перемещение клеток, сортировка клеток, их запрограммированная гибель, дифференцировка клеток, контактные взаимодействия клеток (индукция и компетенция), дистантные взаимодействия клеток, тканей и органов (паракринные, гуморальные и нервные механизмы интеграции). Все эти процессы носят избирательный характер, т.е. протекают в определенных пространственно-временных рамках с определенной интенсивностью, подчиняясь принципу целостности развивающегося организма. Биология развития стремится выяснить степень и конкретные пути контроля со стороны генома и одновременно уровень автономности различных процессов в ходе онтогенеза. Элементарные клеточные механизмы онтогенеза В онтогенезе особи происходят сложнейшие преобразования: осуществляется дифференциация частей развивающегося организма (морфогенез), формирование его внешней и внутренней структуры (морфогенез), рост. В основе этих преобразований лежат клеточные и системные механизмы развития. К клеточным механизмам относят размножение, перемещения, избирательную сортировку, дифференцировку, программированную гибель клеток. Важной особенностью действия этих механизмов является их избирательность, которая означает, что тот или иной механизм реализуется в определенное время развития в определенном месте развивающегося организма с определенной интенсивностью и скоростью и приводит к конкретному качественному и количественному результату. Строгая закономерность действия клеточных механизмов в онтогенезе особи регулируется системными механизмами развития, к которым относят межклеточные взаимодействия, взаимодействия клеточных комплексов, частей и структур зародыша (эмбриональная индукция), нервную и гуморальную регуляцию, образование морфогенетических полей. ДЕЛЕНИЕ КЛЕТОК Деление клеток (размножение, пролиферация) играет важную роль в процессах онтогенеза. Во-первых, благодаря делению из зиготы, которая соответствует одноклеточной стадии развития, возникает многоклеточный организм. Во-вторых, пролиферация клеток, происходящая после стадии дробления, обеспечивает рост организма. В-третьих, избирательному размножению клеток принадлежит заметная роль в обеспечении морфогенетических процессов. В-четвертых, в постнатальном периоде индивидуального развития благодаря клеточному делению осуществляется обновление многих тканей в процессе жизнедеятельности организма (физиологическая или гомеостатическая регенерация), а также заживление ран, восстановление утраченных органов (репаративная регенерация). Зигота, бластомеры и соматические клетки организма, за исключением половых клеток в периоде созревания гаметогенеза, делятся митозом. Клеточное деление как таковое является одной из фаз клеточного цикла. От продолжительности интерфазы (G1-, S-, G2-периодов) зависит частота последовательных делений в ряду клеточных поколений. В свою очередь, интерфаза имеет разную продолжительность в зависимости от стадии развития зародыша, локализации и функции клеток. Так, в периоде дробления эмбриогенеза митотические циклы сильно укорочены. Причины подобной модификации: отсутствие периода G1, а у ряда организмов и периода G2, ускорение репликации - подробно обсуждались в п. 7.4.1. В результате указанных изменений митотического цикла происходит выравнивание ядерно-цитоплазматического соотношения в клетках зародыша, при этом деления бластомеров осуществляются с очень высокой скоростью (рис. 8.1.) Последнее является важным фактором нормального развития зародыша. В результате такой «ускоренной» пролиферации осуществляется быстрое накопление значительного количества клеток. Было доказано, что зародыш или его структуры должны иметь необходимый минимум клеток для успешного протекания дальнейшего развития. Так, формирование полноценной бластулы мыши - ее кавитация, т.е. образование бластоцеля - требует наличия не менее 22-25 бластомеров в моруле. Для последующей успешной имплантации зародыша необходимо пороговое количество бластомеров внутренней клеточной массы бластоцисты. В экспериментах на амфибиях установлено, что при наличии менее 100 клеток в зачатке нервной трубки, образования этой структуры не происходит. Если при закладке верхней конечности в ее зачатке (почке) число клеток недостаточно, то развивается конечность с неполным числом пальцев.
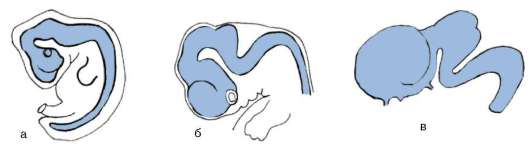
Рис. 8.1. Скорость образования новых клеток в ходе дробления и гаструляции у лягушки Rana pipiens (по: Sze, 1953)
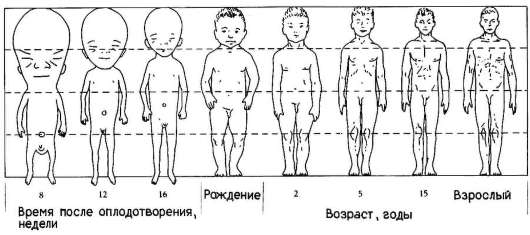
К концу стадии дробления восстанавливается соответствие структуры и продолжительности интерфазы ее обычным характеристикам, и все последующие деления клеток зародыша сопровождаются их ростом, вследствие чего происходит и рост организма в целом. В ходе гаструляции и всех последующих стадий развития становится очевидной избирательность пролиферации, т.е. клетки активно делятся преимущественно в определенных областях развивающегося организма. Избирательность размножения клеток зародыша дрозофилы представлена на рис. 8.2. Особое значение неравномерность размножения клеток приобретает в ходе органогенеза и гистогенеза. Там, где скорость клеточного деления высокая, происходят и качественные изменения в структуре эмбриональной закладки, т.е. формообразовательные процессы сопровождаются активным размножением клеток. Так, особенности пролиферации клеток передней части нервной трубки приводят к формированию головного мозга (рис. 8.3). Еще одним примером избирательности размножения клеток может служить аллометрия роста - явление, при котором наблюдается неравномерный рост отдельных частей тела, благодаря которому достигается формирование нормального взрослого организма конкретного вида. Очень отчетливо это явление наблюдается, например, в развитии человека (рис. 8.4). При сравнении пропорций тела плода, новорожденного и взрослого становится очевидной более высокая скорость роста нижних конечностей по сравнению со скоростью роста головы.
Рис. 8.2. Дифференциальная скорость размножения клеток в разных частях зародыша дрозофилы: а - авторадиографическое выявление мРНК гена string, экспрессия которого наблюдается в активно делящихся клетках, б - регионы зародыша с различной митотической активностью клеток под световым микроскопом (по: S.F. Gilbert, 2005)
Рис. 8.3. Избирательное размножение клеток переднего конца нервной трубки при формировании головного мозга у зародыша человека: а - 4-недельный зародыш, б - 6-недельный зародыш, в - 8-недельный зародыш
Рис. 8.4. Неравномерность роста в онтогенезе человека
Установлено формирование в процессе развития многих структур зародыша клетками, происходящими от небольшого числа или даже одной клетки. Совокупность клеток, являющихся потомками одной родоначальной, называют клоном. Примером подобного явления служит формирование всей мезодермы у моллюска Dentalium из единственного бластомера 4d. Его удаление в эксперименте приводило к отсутствию мезодермальных органов или частей органов у взрослой особи. Не менее интересные данные получены благодаря работам, выполненным на зародышах мыши. Установлено, что организм развивается всего из трех клеток внутренней клеточной массы на стадии, когда бластоциста состоит из 64 клеток, а сама внутренняя клеточная масса содержит примерно 15 клеток. Показано также, что большие по объему участки центральной нервной системы образуются из определенных клеток формирующегося организма. Важное следствие такой ситуации - то, что многие клетки раннего зародыша не участвуют в дальнейшем развитии. В большинстве случаев неясно, в какой именно срок происходит отбор родоначальных клеток и каков механизм этого отбора. Очевидно, что соматические мутации в клетке-родоначальнице клона могут быть причиной мозаицизма, явления, при котором большие группы клеток многоклеточного организма отличаются по набору хромосом или аллельному составу. У человека результатом таких мутаций могут быть мозаичные формы хромосомных болезней, например синдрома Дауна. Известна также соматическая мутация - «белая прядь волос». В сформировавшемся организме способность клеток к делению также значительно разнится. Некоторые клетки, например нейроны, вообще не делятся, в то время как в кроветворной и эпителиальной тканях продолжается активное размножение клеток. Практически не делящиеся в обычных условиях клетки таких органов, как печень и почки, при наличии стимула в виде воздействия гормональных или внутритканевых факторов, могут вступить в митотический цикл. Среди стимулов, побуждающих клетки к делению, значительную часть составляют факторы роста, относящиеся к группе гистогормонов. Они продуцируются неспециализированными клетками, находящимися во всех тканях, и обладают эндокринным (действуют на отдаленные клетки-мишени через кровоток), паракринным (на соседние клетки путем диффузии), аутокринным (на сами клетки-продуценты) и даже интракринным (внутри клетки, не секретируясь, т.е. не выделяясь из клетки-продуцента) действием. Факторы роста - это по большей части пептиды с молекулярной массой 5000-50 000 кДа (дальтон, или Да - единица атомного веса, 1 кДа = 103 Да), индуцирующие синтез ДНК и вхождение клетки в митоз, однако они могут выполнять и другие функции. Так, например, тромбоцитарный фактор роста (PDGF) стимулирует дифференцировку, гепатоцитарный фактор роста (HGF) служит хемоаттрактантом и изменяет подвижность клеток эпителия почки. Действие факторов роста необходимо рассматривать в связи с другими стимуляторами, прежде всего гормонами, и с учетом типа клеток-мишеней и их тканевого микроокружения. Фактор роста, активирующий митоз клеток одного типа, может действовать как ингибитор пролиферации клеток другого типа. Так, например, фактор роста эпидермиса (EFG) может подавлять пролиферацию клеток кишечного эпителия крыс, а полипептиды, стимулирующие рост недифференцированных эмбриональных клеток, останавливают пролиферацию лейкозных клеток и индуцируют их дифференцировку.
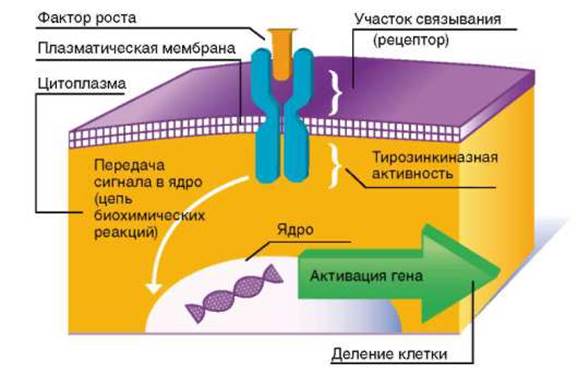
Рис. 8.5. Схема действия факторов роста
Большинство факторов роста оказывает митогенное (стимулирующее митоз) действие, связываясь с рецепторами мембраны клетки, т.е. действуя как лиганды, что приводит к активации фермента, ассоциированной с этими рецепторами (рис. 8.5). Это ведет через те или иные посредники (сигналлинги) к запуску каскадов митогенактивирующих протеинкиназ. Конечные ферменты этого каскада, фосфорилируя ряд транскрипционных факторов, активируют их, а они, в свою очередь, запускают экспрессию определенных генов. Среди последних гены, кодирующие Cdk, которые играют ключевую роль в поочередной смене фаз клеточного цикла, и их активаторные субъединицы - циклины (см. главу 3). На рис. 8.6 показано, в каких именно точках митотического цикла осуществляют свое действие различные Cdk и циклины.
Рис. 8.6. Комплексы циклин-циклинзависимая киназа (Cdk), контролирующие разные фазы клеточного цикла
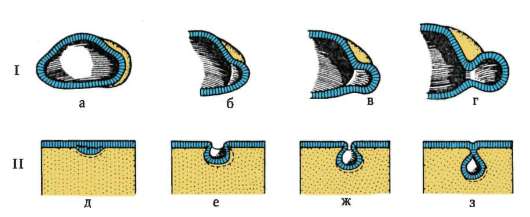
Факторы роста, их рецепторы, участники передачи сигнала внутри клетки, транскрипционные факторы нередко являются продуктами экспрессии протоонкогенов. Это гены, осуществляющие контроль деления, роста, дифференцировки клеток и находящиеся в свою очередь под контролем ряда других генов. К настоящему времени идентифицировано более 100 протоонкогенов. Известно, что часть таких генов (в геноме человека их около 40), экспрессируется только в эмбриональных клетках и малоактивна в зрелых. Некоторые протоонкогены экспрессируются (транскрибируются и транслируются) не только в эмбриогенезе, но и в постнатальном развитии в ходе регенерационных процессов, например после хирургических операций. Изменения структуры и усиление сверх нормы экспрессии протоонкогенов во взрослом организме вызывает развитие опухолей (что определило их название: от греч. protos - первый и onkos - опухоль). В эмбриональном развитии мутации таких генов являются генетической основой формирования пороков. Так, мутации одного из протоонкогенов - FRFR3, кодирующего рецептор к фактору роста фибробластов, приводит к нарушению пролиферации хрящевых клеток, участвующих в формировании трубчатых костей конечности, и в результате к ахондроплазии. Другие мутации того же гена лежат в основе летальной танатоформной дисплазии и менее тяжелого синдрома гипохондроплазии, которые также являются следствием нарушения (хондро)остеогенеза. Наряду с факторами роста описан целый ряд полипептидных ингибиторов пролиферации клеток, которые ранее чаще именовали кейлонами. Эти вещества существенно различаются по молекулярной массе, содержанию углеводных, липидных и других компонентов, а также по чувствительности к температуре и иным свойствам. Кейлоны считаются тканеспецифичными регуляторами пролиферации, т.е. проявляют свое ингибирующее действие в той же ткани, где и образуются. Кейлоны не имеют выраженной видовой специфичности. Так, эпидермальный кейлон трески действует и на эпидермис млекопитающего. Предполагается, что каждый тип клеток образует свой специфичный ингибитор пролиферации. Хотя для некоторых клеток известно несколько таких веществ. Регуляция пролиферации может осуществляться и другими способами, например контактными межклеточными взаимодействиями. Многие клетки способны делиться только будучи прикрепленными к внеклеточным структурам. Например, для эпителиоцитов такой структурой является базальная мембрана, а для фибробластов - коллагеновые волокна межклеточного вещества. Если клетка устанавливает контакт не с внеклеточным матриксом, а с другими клетками, то при определенной плотности клеток наблюдается прекращение делений. Этот эффект назван «контактное торможение». Для каждой ткани «тормозящая» плотность специфична. При регенерации клетки активно делятся лишь до достижения оптимального их количества, после чего пролиферация ингибируется. Считают, что делящимся клеткам соответствует некий генетически запрограммированный лимит делений, при приближении к которому в клетках наступают глубокие изменения, вызывающие в конечном счете прекращение делений и клеточную гибель. Роль пролиферации как одного из основополагающих механизмов развития доказывается мутациями генов, контролирующих деление клеток. У Drosophila melanogaster описана мутация gt (giant). Она наследуется по рецессивному сцепленному с полом типу. У мутантов gt развитие протекает нормально на протяжении всего эмбрионального периода. Однако в тот момент, когда нормальные особи окукливаются и начинают метаморфоз, мутантные особи продолжают оставаться в личиночном состоянии еще дополнительно 2-5 сут. За это время у них происходит одно, а может быть, и два дополнительных деления в имагинальных дисках, от количества клеток которых зависит размер будущей взрослой особи. Затем мутанты образуют куколку вдвое крупнее обычной. После метаморфоза несколько удлиненной по времени стадии куколки на свет появляется морфологически нормальная взрослая особь (имаго) удвоенного размера. У мышей известен ряд мутаций, обусловливающих снижение пролиферативной активности и следующие за этим фенотипические эффекты. К ним относят, например, мутацию or (ocular retardation), затрагивающую сетчатку глаза начиная с 10-х суток эмбрионального развития и приводящую к микрофтальмии (уменьшению размеров глазных яблок), и мутацию tgla, затрагивающую центральную нервную систему с 5-6-х суток после рождения и приводящую к отставанию роста и атрофии некоторых внутренних органов. Таким образом, деление клеток - чрезвычайно важный процесс в онтогенетическом развитии. Оно протекает с разной интенсивностью в разное время и в разных структурах организма, носит, видимо всегда, клональный характер и подвержено генетическому контролю. Все это характеризует клеточное деление как сложнейшую функцию целостного организма, подчиняющегося регулирующим влияниям на различных уровнях: генетическом, тканевом, онтогенетическом. КЛЕТОЧНЫЕ ПЕРЕМЕЩЕНИЯ В процессе развития особи происходят неоднократные перемещения (миграции) отдельных клеток, их групп, клеточных пластов. Особое значение миграция клеток приобретает на стадии гаструляции, приводя к формированию зародышевых листков. В ходе органогенеза этот механизм важен, например, при формировании крупных пищеварительных желез, производных нервного гребня. Не менее значима его роль и в постэмбриональном развитии. Амебоидное движение макрофагов обеспечивает реализацию реакций иммунитета, перемещения сперматозоидов (жгутиковое движение) необходимы для осуществления оплодотворения, миграции клеток эпидермиса приводят к закрытию раневой поверхности при повреждениях кожи и т.д. В целом, миграция обеспечивает доставку клеточного материала в нужную область организма. Следует отметить, что перемещаться могут как отдельные клетки, так и целые клеточные пласты. Последний вариант характерен для эпителиальных клеток, которые тесно прилегают друг к другу боковыми стенками и подстилаются базальной мембраной (рис. 8.7). Отростчатые или веретеновидные клетки, погруженные в межклеточное вещество, - ме-зенхимные клетки - более подвижны, не образуют между собой стойких контактов, вследствие этого они мигрируют одиночно или группами (рис. 8.8). Как мезенхима, так и эпителии могут быть образованы из любого из трех зародышевых листков. Особая форма движения отдельных клеток наблюдается на ранних стадиях
Рис. 8.7. Перемещение клеточных пластов: I - путем выпячивания на примере образования глазного пузырька; II - путем впячивания на примере образования слухового пузырька: а - стенка переднего мозга; б - местное ускорение роста; в - выпячивание; г - глазной пузырек; д-ж - углубление ямки; з - от-шнуровывание пузырька
Рис. 8.8. Миграция мезен-химных клеток в ходе га-струляции у амфибий развития у некоторых зародышей. Например, у птиц первичные половые клетки мигрируют из стенки желточного мешка в кровяное русло и таким образом (с током крови) переносятся в гонады.
Миграции клеток осуществляются на основе дистантных и контактных взаимодействий. К дистантным может быть отнесено перемещение по градиенту концентрации тех или иных веществ - движение по типу хемотаксиса. Такой механизм встречается довольно редко, его достоверных случаев для эмбриональных клеток многоклеточных животных не обнаружено. Основой миграции клеток многоклеточных животных как в эмбриогенезе, так и в постнатальном развитии являются контактные взаимодействия, прежде всего между внеклеточным веществом и мигрирующими клетками. В качестве примера подобного взаимодействия рассмотрим миграцию клеток нервного гребня (рис. 8.9), который вследствие многочисленности и значимости его производных иногда называют четвертым зародышевым листком (см. п. 7.4.3). Начало миграции клеток нервного гребня связано с их выделением из пласта нейроэпителия замыкающейся нервной трубки и приобретением ими внешних признаков мезенхимных клеток. Оказавшиеся вне нейроэпителиального пласта клетки нервного гребня начинают активно перемещаться. Миграция клеток определяется взаимодействием клеток с межклеточным веществом - внеклеточным матриксом. Матрикс служит для клеток механической опорой или, как принято говорить, твердым субстратом. Его компоненты в настоящее время довольно хорошо изучены и включают разные типы коллагена, фи-бронектин, ламинин, гликозаминогликаны и другие вещества (рис. 8.10).
Рис. 8.9. Миграция клеток нервного гребня: а - поперечный срез зародыша; б - производные клеток нервного гребня у взрослого организма; 1 - нервный гребень; 2 - узел спинного корешка; 3 - пигментные клетки; 4 - симпатический узел; 5 - развивающийся надпочечник; 6 - нервное сплетение в стенке кишки; 7 - клетка шванновской оболочки; 8 - униполярный чувствительный нейрон; 9 - клетка-спутник; 10 - мультиполярный нейрон симпатического узла; 11 - хромаффинная клетка в мозговом веществе надпочечника; 12 - превертебраль-ное сплетение; 13 - парасимпатическое сплетение в кишке; стрелками показано направление миграции клеток нервного гребня
Гликопротеиды фибронектин и ламинин - основные вещества внеклеточного матрикса, принимающие участие в миграции клеток нервного гребня. Они оказывают стимулирующий эффект на их перемещение. Напротив, коллаген II типа, откладывающийся, по данным ряда авторов, преимущественно на выпуклых поверхностях нейральных пластов, задерживает на себе клетки нервного гребня, повышая их концентрацию и способствуя дифференцировке. Взаимосвязь мигрирующих клеток с компонентами внеклеточного матрикса осуществляется особым видом клеточных рецепторов.
Рис. 8.10. Фибронектино-вые фибриллы во внеклеточном матриксе крыши бластоцеля гаструлы амфибии, выявленные методом иммунофлюоресценции белками-интегринами (рис. 8.11, а). В эксперименте показано, что введение в головной отдел зародыша антител к интегрину, блокирующих связь клеток с фибронектином или ламинином, приводит к значительным нарушениям в распределении клеток нервного гребня.
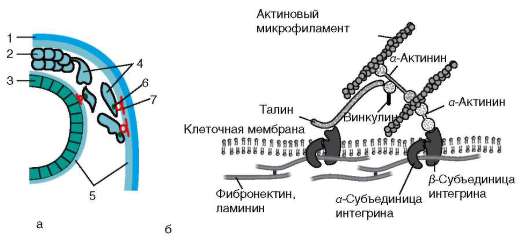
Интегриновый рецептор - трансмембранный белок: его молекула пронизывает плазматическую мембрану клетки и обладает как внеклеточной, так и внутриклеточной частями (доменами). Внутриклеточный домен интегрина через цепь различных соединенных между собой белков взаимодействует с актиновыми микрофиламентами цитоскелета клетки, и тем самым осуществляется структурная связь между внеклеточным матриксом и цитоскелетом прикрепившейся клетки (рис. 8.11, б). Интегрин состоит из α- и β-субъединиц, которые могут комбинироваться в различных сочетаниях, формируя более 20 разных типов интег-ринов. Мигрирующая мезенхимная клетка в некоторых участках своей поверхности образует псевдоподии (клеточные выросты в виде тонких нитей - филоподии или пластинчатой формы - ламеллоподии). Точки прикрепления псевдоподий к внеклеточному матриксу называют фокальными контактами (рис. 8.12). Именно в них оказываются сосредоточенными интегрины. Под фокальными контактами понимают макромолекулярные динамические комплексы, включающие до 100 различных белков, посредством которых передаются регуляторные сигналы от внеклеточного матрикса к клетке. Зафиксировавшись на субстрате, клетка за счет сокращения микрофиламентов и микротрубочек цитоскелета подтягивается в точке прикрепления. Затем она теряет фокальные контакты, формирует новые псевдоподии, на которых снова устанавливаются фокальные контакты, и т.д.
Рис. 8.11. Взаимодействие мигрирующей клетки с компонентами внеклеточного матрикса: а - общий вид; б - механизм действия интегринового рецептора. 1 - покровная эктодерма; 2 - нервный гребень; 3 - нервная трубка; 4 - мигрирующие клетки нервного гребня; 5 - внеклеточный матрикс; 6 - интегрин; 7 – ламинин
Различия в миграции эпителиальных пластов и мезенхимальных клеток, возможно, связаны именно с характером распределения фокальных контактов по клеточному краю: у мезенхимных клеток они сосредоточены преимущественно в концевых отделах, тогда как у эпителиальных клеток фокальные контакты распределены относительно равномерно по всей периферии и силы связывания с субстратом выражены слабее, чем у мезенхимы. Наиболее интересный и принципиальный вопрос при перемещении клеток - целенаправленный характер процесса миграции, когда клетки движутся не хаотически, а по определенным путям именно в те участки зародыша, где впоследствии из них будут образовываться зрелые производные. Каким образом клетки определяют, куда они должны мигрировать? В последние годы установлено, что направление миграции может быть задано неоднородностью компонентов матрикса и, следовательно, его адгезивных свойств, кривизной его поверхности или микрорельефом, а также различными нарушениями непрерывности матрикса. Все это служит своеобразными опознавательными знаками для выбора направления клеточных миграций и сосредоточения определенных типов клеток в участках закладки будущих органов или регенерации. С учетом описанных выше взаимодействий рецепторов клетки с соответствующими компонентами внеклеточного матрикса становится очевидно, что если необходимые элементы матрикса распределены не равномерно, а, например, в виде островков или узких дорожек, то клетки смогут прикрепляться и перемещаться лишь в границах определенных участков. Такая картина реально наблюдается в организме в условиях эмбриогенеза или при заживлении ран, когда клетки направленно мигрируют вдоль линейных участков на поверхности внеклеточного ма-трикса в соответствии с наличием в этих участках белковых компонентов, необходимых для адгезии клеток данного типа (рис. 8.13).
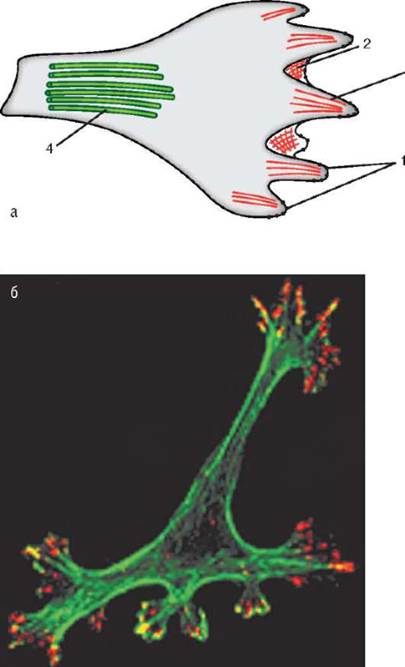
Рис. 8.12. Мигрирующая клетка: а - схематическое изображение; б - микрофотография с использованием антител к актину (зеленый) и интегрину (красный). 1 - фокальные контакты; 2 - ламеллоподия с сетью актиновых филамен-тов; 3 - филоподия с пучком актиновых филаментов; 4 – микротрубочки
Механизм реакции мигрирующих клеток на геометрическую конфигурацию субстрата в настоящее время активно обсуждается. Одно из предположений состоит в том, что в этих реакциях участвуют так называемые рецепторы растяжения. Эти рецепторы клеточной мембраны, возможно, реагируют на кривизну или микронеровности поверхности субстрата, вызывая реорганизацию актинового цитоскелета и неравномерное перераспределение сил натяжения в клетке. В результате клетки начинают вытягиваться и ориентироваться в определенном направлении. Активация рецепторов растяжения включает внутриклеточную сигнализацию, которая вызывает фосфорилирование некоторых белков и изменение генной экспрессии. Одним из вероятных кандидатов на роль рецепторов растяжения являются ионные хлоридные каналы в клеточной мембране: в среде с дефицитом хлоридов вытягивание клеток вдоль микроканавок резко ослабевает. Однако для доказательства данного и ряда других предположений необходимы дальнейшие исследования.
Рис. 8.13. Фибриллы внеклеточного матрикса зародыша морского ежа на стадии гаструляции и мигрирующие вдоль них клетки
Помимо доставки клеточного материала в нужную область зародыша миграция также обеспечивает определенный характер расположения клеток в зачатке формирующейся структуры, вследствие чего последний приобретает форму. Так, например, в зачатке головного мозга клетки перемещаются из зоны размножения, прилежащей к полости невроцеля, к наружной стороне нервной трубки и образуют ряд выпячиваний, так называемых мозговых пузырей. Миграция клеток из зоны размножения обеспечивает также упорядоченное расположение слоев коры переднего мозга. Формирование начинается с самых глубоких слоев. Сначала мигрируют и занимают нужную позицию клетки самого нижнего (внутреннего) уровня. Клетки каждого последующего слоя, чтобы достичь своего места локализации, должны преодолеть уже сформированные клеточные уровни. Один из регуляторов процесса миграции и позиционирования нервных клеток коры переднего мозга - белок рилин, кодируемый геном RELN. Название «рилин» происходит от английского глагола to reel - кружиться, идти нетвердой походкой. Именно такая, «закрученная», неровная походка наблюдается у мышей с генетически обусловленным недостатком рилина. Нехватка белка ведет к таким нарушениям миграции нейронов, что у мышей наблюдается инверсия слоев коры головного мозга, т.е слои выстраиваются «наоборот»: более молодые нейроны не в состоянии преодолеть слои уже «осевших» на своем уровне клеток. Генетический контроль миграции клеток, как и других процессов, осуществляемых в онтогенезе, сложен и в настоящее время активно изучается. Имея в виду перемещения клеток нервного гребня, можно привести следующие примеры. Продукт гена Slug участвует в трансформации клеток нервного гребня в мигрирующие мезенхимальные клетки. Продукт гена Foxd3 усиливает их перемещения. Миграция отдельных групп клеток нервного гребня также генетически детерминирована. Так, при одной из форм синдрома Ваарденбурга наблюдается частичный альбинизм, врожденная нейросенсорная тугоухость, а в некоторых случаях и отсутствие вегетативных ганглиев в кишечнике. Эта патология обусловлена нарушением миграции трех производных нервного гребня, одно из которых - меланоциты, второе - клетки улиткового ганглия, третье - нейроны межмышечного сплетения кишки. У больных выявлены мутации генов, кодирующих регуляторные белки РАХЗ и MITF, и мутация гена, кодирующего рецептор к эндотелину-3. В целом, нарушения клеточной миграции, происходящие в период эмбриогенеза, приводят к формированию таких врожденных пороков развития, как гетеротопии и эктопии, т.е. к аномальной локализации органов или структур. Так, гетеротопия поджелудочной железы млекопитающих определяется нарушением перемещения закладок этого органа, в результате чего формирование компактной железы происходит в ненадлежащем месте. Таким образом, несомненно, что миграция клеток является одним из важнейших механизмов развития, определяя правильность формирования структуры, формы органов, их локализацию, обеспечивая процессы регенерации, иммунитета и другие. Приобретение клетками способности к миграции, взаимодействие мигрирующих клеток с субстратом, детерминирующее перемещение клеток, находятся под генетическим контролем.
|
||
|
Последнее изменение этой страницы: 2016-07-15; просмотров: 767; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.62 (0.014 с.) |