Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Гетерогенность яйцеклетки как основа дифференцировкиСодержание книги
Поиск на нашем сайте Зрелая яйцеклетка, которую Т.Х. Морган справедливо считал самой дифференцированной клеткой в организме, представляет собой мозаичную, высокогетерогенную систему. Один из процессов, приводящий к гетерогенности яйцеклетки - овоплазматическая сегрегация. Неравномерное распределение компонентов цитоплазмы в яйцеклетке можно обнаружить уже на стадии созревания. Как было показано в п. 7.2, овоплазматическую сегрегацию сопровождает поляризация яйцеклетки. Остановимся более подробно на процессах, приводящих к овоплазматической сегрегации и роли последней в дифференцировке клеток развивающегося зародыша. Формирование сегрегации цитоплазмы подробно изучено в созревающем яйце дрозофилы. Неоднородность цитоплазмы яйцеклетки возникает в том числе вследствие неравного положения ее полюсов среди клеток материнского организма. К переднему полюсу яйцеклетки примыкают фолликулярные и питающие клетки, которые продуцируют мРНК для белка bicoid. Эта мРНК транспортируется в яйцеклетку, и еще до оплодотворения устанавливается градиент ее концентрации с максимумом на переднем конце яйцеклетки, что обусловливает в дальнейшем развитии формирование головных структур зародыша из этой части яйца. Будущий задний полюс соседствует с фолликулярными клетками, которые доставляют в эту область яйца мРНК, считанную с гена nanos, детерминирующую образование заднего конца зародыша (рис. 8.26). Таким образом, еще в неоплодотворенной яйцеклетке дрозофилы формируется передне-задняя ось будущего организма. Аналогично задается и дорсо-вентральная ось. Вещества, имеющие четкий градиент распределения, принято называть морфогенами. Следует обратить внимание, что градиенты морфогенов в яйцеклетке дрозофилы создаются благодаря активности в окружающих яйцо фолликулярных и питающих клетках генов материнского организма. Они получили название - «гены с материнским эффектом».
Рис. 8.26. Распределение морфогенов по продольной оси яйца дрозофилы
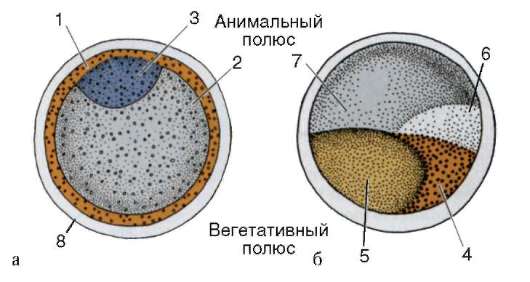
Следует обратить внимание, что большинство запасенных в яйцеклетке мРНК первоначально находится в неактивном состоянии в комплексе с белком в виде информосом. Такие неактивные мРНК могут быть распределены в цитоплазме достаточно равномерно. Создание их градиентов осуществляется благодаря их неравномерной активации. Механизмы активации могут быть различными. Так, например, установлено, что фиксация мРНК на цитоплазматическом матриксе яйцеклетки (локализация мРНК в определенных зонах яйца) приводит к их активации. Показано, что в дальнейшем транслируются только локализованные мРНК, а нелокализованные разрушаются. Другие механизмы избирательной трансляции запасенных мРНК наблюдаются на следующих этапах формирования овоплазматической сегрегации и связаны с перемещениями цитоплазмы вследствие оплодотворения. Проникновение сперматозоида в яйцеклетку в момент оплодотворения и последующее движение его пронуклеуса приводит к усилению овоплазматической сегрегации. В яйце наблюдаются сложные перемещения цитоплазмы и ее функциональная перестройка. В результате она становится еще более неоднородной. Этот процесс хорошо заметен в тех случаях, когда разные участки цитоплазмы содержат гранулы веществ разной окраски (желток, темный пигмент и др.). Хорошим примером может служить яйцо асцидии. Серая цитоплазма центральной части яйцеклетки окружена кортикальным слоем, содержащим желтые липидные включения. На анимальном полюсе располагается светлая цитоплазма с ядерным материалом. Сразу после оплодотворения цитоплазма яйца перемещается, и кортикальный ее слой формирует желтый серп, расположенный между экватором и вегетативным полюсом (рис. 8.27). Перемещения цитоплазмы вследствие оплодотворения хорошо заметны и в яйцеклетке амфибий. В ней слой темного пигмента меланина первоначально покрывает все анимальное полушарие. После проникновения сперматозоида поверхностный - кортикальный - слой цитоплазмы толщиной в несколько микрометров поворачивается примерно на 30о относительно внутренней массы желтка в направлении, которое зависит от места проникновения сперматозоида. В результате этого у некоторых амфибий против места проникновения спермия появляется серповидная слабопигментированная область, названная серым серпом. В ней позже, в ходе гаструляции, возникает дорзальная губа бластопора. Вследствие всех указанных перемещений цитоплазмы формируются оси зародыша. Сторона, где формируется серый серп, становится дорзаль-ной, а противоположная, где наблюдается внедрение сперматозоида - вентральной. Анимально-вегетативная ось соответствует головно-хво-стовой оси будущего зародыша (см. рис. 7.3).
Рис. 8.27. Сегрегация цитоплазмы в яйце асцидии Styelapartita: а - до оплодотворения; б - после оплодотворения; 1 - кортикальная цитоплазма с желтыми липидными включениями; 2 - цитоплазма, содержащая желток; 3 - светлая цитоплазма с ядром ооцита; 4 - желтый серп; 5 - цитоплазма с желтком; 6 - серый серп; 7 - анимальная светлая цитоплазма; 8 – хорион Перемещения цитоплазмы вследствие проникновения спермия в яйцеклетку - еще один механизм, приводящий к избирательной трансляции запасенных в яйцеклетке мРНК. В частности, благодаря в том числе и этому механизму осуществляется детерминирование дорсо-вентральной оси зародыша. В оогенезе у амфибий на вегетативном полюсе яйца запасаются мРНК для белка Xwnt11. После оплодотворения и поворота цитоплазмы часть этой мРНК перемещается по стороне, противоположной внедрению сперматозоида, в направлении анималь-ного полюса. В области серого серпа происходит полиаденилирование молекул мРНК Xwnt11, что приводит к их активации и последующей трансляции. В результате только в этой области яйца образуется соответствующий белок - один из основных дорсализующих факторов. Остальная мРНК для Xwnt11 в вегетативном полушарии, по-видимому,остается репрессированной. Выполненные исследования установили, что именно поворот цитоплазмы является механизмом, запускающим трансляцию мРНК Xwnt11 через полиаденилирование. Анализ результатов многих проведенных экспериментов позволил сделать вывод, что в создании сегрегации цитоплазмы яйцеклетки ведущая роль принадлежит цитоскелету. Так, транспорт мРНК, поступающих из окружающих клеток и синтезированных в самой яйцеклетке, к месту их локализации в цитоплазме осуществляется на большие расстояния по микротрубочкам, а на малые - по микрофиламентам. Считают, что местом локализации в клетке морфогенетических детерминант может быть кортикальный слой или цитоскелет клетки. Предполагают также, что и перемещения цитоплазмы яйца, наблюдаемые после оплодотворения, определяются цитоскелетом. В частности, в этом процессе возможно значительное участие центриоли сперматозоида и отходящих от нее микротрубочек. С помощью нарушающего сборку микротрубочек колхицина удается подавить транспорт и активацию мРНК, перемещения цитоплазмы и ооплазматическую сегрегацию в целом. В ходе дробления разные участки цитоплазмы зиготы, содержащие специфический набор веществ, попадают в разные бластомеры. Экспериментами с микроинъекциями коллоидных частиц золота показано, что при дроблении цитоплазма яйцеклетки распределяется между бла-стомерами, не перемешиваясь. Различия в характере цитоплазмы могут служить регулятором считывания информации с разных генов в разных бластомерах и тем самым влиять на ход их дифференцировки. Показано, что цитоплазматические факторы белковой природы проникают в ядро бластомера и путем избирательной активации или инактивации конкретных генов определяют характер считываемой информации. Полагают, что таким способом морфогенетические детерминанты, содержащиеся в отдельных участках цитоплазмы, жестко, порой необратимо контролируют предопределенность (детерминированность) данного бластомера к образованию клеток определенного типа. Такое жесткое предопределение судьбы бластомеров наблюдается у оболочечников, к которым относятся и асцидии. Неоднократно экспериментально доказано, что у этих животных каждый бластомер ответственен за образование специфического набора тканей личинки, при этом каждая клетка дифференцируется автономно, независимо от окружающих ее клеток. Тунг и другие исследователи пересаживали в цитоплазму бластомера, лишенного генетического материала, ядро из другого бла-стомера. Показано, что дальнейшее развитие клетки-реципиента идет по пути того бластомера, чья цитоплазма ему досталась. Обнаружено также, что удаление у оболочечников каких-либо бластомеров приводит к отсутствию у личинки как раз тех структур, которые в норме из них формируются, а изоляция определенных групп клеток зародыша приводит к формированию из них характерных структур вне связи с другими клетками. Так, в серии экспериментов на 8-клеточном зародыше оболо-чечников показана способность только одной пары бластомеров, содержащих фермент ацетилхолинэстеразу, давать начало мышечной ткани. У асцидий после оплодотворения по-разному окрашенные области цитоплазмы яйца распределяются по разным бластомерам, детерминируя их дальнейшую судьбу. Клетки бластулы, унаследовавшие цитоплазму желтого серпа, дают начало мышечным клеткам, цитоплазму серого экваториального серпа - образуют хорду и нервную трубку, анимальную цитоплазму - становятся эпидермисом личинки, содержащие желток вегетативной области - формируют в ходе развития кишку (см. рис. 8.27). Жесткая детерминация судьбы бластомеров, определяемая составом веществ попавшего туда участка цитоплазмы яйца, обнаружена и у ряда других животных, например гребневиков, круглых и кольчатых червей, моллюсков. Тип развития этих животных, дифференцировка клеток которых определяется очень рано в развитии благодаря прежде всего ово-плазматической сегрегации, назван мозаичным. Помимо овоплазматической сегрегации в определении судьбы бла-стомеров на самых ранних этапах развития может принимать участие и другой системный механизм - межклеточные взаимодействия. В этом случае развитие бластомеров в большей степени зависит от их взаимодействий с соседними клетками, межклеточным матриксом, которые определяются положением этих бластомеров в зародыше. Подобный тип развития, наблюдаемый у иглокожих и позвоночных, назван регуляционным. Следует, однако, иметь в виду, что в развитии и мозаичных, и регуляционных зародышей участвуют оба механизма, однако степень их влияния значительно разнится, и основную роль играет один из них. Так, локализация специфических белков или м-РНК в определенных областях зиготы не ограничена мозаичными зародышами. Обнаружено, что анимальные и вегетативные области яиц амфибий, имеющих регуляционный тип развития, содержат уникальные мРНК. Кроме того, в цитоплазме вентральной области зиготы лягушки была выявлена так называемая половая детерминанта. Клетки, получающие при дроблении цитоплазму с данным веществом, становятся предшественниками половых клеток, и их потомки дают начало гаметам. Показано, что у зародышей ряда других животных, раннее развитие которых является в основном регуляционным и определяется межклеточными взаимодействиями, обнаруживаются подобные половые детерминанты. Содержащие их бластомеры в ходе дальнейшего развития дают начало предшественникам гамет и мигрируют в закладку гонад. Помимо овоплазматической сегрегации, гетерогенность яйцеклетки определяется также неоднородностью организации ее плазмалем-мы. Так, для овулировавших яйцеклеток млекопитающих характерна своеобразная организация цитоскелета, что в свою очередь приводит к мозаичной организации плазматической мембраны. Основная часть мембраны яйцеклетки образует микроворсинки, и лишь примерно от одной десятой до одной пятой общей поверхности яйцеклетки мыши представлено районом, в котором нет микроворсинок. Под плазма-леммой в этой области яйцеклетки располагается густая сеть микро-филаментов, а глубже находится мейотическое веретено метафазы II. У других млекопитающих район, не имеющий микроворсинок, также соответствует той области цитоплазмы, где располагается мейотическое веретено. При оплодотворении спермий контактирует с мембраной яйцеклетки в любом месте, богатом микроворсинками. После этого микроворсинки исчезают, генетический материал спермия попадает в цитоплазму яйцеклетки, а часть мембраны спермия встраивается в месте его проникновения в мембрану яйцеклетки. В результате возникает разнородность плазматической мембраны, которая отражается на нескольких делениях дробления. Первые два бластомера имеют одинаковый размер, но не вполне одинаковые характеристики. Во время интерфазы синтез рибосомальной РНК в ядрышках этих бластомеров происходит в разное время, продолжительность фазы репликации ДНК у них также неодинакова. Один из бластомеров содержит в плазмалемме антигены, а в цитоплазме - структурные компоненты хвоста спермия. Предполагается, что именно этот бластомер вступает во второе деление дробления на 20-60 мин раньше другого. Мембранные антигены спермия сохраняются в плазмалеммах у потомков этого бластомера еще на протяжении нескольких делений. Установлено, что потомки именно этого бластомера, который на 2-клеточной стадии делится первым, с большей вероятностью дадут начало развитию внутренней клеточной массы бла-стоцисты, тогда как потомки запаздывающего при делении бластомера с большей вероятностью станут источником для формирования внезаро-дышевых частей эмбриона. Таким образом, гетерогенность яйцеклетки не только определяет последующую дифференцировку клеток зародыша, но и обеспечивает развитие зародыша как единой системы. МЕЖКЛЕТОЧНЫЕ ВЗАИМОДЕЙСТВИЯ Межклеточные взаимодействия чрезвычайно важны в развитии и являются одним из механизмов, обеспечивающих интегрированность развития особи. Этот механизм действует на протяжении всего онтогенеза, но особую значимость имеет на ранних этапах эмбриогенеза, а именно, в период дробления. Так, уже на 2-клеточной стадии зародыш представляет собой не совокупность отдельных клеток, а единый организм. Это может быть показано с привлечением результатов ряда экспериментов. Немецкий эмбриолог Вильгельм Ру разрушал одну из клеток зародыша лягушки на стадии 2 бластомеров раскаленной иглой. В ходе дальнейшего развития из оставшегося неповрежденными бластомера формировалась только половина зародыша - полунейрула с полным набором структур правой или левой стороны (рис. 8.28). Однако, как известно, на стадии дробления клетки большинства хордовых тотипотентны. И действительно, если повторить описанный эксперимент и сразу отделить убитый бла-стомер от неповрежденного, то из последнего сформируется абсолютно полноценный организм. Аномальное развитие зародыша в опыте В. Ру наблюдалось вследствие контакта бластомеров. Неповрежденный бла-стомер, благодаря наличию межклеточных влияний, «определял» себя только как часть целого организма и развивался в соответствии с полученной информацией. При отделении этого бластомера сигналов к нему от погибшей клетки не поступало, и он давал начало полноценной особи. Таким образом, уже начиная со стадии 2 бластомеров, каждый из них развивается как часть единого организма в соответствии с сигналами, полученными от своего окружения.
Рис. 8.28. Схема эксперимента В. Ру
Межклеточные взаимодействия - основной механизм дифференци-ровки клеток зародышей, характеризующихся регуляционным типом развития. Однако у организмов с ярко выраженным мозаичным типом развития также осуществляются подобные взаимодействия между бла-стомерами. Так, у оболочников только две пары передних бластомеров 8-клеточного зародыша способны образовывать нервную систему, однако развитие нейральных структур возможно лишь при контакте этих двух пар клеток между собой. Если же эти пары бластомеров разобщить, то формирования нервных клеток не происходит. Внешние сигналы, поступающие прямо или опосредованно от других клеток организма, а также от структур внеклеточного матрикса, играют решающую роль в выборе клеткой направления дифференцировки. Именно такой путь обеспечивает гибкую и тонкую пространственно-временную координацию дифференцировок, без чего невозможно нормальное развитие. Воздействовать друг на друга клетки могут следующими способами. Во-первых, формируя межклеточные контакты, во-вторых, за счет диффузии веществ от одной клетки к другой, в-третьих, в результате контакта между клеткой и матриксом, сформированным другими клетками (рис. 8.29). При этом могут наблюдаться обмен молекулами, изменение в межклеточной среде концентрации ионов, выделение продуктов жизнедеятельности, электрические и механические взаимодействия. Было продемонстрировано, например, что на поздних стадиях дробления между клетками зародыша шпорцевой лягушки передаются электрические импульсы. После электрического разобщения клеток дальнейшее развитие нарушается.
Рис. 8.29. Возможные варианты межклеточных взаимодействий
Остановимся на значении межклеточных контактов для дифферен-цировки. Давно обнаружено, что одиночные эмбриональные клетки дифференцируются плохо, тогда как контакты с соседними клетками существенно активируют этот процесс. Явление получило название «эффект коммунальности». В некоторых случаях увеличение числа клеток в развивающемся фрагменте может привести к расширению спектра его возможных дифференцировок. Так, если срастить вместе несколько дорсальных губ бластопора ранней гаструлы тритона, то возникнет более обширный набор осевых зачатков, нежели из одной губы. Напротив, даже кратковременное нарушение межклеточных контактов существенно ограничивает возможности дальнейшего развития этого фрагмента. Например, у амфибий в период гаструляции даже кратковременное (на несколько десятков секунд) разобщение клеток хордоме-зодермы приводит к изменению их возможностей к дифференцировке. Нарушение контактов между дифференцированными клетками взрослого организма может привести к утрате их дифференцированного состояния, а в некоторых случаях - к злокачественному перерождению. Яркие примеры влияния межклеточных взаимодействий на процесс клеточной специализации можно наблюдать в ходе дробления. В эксперименте было показано, что у прудовика, развитие которого мозаично, бластомер 3D во время паузы в дроблении на стадии 24 бластомеров увеличивает число своих соседей с 6 до 24. Одно из ближайших последствий «катастрофы связности» состоит в том, что меняются характеристики клеточного цикла этого бластомера, и он делится неодновременно со всеми остальными, имеющими по 5-6 соседей. Вероятно, именно благодаря этому потомки только данной клетки дают начало всей мезодерме и развивающимся из нее структурам. В ходе дробления мыши на стадии 8-клеточного зародыша происходит его компактизация. Рыхло расположенные клетки внезапно сближаются, площадь контактов между ними увеличивается, и они образуют компактный клеточный шар. В результате более тесного прилегания друг к другу бластомеры изменяют свою форму от сферической до уплощенной, при этом контур зародыша сглаживается (рис. 8.30). Между уплощающимися клетками, расположенными на поверхности, возникают плотные контакты, и этот слой изолирует внутренние клетки округлой формы, связанные между собой щелевыми контактами.
Рис. 8.30. Компактизация и образование бластоцисты: а - ранний 8-клеточ-ный зародыш; б - 8-клеточный зародыш после компактизации; в - морула (32 клетки); г - бластоциста; д - микрофотографии 8-клеточного зародыша мыши (сканирующая электронная микроскопия): д1 - до компактизации; д 2 - после компактизации. I - компактизация; II - кавитация. 1 - плотные контакты; 2 - щелевые контакты; 3 - внутренняя клетка; 4 - наружная клетка; 5 - клетка трофобласта; 6 - клетка эмбриобласта; 7 – бластоцель
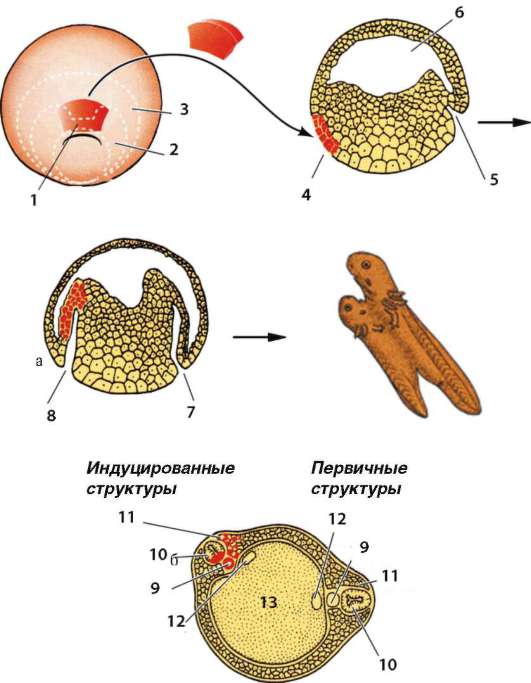
Большая часть потомков наружных клеток, соединенных плотными контактами, становится клетками трофобласта и участвует в образовании плодной части плаценты. Потомки внутренних клеток, объединенных щелевыми контактами, образуют эмбриобласт, который даст начало зародышу и ряду внезародышевых структур, таких как амнион, аллантоис, желточный мешок. Клетки эмбриобласта отличаются от клеток трофобласта не только по своему виду, но и по спектру белков, которые они синтезируют. Таким образом, возникновение различий между этими двумя группами клеток является ранним процессом дифференцировки в развитии млекопитающих, и базирующимся на межклеточных взаимодействиях. Щелевым контактам принадлежит особая роль в межклеточных взаимодействиях. Это специфические области, где плазматическая мембрана одной клетки вступает в тесный контакт с плазматической мембраной другой клетки. У большинства зародышей по крайней мере ранние бла-стомеры связаны именно такими контактами, в результате чего небольшие растворимые молекулы и ионы свободно проходят между ними. Показано, что щелевые контакты формируются в точно определенное время, когда возникает необходимость передачи информации от одного бластомера другому. О значении этих контактов в развитии можно судить по результатам опытов, выполненных на зародышах амфибий и млекопитающих. Когда в один из бластомеров 8-клеточного зародыша амфибии путем микроинъекции вводили антитела к белкам щелевых контактов, то потомки этой клетки не могли обмениваться молекулами веществ с соседними бластомерами. Головастики, развившиеся из обработанных таким способом зародышей, оказались дефектными, и эти дефекты развития были прямо связаны с судьбой инъецированной клетки. Потомки такой клетки не погибали, но оказывались неспособными следовать по нормальному пути развития. Контактные взаимодействия между клетками важны для дифферен-цировки на всех стадиях развития - от самых ранних и до взрослого состояния. Обнаружено, что при формировании сложных фасеточных глаз у дрозофилы межклеточные взаимодействия распространяются по эмбриональной ткани в виде волны. Области образующихся межклеточных контактов имеют разную форму. Установлено, что дифференцировка клеток зависит от геометрии их контактных зон с соседними клетками. Клетки с одинаковой формой контактов дифференцируются в одном и том же направлении. Среди всех остальных выявляется одна фоторе-цепторная клетка, которая отличается от других по этому показателю. Именно она может воспринимать ультрафиолетовую область спектра. Таким образом, межклеточные взаимодействия важны для развития организма и его целостности, особенно в период дробления. Начиная со стадии бластулы, ведущим интегрирующим механизмом онтогенеза становится эмбриональная индукция. ЭМБРИОНАЛЬНАЯ ИНДУКЦИЯ По мере развития организма взаимодействия отдельных клеток сменяются взаимодействиями более крупных элементов зародыша - клеточных комплексов, формирующих структуры, ткани, зачатки органов зародыша. Примером таких влияний служит эмбриональная индукция - взаимодействие элементов развивающегося зародыша, при котором воздействие одного из них направляет (индуцирует) развитие другого. В результате такого взаимодействия запускается цепь морфогенетических (формообразовательных) процессов. Элемент, оказывающий воздействие, назван индуктором. Способность воспринимать индукционное воздействие и отвечать на него определяется как компетенция, а элемент организма, способный реагировать на индукционное воздействие изменением своего развития, назван компетентной тканью. В результате компетентная ткань становится детерминированной (предопределенной) к специфическому типу развития. Далее детерминированное состояние реализуется в процессе дифференцировки (дифференциации). Следует понимать, что индукционные взаимодействия осуществляются на основе межклеточных, без которых не обходится ни один этап развития. Феномен эмбриональной индукции был открыт немецким эмбриологом Г. Шпеманом и его ученицей Г. Мангольд в 1921 г. в серии экспериментов по изучению свойств материала хордомезодермы. Для того чтобы иметь возможность проследить за судьбой клеток при трансплантации, были использованы два вида тритонов, отличающихся по окраске эмбриональных тканей: гребенчатый тритон, клетки которого не содержат пигмента, и обычный тритон с пигментированными клетками. Участок дорзальной губы бластопора, содержащий материал хордоме-зодермы, зародыша гребенчатого тритона на стадии ранней гаструлы пересаживали в (под) боковую или брюшную эктодерму обыкновенного приблизительно той же стадии развития. У зародыша-реципиента в месте пересадки наблюдалось образование второго комплекса осевых органов (хорды, нервной трубки и сомитов). В некоторой доле случаев развитие завершалось формированием дополнительного зародыша (рис. 8.31). По распределению неокрашенных и пигментированных клеток было установлено, что почти вся нервная трубка и значительная часть мезодермы возникли из тканей реципиента, а пересаженная хор-домезодерма образовала, как и следовало ожидать, хорду, часть мезодермы, а также небольшой участок нервной трубки. Описанное явление получило название первичной эмбриональной индукции. Зачаток хордомезодермы, локализованный в дорзальной губе бластопора, был назван первичным эмбриональным индуктором. Эктодерма, воспринимающая воздействие и отвечающая формированием нервной трубки в этом эксперименте представляет собой компетентную ткань.
Рис. 8.31. Эксперимент Г. Шпемана по пересадке спинной губы бластопора от зародыша-донора зародышу-реципиенту: а - схема опыта; б - поперечный срез на стадии закладки двух комплексов осевых органов. 1 - спинная губа бластопора; 2 - презумптивная мезодерма; 3 - презумптивная хорда; 4 - материал донора; 5 - инвагинация; 6 - бластоцель; 7 - первичная инвагинация; 8 - вторичная инвагинация; 9 - хорда; 10 - нервная трубка; 11 - мезодерма; 12 - полость кишки; 13 – энтодерма
В ходе дальнейших исследований было показано, что ткань индуктора не сразу приобретает способность направлять формирование всего спектра структур, который образуется под ее влиянием. Наблюдается созревание способности к индукции - постепенное приобретение каждой частью индуцирующей ткани возможности оказывать воздействие на формирование определенных элементов зародыша. Если пересадить дорзальную губу ранней гаструлы, то индуцируется развитие структур переднего мозга, если же пересадить дорзальную губу поздней гаструлы, то развиваются спинной мозг и мезодермаль-ные ткани (рис. 8.32). Осуществление индукции возможно лишь при условии, что клетки реагирующей ткани способны воспринять воздействие, т.е. являются компетентными. Только в этом случае они отвечают образованием соответствующих структур. Компетенция ткани также возникает на определенной стадии развития. Клетки реагирующей ткани должны пройти определенные фазы развития, прежде чем они приобретут способность к дифференцировке под влиянием сигналов индуктора. Состояние компетенции к воздействию определенного индуктора сохраняется ограниченное время. Затем может появиться компетенция к другому индуктору. Для каждого индуктора также характерно наличие определенного периода функциональной активности. В эксперименте на амфибиях показано, что компетенция к образованию нервной ткани у амфибий возникает с начала гаструляции и затрагивает всю эмбриональную эктодерму. К концу этой стадии компетенция прекращается. Время контакта между хордой и нейроэктодер-мой при первичной индукции должно быть не менее 4 ч. При меньшем по времени индуцирующем воздействием формирования нейральных структур не происходит.
Рис. 8.32. Результаты пересадки дорзальной губы бластопора на стадиях ранней (а) и поздней (б) гаструлы (объяснение в тексте)
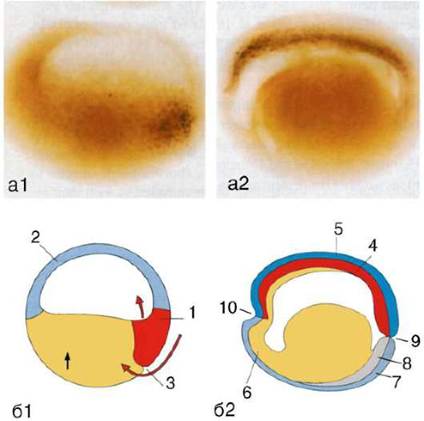
Пересадка материала дорзальной губы бластопора на стадии нейру-ляции не приводит к формированию дополнительной нервной трубки. Это объясняется тем, что эктодерма на указанной фазе развития уже не способна отвечать на сигналы данного индуктора. Однако она становится компетентна в отношении иных индукторов. Например, на индуцирующее действие глазного пузыря отвечает образованием хрусталика. Задний мозг сходным образом может индуцировать образование из прилегающей к нему эктодермы слухового пузырька. Кроме вышеперечисленного для эффективного ответа на индуцирующее влияние необходимо наличие в компетентной ткани определенного, минимального числа клеток, т.е. требуется некоторый «порог массы». Одиночные клетки не воспринимают действие индуктора. Если же их число превышает «порог массы» и клетки обладают минимальной организацией, то количество образуемых структур из возможного спектра для данной конкретной индукции зависит от объема реагирующей ткани. Чем больше в ней клеток, тем активнее ее реакция. При этом для оказания индуцирующего воздействия достаточно лишь одной клетки индуктора. Во всех классах хордовых индукционные взаимодействия между хор-домезодермальным и нейральным зачатками подобны таковым у амфибий. У зародышей амниот (птиц, рептилий и млекопитающих) зачаток хордомезодермы локализован в области гензеновского узелка. Поэтому второй зародыш сходным образом «организуется» благодаря воздействию спинной губы бластопора, а у птиц и млекопитающих подобное действие оказывает гензеновский узелок. Интересно, что у ланцетника и круглоротых активен только туловищный индуктор, стимулирующий формирование нервной трубки (спинного мозга), а головной индуктор не действует. Это, безусловно, связано с отсутствием головного мозга у бесчерепных и слабым его развитием у круглоротых. У костистых рыб уже присутствуют оба индуктора. В целом формирование гомологичных структур в группах эволю-ционно родственных организмов происходит под контролем сходных индукций. Так, для формирования придатков кожи необходимо стимулирующее влияние мезодермы на эпидермис кожи. Показано, что начальные этапы формирования кожных придатков у амниот можно индуцировать дермой зародышей других классов, например дерма ящерицы стимулирует развитие волос в эпидермисе мыши. Это свидетельствует о том, что эмбриональная индукция как один из важнейших механизмов развития имеет большое эволюционное значение, а сами индукторы зачастую эволюционно консервативны. После открытия явления первичной эмбриональной индукции были предприняты неоднократные попытки идентифицировать индуцирующие молекулы, выделяемые первичным организатором, определить их свойства и механизм действия. В 1932 г. группа исследователей, возглавляемая Г. Шпеманом, экспериментально продемонстрировала химическую природу индуцирующего сигнала, вызывающего формирование нейральных структур. Вскоре выяснилось, что индукцию могут вызывать разнообразные убитые ткани, вытяжки из различных живых тканей беспозвоночных и позвоночных животных, а также растений, несколько классов химических соединений (белки, нуклеопротеины, стероиды и даже неорганические вещества). Новый этап исследований молекулярных механизмов эмбриональной индукции начался примерно 20 лет назад, когда благодаря прогрессу молекулярной биологии оказалось возможным связать индукционные процессы, как и вообще клеточную дифференцировку, с активацией или репрессией работы определенных генов, ответственных за синтез специфических белков. Было установлено, что на ранних стадиях эмбриогенеза в зародыше синтезируются белки семейства ВМР (от англ. bone morphogenetics proteins - морфогенетические белки, получаемые из костного мозга), входящие в надсемейство TGF-β - трансформирующих факторов роста β. Их концентрация наивысшая на вентральной стороне зародыша. Белки секретируются в межклеточное пространство, связываются с мембранными рецепторами эмбриональных клеток и препятствуют их диффе-ренцировке в нервную ткань и другие производные осевых зачатков, позволяя развитие только в сторону покровной эктодермы. Для осуществления формирования нервной трубки (нейральной дифференци-ровки) взаимодействие ВМР с рецепторами мембран клеток-мишеней должно быть предотвращено. Клетки шпемановского организатора - хордомезодермы - секре-тируют в межклеточное пространство белки chordin и noggin. Их функция состоит в том, чтобы связывать молекулы ВМР в межклеточном пространстве, препятствуя их взаимодействию с мембранными рецепторами клеток. В отсутствие ВМР клетки дорзальной эктодермы дифференцируются в нервную ткань (рис. 8.33). Таким образом, реализуется «индукция по умолчанию», поскольку данная дифференцировка не требует дополнительных стимулирующих воздействий, а нуждается лишь в блокировании ВМР, и именно его осуществляет шпемановский индуктор. Это открытие привело к существенному пересмотру традиционных представлений о первичной индукции. Ранее считалось, что базисный путь дифференцировки эмбриональных клеток, не требующий индукционных влияний, - их развитие в покровную эктодерму.
Рис. 8.33. Локализация мРНК белка noggin в ткани зародыша амфибии, выявленная методом гибридизации in situ (черные точки): а - фотографии; б - соответствующие схемы. а1, б1 - бластула; а2, б2 - гаструла. 1 - шпемановский организатор; 2 - презумптивная эктодерма; 3 - место начала инвагинации (дорзальная губа бластопора); 4 - зачаток хорды (хордомезодерма); 5 - ней-роэктодерма; 6 - энтодерма; 7 - эктодерма; 8 - мезодерма; 9 - бластопор; 10 - место образования будущего рта
Подразделение нервной системы на отделы также осуществляется путем «индукции по умолчанию». Выяснено, что в межклеточном пространстве на стадии гаструлы присутствуют белки семейства Wnt. Оказалось, что если не препятствовать их связыванию с рецепторами клеток презумптивной (предполагаемой) нейральной эктодермы, то вся нервная пластинка развивается в спинной мозг. Вещества семейства Wnt связываются в межклеточном пространстве белками ucrberus и Dickkopf, которые секретируются передней частью хордомезодермы - прехор-дальной пластинкой. Следствием такого взаимодействия становится активация в клетках, соответственно, передней части нервной пластинки определенных генов, среди которых ОТХ-2, anf и другие, что и приводит в результате к формированию головного мозга и его отделов. Однако механизмы индукции не определяются только лишь включением и выключением определенных генов. Как и любой процесс в организме, регуляция индуктивных взаимодействий осуществляется на нескольких уровнях, она многогранна и к настоящему времени еще далеко не полностью изучена. Так, несмотря на многочисленные эксперименты, не удалось с достоверностью обнаружить химический фактор, выделяемый глазным бокалом и необходимый для индукции хрусталика, хотя его существование утверждается рядом исследователей. Как было показано в предыдущем разделе, межклеточные взаимодействия, лежащие в основе индукции, могут осуществляться не только вследствие выделения клеткой каких-либо факторов, но и при непосредственном межклеточном контакте, а также через матрикс. Все это справедливо и для индуктивных взаимодействий. Например, установлено, что для развития метанефрогенной мезенхимы формирующейся почки под действием чужеродного индуктора (нервной ткани) необходим непосредственный контакт между клеточными отростками индуктора и реагирующей ткани. Роль компонентов внеклеточного матрикса в индуктивных процессах показана в том числе и в эксперимента
|
||
|
Последнее изменение этой страницы: 2016-07-15; просмотров: 1366; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.141 (0.017 с.) |