
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Зміна ступені перетворення при iзотермічному режиміСодержание книги
Поиск на нашем сайте
Для визначення ступені перетворення по довжині реактора необхідно визначити залежність зміни міри перетворення (х) по довжині реактора.Для цього розглянемо стаціонарний режим у РІВ. Швидкість хімічного перетворення для реакції першого порядку визначається наступним виразом: W = K × C = K × C0 (2.33) де К-константа швидкості реакції, залежна від температури К = Kо × е–Е/(R*T) C0, C - початкове і поточне значення концентрації; Х=(С0 - С)/С0 - ступінь перетворення В iзотермічному режимі Т=const, отже, К=const. В стаціонарному режимі рівняння матеріального балансу має наступний вигляд (тому що dС/dt=0):
У (2.34) висловимо значення концентрації через ступінь перетворення і замість W підставимо його значення з (2.33). Одержимо:
Т.к. L/U=t, отже dZ/U = dt.Тоді замість (2.35) можна записати: dX / dZ = K(1–X) `(2.36) Для того,щоб визначити зміну ступені перетворення по довжині реактора,слід проiнтегрувати (2.36).
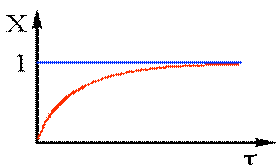
Отримаємо: -ln(1–X)=Kt (2.37) Перетворив (2.37),одержимо: X = 1 – e–Kt (2.38) Одержаний вираз дозволяє визначити Х по довжині реактора (рiс.2.12). З аналізу(2.38) видно,що практично неможливо одержати ступінь перетворення рівну 1 Аналогічна залежність-зміна концентрації по довжині реактора має вигляд: С = С0 – e–Kt (2.39)
Рис 2.12
Зміна ступеня перетворення при адiабатичному режимі
зменьшується і ступінь перетворення практично не змінюється
Рис 2.13 Зіставлення РІЗ та РІВ Порівняння реакторів найбільш слушно проводити по якомусь параметру, що визначає техніко-економічні показники. У вигляді такого параметра частіше всього використовують час перебування t. Співвідношення між часами перебування в РІЗ (tз) і в РІВ (tв) залежно від ступеня перетворення розглянемо для простійшого випадку - протікання реакції першого порядку при iзотермічних умовах і постійному обсязі.
Для РІЗ із (2.7) слідує: t = (CBX – C)/W (2.40) де t = V / Q. Так.як.у данному випадку W=K×C, то висловивши в (2.40) значення концентрації через ступінь перетворення,отримаємо залежність часу перебування від ступені перетворення для РІЗ:
Для РІВ залежність часу перебування від ступені перетворення може бути одержана з рівняння (2.37) tв= – 1 / K – Ln(1–X) (2.42) Тоді відношення t = –1/K–Ln(1–X) буде функцією тільки ступені перетворення:
Проведемо зіставлення РІЗ і РІВ,задаючи різні значення міри ступе ні перетворення, зіставляючи моделі по відношенню tC/tB (табл.2.2) Таблиця 2.2
З приведеного зіставлення видно,що час перебування у реакторі ідеального змішеняя завжди більше,ніж у реакторі ідеального витиснення. При цьому, чим вище ступінь перетворення Х, тим t більше відрізняється від tB. Оскільки час перебування прямопропорційний обсягу апарата, то необхідний обсяг РІЗ завжди більше,чим обсяг РІВ. При рівних обсягах реакторів ступінь перетворення Х в РІВ досягає понад більш високих значень,чим у РІЗ. Треба визначити,що відношення обсягу реакторів збільшується з підвищенням порядку реакції. Графіки залежності ступеня перетворення і концентрації від часу контакту приведені на рис.2.14 та 2.15.
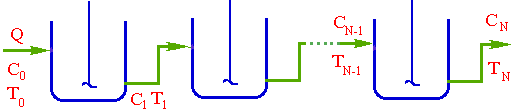
Рис 2.14 Рис 2.15 Для РІВ ступінь перетворення та концентрація змінюється плавно по всій довжині реактора,тому у будь-якому перетині по t середня швидкість процесу вище,чим у РІЗ. Незважаючи на очевидні привілеї РІВ в хімічній промисловiсті надто часто застосовуються і РІЗ, особливо у вигляді каскада реакторів. Це пояснюється передусім простотою їх виготовлення, полегкістю регулювання температури, доступністю узлів апарату, що полегшує очистку внутрішніх поверхностей. Ячеєчна модель Ця модель схематично представляє реальний апарат як деяке число однакових послідовно сполучених ячеєк (аппаратів) ідеального змешення (рiс.2.17) Сумарний обсяг всіх ячеєк дорівнює обсягу реального апарату, отже, обсяг кожної ячейкi дорівнює V/n. Кількість ячеєк n є параметром, що характеризує ячеєчну модель реального апарату. Якщо n = 1, оте ячеєчна модель переходить у модель ідеального перемішення, а у випадку n = ∞ – у модель ідеального витіснення.
У ряді випадків в апаратах справді можна виділити дільниці по ходу потоку, в кожному з яких режим близок до ідеального перемішення - каскад реакторів ідеального перемішення, тарельчата барботажна колона, реактор з кiпящим шаром.
Рис 2.17
При складанні ячеєчної моделі використовуються наступні допущення: - в кожній ячейкі потік має структуру ідеального перемішення й концентрація Cі не змінюється у межах відповідної ячейкi (i=1,2, n - індекс ячейкi); - перемішення між ячейками відсутнє; - об'ємна швидкість Q не змінюється. Крім отого,частіше всього для вигоди розрахунків приймається, що - объєм кожної з n ячєєк однаков та дорівнює Vi: - сума объємів всіх ячеєк дорівнює загальному обйому зони,для якої справедлива ячеєчна модель (V = nVi) - середній час перебування часток у кожній ячейкі t=V/Q=tс/n, а середній час перебування у системі tс = V/Q. Оскільки у кожної ячейкі дотримується режим ідеального перемішення, оте для будь-який i-ой ячейкi справедливо порівняння моделі РІС:
або
де i = 1, 2,...,n. Система порівняннь уявляє собою матеріальні баланси в кожної з прийнятих n ячеєк.
………………..
Рівняння енергетичного балансу має наступний вигляд:
…………………………………………. (2.46)
Кiнетичні порівняння Оскільки концентрація змінюється східчасто від ячейкi до ячейкі, оте швидкості реакції в кожному реакторі різні. W = F(CI,ТI), I = 1, 2, 3... n Початкові умови та обмеження записуються для кожної ячейкi аналогічно моделі РIС. Порівняємо профілі концентрацій у реакторах РІВ, РІЗ та каскаді реакторів ідеального перемішення при n=3 (рiс. 2.18). Зіставлення проводиться при однакових початкових концентраціях САо і Х = const, де Х - міра перетворення.
Рис.2.18
Для необернутої реакції першого порядку міра перетворення при будь-якому числі ячеєк n визначається по наступній формулі:
Легко переконатися,щo при n = 1 вираз (2.47) переходить у (2.13), а при n → ∞ прагне до (2.38). Також з (2.47)видно,що з зростанням числа ячеєк міра перетворення достатньо швидко наближається до результатів,характерних для режиму ідеального витіснення. Цим і пояснюється, що у хімічній технології часто використовують прийом секціонiрованiя - апарати, у яких створюється інтенсивне змішення потоку, поділяють на послідовні секції.
|
||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-07-11; просмотров: 458; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.117.91.116 (0.01 с.) |

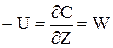 (2.34)
(2.34)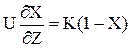 (2.35)
(2.35)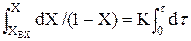
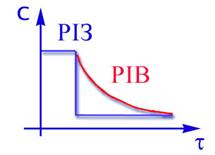
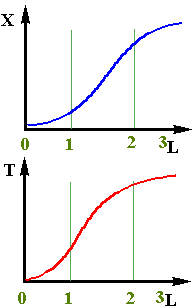 При адiабатичному протіканнi процесу визначити зміну ступеня перетворення по довжині реактора можна тільки при сумісному рішенні дорівнень матеріального і теп-лового балансів. Якісно цю залежність можна пояснити наступним чином (рiс.2.13). На початковій дільниці шару (0- 1) ступінь перетворення буде мала, тому що із-за низьких температур швидкість хiмiчного перетворення буде невелика. На наступних дільницях шару за рахунок протікання хімічної реакції температура зростає, концен-трація вихідного компонента ще достатньо велика і швидкість реакції помітно збільшується,що приводить до чималого збільшення ступеня перетворення (участок 1 - 2). До кінця шару (участок 2 - 3) вихідного компоненту практично не залишається і,відповідно, швидкість реакції
При адiабатичному протіканнi процесу визначити зміну ступеня перетворення по довжині реактора можна тільки при сумісному рішенні дорівнень матеріального і теп-лового балансів. Якісно цю залежність можна пояснити наступним чином (рiс.2.13). На початковій дільниці шару (0- 1) ступінь перетворення буде мала, тому що із-за низьких температур швидкість хiмiчного перетворення буде невелика. На наступних дільницях шару за рахунок протікання хімічної реакції температура зростає, концен-трація вихідного компонента ще достатньо велика і швидкість реакції помітно збільшується,що приводить до чималого збільшення ступеня перетворення (участок 1 - 2). До кінця шару (участок 2 - 3) вихідного компоненту практично не залишається і,відповідно, швидкість реакції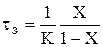 (2.41)
(2.41)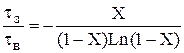 (2,43)
(2,43)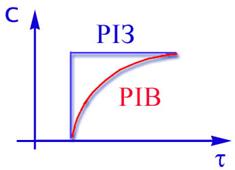
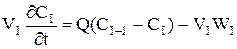 (2.43)
(2.43)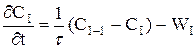 (2.44)
(2.44)
 (2.45)
(2.45)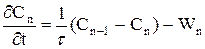
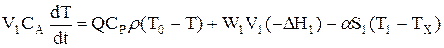

 Для останньої ячейкi концентрація речовини А у ячеєчної моделі співпадає з його концентрацією при ідеальних режимах (витиснення та перемішення).Но перші ячейкi працюють при великих значеннях СA,чим ячeєчна модель при режимі ідеального витиснення, та, відповідно,в них швидкість хімічного перетворення вище. Інакше кажучи, середня концентрація у каскаді реактора виявляється більш високою, чим у РИС. Тому обсяг каскаду реакторів завжди менш, ніж обсяг одного РИС при отих же характеристиках процесу.
Для останньої ячейкi концентрація речовини А у ячеєчної моделі співпадає з його концентрацією при ідеальних режимах (витиснення та перемішення).Но перші ячейкi працюють при великих значеннях СA,чим ячeєчна модель при режимі ідеального витиснення, та, відповідно,в них швидкість хімічного перетворення вище. Інакше кажучи, середня концентрація у каскаді реактора виявляється більш високою, чим у РИС. Тому обсяг каскаду реакторів завжди менш, ніж обсяг одного РИС при отих же характеристиках процесу.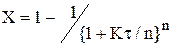 (2.47)
(2.47)


