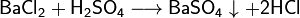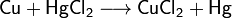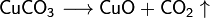Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Факторы, влияющие на скорость химической реакции.Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
1. Концентрация – скорость прямо пропорциональна произведению концентрации реагирующих веществ, взятых в степенях, равных их коэффициентам в уравнении химической реакции (закон действующих масс). 2. Температура – при повышении температуры на каждый 10 градусов скорость реакции увеличивается в 2-4 раза (правило Вант-Гоффа). 3. Поверхность взаимодействия реагирующих веществ (для гетерогенных реакций). Для таких реакций часто применяют измельчение твердых веществ, их перемешивание. 4. Присутствие катализаторов и ингибиторов – скорость реакций зависит от катализаторов (веществ, увеличивающих скорость реакций) и ингибиторов (вещества, уменьшающие скорость теакций)
3. Определите направление перемещения электронов во внешней цепи следующих гальванических элементов: Fe½Fe(NO3)2½½ Pb(NO3)2½Pb; Cu½Cu(NO3)2½½ AgNO3½Ag; Zn½ZnSO4½½ MgSO4½Mg. Составьте уравнения реакций, протекающих на электродах. ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ № 5
Виды гидратов оксидов. Кислоты, основания, амфотерные гидроксиды. Амфотерные гидроксиды — неорганические соединения, гидроксиды амфотерных элементов, в зависимости от условий проявляющие свойства кислотных или основных гидроксидов. Все амфотерные гидроксиды являются твёрдыми веществами. Нерастворимы в воде, в основном являются слабыми электролитами. Общие свойства Все амфотерные гидроксиды являются твёрдыми веществами. Нерастворимы в воде, в основном являются слабыми электролитами. При нагревании разлагаются с образованием соответствующего амфотерного оксида, например:
В ряде случаев промежуточным продуктом при разложении является метагидроксид, например:
При взаимодействии с кислотами образуют соли с амфотерным элементом в катионе, например:
При взаимодействии со щёлочью образуют соли с амфотерным элементом в анионе, например:
Получение Общим способом получения амфотерных гидроксидов является осаждение разбавленной щёлочью из растворов солей соответствующего амфотерного элемента, например:
В ряде случаев при осаждении образуется не гидроксид, а гидрат оксида соответствующего элемента (например, гидраты оксидов железа(III), хрома(III), олова(II) и др.). Влияние концентрации на скорость химической реакции. Основной постулат химической кинетики, называемый также законом действующих масс:
Числа n, m в выражении закона действующих масс называются порядками реакции по соответствующим веществам. Это экспериментально определяемые величины. Сумма показателей степеней n, m называется общим порядком реакции.
3. Составьте уравнения возможных реакций: 1) Zn + H2SO4(разб)Þ ZnSO4 + H2↑ 2)Сu + HCl Þ реакция не пойдет так как медь стоит в ряду напряжения металлов после н 3)2Na + 2HCl Þ H2 +2NaCl 4)2Al + 6H2SO4(конц) Þ Al2(so4)3 +3so2 + 6h2o 5)Ag + H2SO4(разб) Þреакции нет 6)4Mg + 10 HNO3(очень разб) Þ 4Mg(NO3)2 + NH4NO3 + 3H2O
ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ № 6
Средние (нормальные) соли — все атомы водорода в молекулах кислоты замещены на атомы металла. Пример: Кислые соли — атомы водорода в кислоте замещены атомами металла частично. Они получаются при нейтрализации основания избытком кислоты. Пример:, Основные соли — гидроксогруппы основания (OH−) частично замещены кислотными остатками.(CuOH)2 CO3
Химические свойства Химические свойства определяются свойствами катионов и анионов, входящих в их состав.
|
|||||
|
Последнее изменение этой страницы: 2016-06-19; просмотров: 840; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.144.249.63 (0.008 с.) |



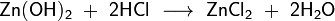

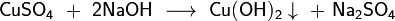
 ,
, 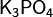 .
.