
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Опыт Резерфорда. Гипотеза Резерфорда. Достоинства и недостатки гипотезы Резерфорда о строении атома.Содержание книги
Поиск на нашем сайте
. Резерфорд предложил применить зондирование атома с помощью α-частиц, которые возникают при радиоактивном распаде радия и некоторых других элементов. Масса α-частиц приблизительно в 7300 раз больше массы электрона, а положительный заряд равен удвоенному элементарному заряду. В своих опытах Резерфорд использовал α-частицы с кинетической энергией около 5 МэВ (скорость таких частиц очень велика – порядка 107 м/с, но все же значительно меньше скорости света). α-частицы – это полностью ионизированные атомы гелия. Они были открыты Резерфордом в 1899 году при изучении явления радиоактивности. Этими частицами Резерфорд бомбардировал атомы тяжелых элементов (золото, серебро, медь и др.). Электроны, входящие в состав атомов, вследствие малой массы не могут заметно изменить траекторию α-частицы. Рассеяние, то есть изменение направления движения α-частиц, может вызвать только тяжелая положительно заряженная часть атома. Схема опыта Резерфорда представлена на рис. 6.1.2.
От радиоактивного источника, заключенного в свинцовый контейнер, α-частицы направлялись на тонкую металлическую фольгу. Рассеянные частицы попадали на экран, покрытый слоем кристаллов сульфида цинка, способных светиться под ударами быстрых заряженных частиц. Сцинтилляции (вспышки) на экране наблюдались глазом с помощью микроскопа. Наблюдения рассеянных α-частиц в опыте Резерфорда можно было проводить под различными углами φ к первоначальному направлению пучка. Было обнаружено, что большинство α-частиц проходит через тонкий слой металла, практически не испытывая отклонения. Однако небольшая часть частиц отклоняется на значительные углы, превышающие 30°. Очень редкие α-частицы (приблизительно одна на десять тысяч) испытывали отклонение на углы, близкие к 180°.
Недостатки ядерной модели Резерфорда: 1. Не объясняет устойчивость атомов во времени. 2. Не объясняет линейчатый характер спектра.
ЗАКОН РАУЛЯ (закон упругости пара), гласит, что ДАВЛЕНИЕ НАСЫЩЕННОГО ПАРА в РАСТВОРЕ - это сумма результатов умножения значений давления насыщенного пара каждого компонента на мольную долю этого компонента в растворе. (МОЛЬНАЯ доля - это отношение количества молей каждого компонента к общему количеству молей раствора.) Закон выполняется лишь приблизительно и при ограниченном ряде условий, различных для различных веществ. Этот закон был открыт французским физхимиком Франсуа-Мари Раулем (1830-1901); используется для вычисления ОТНОСИТЕЛЬНОЙ МОЛЕКУЛЯРНОЙ МАССЫ; послужил базой для многих теорий раствора.
Как изменится скорость прямой и обратной реакции 2NO + O2 Û 2NO2, Если давление в системе повысить в 3 раза?
ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ № 16
Постулаты Бора: 1) Электрон в атоме может находиться не на любых, а только на стационарных орбитах. 2) На стационарных орбитах электрон находится бесконечно долго ни излучая, ни поглощая энергии. 3) При переходе электрона с одной орбиты на другую энергия выделяется или поглощается только целым числом квантов.
Эбулиоскопия — метод исследования растворов, основанный на измерении повышения их температуры кипения по сравнению с чистым растворителем. Используется для определения молекулярной массы растворенного вещества, активности растворителя, степени диссоциации (или изотонического коэффициента). Температура кипения жидкости — такая температура, при которой давление пара над жидкостью равно внешнему давлению. В то же время давление пара над раствором нелетучего вещества практически полностью определяется давлением пара растворителя и, в соответствии с законом Рауля, может быть выражено уравнением:
где Эбулиоскопическая константа растворителя равна повышению температуры кипения одномоляльного раствора.
|
|||||||
|
Последнее изменение этой страницы: 2016-06-19; просмотров: 1436; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.117.71.135 (0.01 с.) |



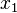 — мольная доля растворителя.
— мольная доля растворителя.


