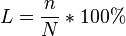Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Кислотами называются электролиты, при диссоциации которых в качестве катионов образуются только катионы водородаСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Н3РО4 Н2РО-4 НРО2-4 Основаниями называются электролиты, при диссоциации которых в качестве анионов образуются только гидроксид-ионы. KOH NH4OH Солями называются электролиты, при диссоциации которых образуются катионы металлов а также катион аммония (NH+4) и анионы кислотных остатков Например: (NH4)2SO4 Так диссоциируют средние соли. Кислые же и основные соли диссоциируют ступенчато. У кислых солей вначале отщепляются ионы металлов, а затем катионы водорода. Например: KHSO4 HSO-4 У основных солей вначале отщепляются кислотные остатки, а затем гидроксид-ионы. Mg(OH)Cl 3. В гомогенной системе N2 + 3H2 Û 2NH3 равновесные концентрации [N2]р = 0,2 моль/л; [H2]р = 0,3 моль/л; [NH3]р = 1,2 моль/л. Вычислите константу равновесия системы и исходные концентрации азота и водорода.
ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ № 20 Экспериментальное обоснование Периодического закона Одна из главных причин невозможности объяснить физический смысл периодического закона и структуру периодической системы состояла в том, что было неизвестно, как построен атом. Важнейшей вехой на пути развития периодической системы явилось создание атомной модели Э. Резерфордом (1911). На ее основе голландский ученый А. Ван ден Брук (1913) высказал предположение, что порядковый номер элемента в периодической системе численно равен заряду ядра его атома (Z). Это экспериментально подтвердил английский ученый Г. Мозли (1913). Периодический закон получил физическое обоснование: периодичность изменения свойств элементов стала рассматриваться в зависимости от Z-заряда ядра атома элемента, а не от атомной массы.
В результате структура периодической системы Менделеева значительно упрочилась. Была определена нижняя граница системы. Это водород - элемент с минимальным Z = 1. Стало возможным точно оценить количество элементов между водородом и ураном. Были определены «пробелы» в периодической системе, соответствующие неизвестным элементам с Z = 43, 61, 72, 75, 85, 87. Однако оставались неясными вопросы о точном количестве редкоземельных элементов и, что особенно важно, не были вскрыты причины периодичности изменения свойств элементов в зависимости от Z.
Опираясь на сложившуюся структуру периодической системы и результаты изучения атомных спектров, датский ученый Н. Бор в 1918 — 1921 гг. развил представления о последовательности построения электронных оболочек и подоболочек в атомах. Ученый пришел к выводу, что сходные типы электронных конфигураций атомов периодически повторяются. Таким образом, было показано, что периодичность изменения свойств химических элементов объясняется существованием периодичности в построении электронных оболочек и подоболочек атомов. Сильные и слабые электролиты. Степень электролитической диссоциации. Электролит — вещество, расплав или раствор которого проводит электрический ток вследствие диссоциации на ионы, однако само вещество электрический ток не проводит.
Сильные электролиты — электролиты, степень диссоциации которых в растворах равна единице (то есть диссоциируют полностью) и не зависит от концентрации раствора. Сюда относятся подавляющее большинство солей, щелочей, а также некоторые кислоты (сильные кислоты, такие как: HCl, HBr, HI, HNO3).
Слабые электролиты — степень диссоциации меньше единицы (то есть диссоциируют не полностью) и уменьшается с ростом концентрации. К ним относят воду, ряд кислот (слабые кислоты), основания p-, d-, и f- элементов.
Степень диссоциации — величина, характеризующая состояние равновесия в реакции диссоциации в гомогенных (однородных) системах. "Степень диссоциации это есть отношения числа продиссоциируемых молекул к общему числу молекул и умноженному на 100%":
3. Как изменится состояние равновесия в системах: 2Н2 + O2 Û 2Н2О – 483,6 кДж, N2 + O2 Û 2NO – 180,8 кДж, если а) повысить температуру; б) увеличить давление; в) увеличить концентрации продуктов реакции?
ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ № 21
|
|||||
|
Последнее изменение этой страницы: 2016-06-19; просмотров: 1018; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.143.251.133 (0.011 с.) |

 Н+ + Н2РО-4(первая ступень)
Н+ + Н2РО-4(первая ступень)