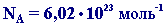Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Молекулярная масса - сумма масс атомов, входящих в состав данной молекулы.Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Моль - это такое количество вещества, в котором содержится определенное число частиц (молекул, атомов, ионов), равное постоянной Авогадро Молярная масса вещества (M) – масса, которую имеет 1 моль данного вещества.
Химическое равновесие. Константа равновесия в гомогенных химических реакциях. Химическое равновесие – такое состояние системы, при котором скорость прямой реакции равна скорости обратной реакции. Константа равновесия — величина, определяющая для данной химической реакции соотношение между термодинамическими активностями (либо, в зависимости от условий протекания реакции, парциальными давлениями, концентрациями или фугитивностями) исходных веществ и продуктов в состоянии химического равновесия (в соответствии с законом действующих масс). Зная константу равновесия реакции, можно рассчитать равновесный состав реагирующей смеси, предельный выход продуктов, определить направление протекания реакции. Для восстановления 15,7 кг оксида хрома алюминотермическим способом было взято 5кг алюминия. Сколько хрома образовалось? Какое из исходных веществ оказалось в избытке?
ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ № 9 Законы сохранения массы и постоянства состава. Закон сохранения массы – масса веществ, вступивших в реакцию, равна массе веществ, образовавшихся в результате реакции.
Закон постоянства состава - каким бы способом ни было получено вещество, его химический состав и свойства остаются неизменными. Сдвиг химического равновесия. Принцип Ле Шателье. Принцип Ле Шателье – если изменить одно из условий – температуру, давление, концентрацию веществ, - при которых данная система находится в состоянии химического равновесия, то равновесие сместится в направлении, которое препятствует этому изменению. 3. Подберите коэффициенты в уравнениях реакций, пользуясь методом полуреакций: a) HBr + H2SO4 Þ Br2 + SO2 + H2O, Br2 + SO2 + 2H2O = 2HBr + H2SO4 2Br +2e =Br(-1) (*2) (окислитель Br2) S(+4)-2e=S(+6) (восстановитель-сера со степенью окисления +4, т.е. SO2)
б) SO2 + K2Cr2O7 + H2SO4 Þ K2SO4 + Cr2(SO4)3 + H2O, 3SO2 + K2Cr2O7 + H2SO4 = K2SO4 + Cr2(SO4)3 +H2O S^+4 - 2e = S^+6 - восстановитель *3 2Cr^+6 + 6e = 2Cr^+3 - окислитель
ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ № 10
Законы кратных и объемных отношений. Закон кратных отношений - Если один и тот же элемент образует несколько соединений с другим элементом, то на одну и ту же массовую часть первого элемента будут приходиться такие массовые части второго, которые относятся друг к другу как небольшие целые числа. Закон объёмных отношений - при постоянном давлении и температуре объемы газов, вступающих в химическую реакцию, находятся в простых отношениях друг к другу и к объемам газообразных продуктов реакции, то есть отношение объемов, в которых газы участвуют в реакции, соответствует отношению небольших целых чисел.
Влияние концентрации, давления, температуры на состояние Химического равновесия. Влияние концентрации – для увеличения скорости прямой реакции (и, следовательно, для смещения равновесия вправо) нужно увеличивать равновесные концентрации исходных веществ и уменьшать равновесные концентрации продуктов реакции.
Влияние давления – имеет смысл только в реакциях с участием газообразных веществ. Если прямая реакция ведёт к уменьшению числа газообразных частиц, и, следовательно, к уменьшению давления, повышение давления смещает равновесие вправо, а уменьшение смещает влево. Если прямая реакция ведёт к увеличению давления, то повышение давления смещает равновесие влево, а уменьшение смещает вправо. Если же в уравнении обратимой реакции число молекул в левой части равно числу молекул в правой части, то изменение давления не вызовет смещения химического равновесия.
Влияние температуры – при повышении температуры в экзотермических реакциях равновесие смещается влево (в сторону уменьшения исходных веществ), а в эндотермических – вправо. Поэтому экзотермические реакции нужно проводить по возможности при низких температурах. Обратимые эндотермические реакции следует проводить при высокой температуре для смещения равновесия вправо.
3. Подберите коэффициенты в уравнениях реакций, пользуясь методом полуреакций: а) Cu2S + HNO3 Þ Cu(NO3)2 + H2SO4 + H2O + NO, В зависимости от степени разбавления и температуры при которой происходит реакция возможны различные продукты, например:
Cu2S + 14 HNO3 => 2 Cu(NO3)2 + H2SO4 + 10 NO2 + 6 H2O
3 Cu2S + 22 HNO3 => 6 Cu(NO3)2 + 3 H2SO4 + 10 NO + 8 H2O Cu2S + 6 HNO3 => 2 Cu(NO3) + H2SO4 + N2 + 2 H2O
б) Na2SO3 + KIO3 + H2SO4 Þ Na2SO4 + I2 + K2SO4 + H2O, 2KJO3 + 6Na2SO3 + H2SO4 = J2 + 6Na2SO4 + K2SO4 + H2O 2JO3(-) + 12H(+) - 10e = J2 + 6H2O ------x1 иод восстанавливается, KJO3 - окислитель SO3(2-) + H2O - 2e = SO4(2-) + 2H(+)----x 6 сера окисляется, Na2SO3 - восстановитель
ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ № 11 Закон эквивалентов. Эквивалент, эквивалентная масса. Способы вычисления эквивалентов простых и сложных веществ по формулам. Эквивалент — это реальная или условная частица, которая может присоединять, высвобождать или другим способом быть эквивалентна катиону водорода в ионообменных реакциях или электрону в окислительно-восстановительных реакциях. Эквивалентная масса — это масса одного эквивалента данного вещества. Закон эквивалентов: Все вещества реагируют и образуются в эквивалентных соотношениях. Понятие раствора. Типы растворов. Растворы – гомогенные системы переменного состава, состоящие из двух и более частей. Истинные растворы – размер растворенных частиц меньше 10(-9) м
|
|||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-06-19; просмотров: 724; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.135.194.220 (0.009 с.) |