
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Причины периодичности свойств элементов.Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Периодическое изменение свойств элементов в периоде объясняется последовательностью заполнения электронами уровней и подуровней в атомах при увеличении порядкового номера элемента и заряда ядра атома. Так как электронные конфигурации атомов элементов изменяются периодически, то соответственно периодически изменяются и свойства элементов, которые определяются их электронным строением: размерами атомов, энергетическими характеристиками, окислительно-восстановительнымим свойствами. Главным химическим свойством атомов элементов является их окислительная или восстановительная способность, которая определяется положением элемента в ПСЭ. В периодах от начала к концу ослабляется восстановительная активность атомов и возрастает окислительная, т. е. наблюдается переход от атомов с типичными свойствами металлов к атомам с типичными свойствами неметаллов, электроотрицательность атомов при этом возрастает. В пределах группы элементов (главной подгруппы) с ростом заряда ядра атомов увеличивается количество энергетических уровней атомов. Таким образом, восстановительная активность атомов по группам сверху вниз возрастает, а окислительная – снижается, уменьшается и величина ЭО атомов. Составьте уравнения реакций в молекулярном, полном и сокращенном ионном виде Ca(HCO3)2 + Ca(OH)2 Þ; MgOHCl + HNO3 Þ.
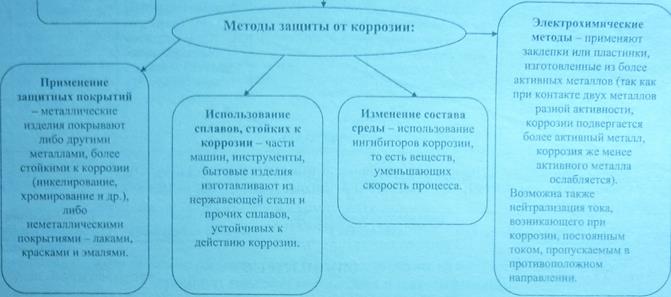
ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ № 42 Методы защиты металлов от коррозии.
Гидролиз солей. Гидролиз – реакция обмена между солью и водой.
Соль образована сильным основанием и слабой кислотой (щелочная среда): Na2CO3 + H2O = NaHCO3 + NaOH
Соль образована слабым основанием и слабой кислотой (нейтральная, слабокислая, слабощелочная среда). Такие соли чаще всего разлагаются водой полностью: AL2S3 + 6H2O = 2AL(OH)3 + 3H2S
Соль образована слабым основанием и сильной кислотой (кислая среда): CuCL2 + H2O = Cu(OH)CL + HCL
Не подвергаются гидролизу соли, образованные сильной кислотой и сильным основанием.
3. Cоставьте полные ионные и молекулярные уравнения, соответствующие приведенным кратким уравнениям реакций: NiOH+ + H+ Þ Ni2+ + H2O; NiOH+ + H+ Þ Ni2+ + H2O NiOH+ + NO3– + H+ + NO3– NiOHNO3 + HNO3 BO33- + 3H+ Þ H3BO3.
ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ № 43 Металлические покрытия. Металлические покрытия наносят гальваническим методом (гальванический электролиз), погружением деталей в расплавленный металл, лужением и методом металлизации (газотермическим напылением).
Основные положения теории электролитической диссоциации С.Аррениуса. 1. Электролитам в водной среде (и в расплавленном состоянии) свойственно распадаться на положительно заряженные ионы (катионы) и отрицательно заряженные ионы (анионы). Свойства ионов резко отличаются от свойств нейтральных атомов составляющих их элементов. Ионы в водных растворах гидратированны (аквакомплексы). Так, нейтральный атом натрия +11Na 1 s 22 s 22 p 63s1 при обычных условиях легко отдает наружный (3 s 1) электрон (окисляется). Натрий бурно реагирует с водой, кислотами, химически активен. 2. Беспорядочное (хаотичное) движение ионов в растворе под действием электрического поля становится направленным: положительно заряженные ионы (катионы) движутся к электроду с отрицательным зарядом (катоду), а анионы – к аноду. Этим объясняется ионная проводимость водных растворов и расплавов электролитов.
3. Процесс диссоциации электролитов в водной среде (расплавах) является обратимым:
3. Составьте уравнения гидролиза Be(NO3)2, Rb2S, BaCl2 в молекулярном и ионном виде. Укажите рН среды.
ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ № 44
|
||||||||
|
Последнее изменение этой страницы: 2016-06-19; просмотров: 2789; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.191.218.187 (0.01 с.) |

 Ni2+ + 2 NO3– + H2O
Ni2+ + 2 NO3– + H2O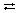 Na+ + OH–.
Na+ + OH–.




