Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Механизмы «ускользания» опухоли от иммунного контроляСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
· интоксикация иммуннокомпетентных органов; · слишком интенсивное размножение; · фибриновая пленка, мешающая распознаванию опухолевых антигенов; · антигенное упрощение ® иммунокомпетентной системе нечего распознавать; · антигенный туман - синтез нефиксированных антигенов вокруг опухоли, на которые и «бросаются» специфические иммунокомпетентные клетки и антитела; · синтез собственных экранирующих антител-колпачков на чуждые антигены; · активация Т-супрессоров; · увеличение продукции глюкокортикоидов, угнетающих иммунитет, в ответ на гипогликемию.
Рис. 13.9. схема противоопухолевого иммунитета.
Принципы фармакологического торможения опухолевого роста.
Главное направление этой области фармакотерапии - препятствовать повышенной митотической активности опухолевой клетки. С этой целью применяются цитостатики, или цитотоксичные препараты (допан, циклофосфан, тиотэф, миелосан). Поскольку данная группа препаратов не может действовать избирательно только на опухолевые клетки, в значительной степени страдают и те органы и ткани, в которых изначально велика интенсивность клеточного деления: эпителиальная (что может проявиться в виде плохого заживления ран после операций) и, особенно, кроветворная система (что может проявиться анемией и лейкопенией). Тем более, что данные симптомы возникают и вследствие интоксикации красного костного мозга продуктами жизнедеятельности опухолевых клеток, а также феноменом "ловушек" аминокислот и глюкозы, каковыми являются опухолевые клетки с их неестественно повышенным метаболизмом. Последнее требует коррекции прежде всего в виде стимуляторов эритро- и лейкопоэза. Поскольку среди условий возникновения опухолей, а также неизбежных звеньев патогенеза присутствует ослабление иммунной системы, лечение опухолей включает назначение иммуностимуляторов в качестве этиотропной и патогенетической терапии. В последние годы предпринимаются успешные попытки лечения лейкокинами - интерлейкинами (ИЛ2, α-интерферон). БЦЖ (ослабленные туберкулёзные бациллы) применяется для лечения больных с меланомой, саркомой и другими опухолями. Главное воздействие направлено на активацию макрофагов и NK-клеток. Большое количество бактериальных и других иммуностимулирующих агентов используется в активации противоопухолевой защиты. Пассивная иммунизация моноклональными антителами к опухолеассоциированным антигенам, конъюгированными с токсическими препаратами и др., могут усилить разрушение опухоли. Из соображений возможности ятрогенного канцерогена, надо также с осторожностью (особенно при предопухолевых состояниях) применять лекарственные препараты, содержащие в составе тяжелые металлы и их аналоги, полициклические ароматические углеводороды (например, стероидные структуры), ароматические амины (например, производные анилина), нитриты и нитраты (возможность образования нитрозаминных групп). Вместе с тем, учитывая высокую интенсивность метаболизма в опухолевых клетках, делаются попытки заблокировать его путем назначения именно тяжелых металлов как блокаторов многих ферментов. Еще издавна делались попытки лечить опухоли препаратами ртути, в частности, сулемой - HgCl2, но из-за высокой токсичности последней метод не получил распространения. Теперь этот подход переживает второе рождение. Менее токсичные органические препараты ртути более избирательно поражают опухолевые клетки благодаря идее "кондуктора" - проводника, который интенсивно поглощается именно опухолевой клеткой и проводит за собой нужную часть молекулы противоопухолевого препарата. Несмотря на то, что, как говорилось выше, многие стероиды могут служить по крайней мере коканцерогенами и синканцерогенами (особенно половые гормоны при предраковых состояниях в своих органах - мишенях), при гормон-зависимых опухолях половой сферы применяют блокаторы секреции половых гормонов за счет торможения секреции гонадотропных гормонов (леупролид, гозерелин) и блокаторы рецепторов к половым гормонам – антигормоны (антагонист эстрогенов тамоксифен или антагонист андрогенов флутамид). Оригинален метод лечения таких гормон-зависимых опухолей половыми гормонами противоположного пола, что основано на выключении секреции собственных половых гормонов по механизму обратной связи. Некоторые опухолевые клетки (лимфобласты при остром лимфолейкозе) не могут синтезировать необходимый им метаболит (аспарагинат), поэтому для большего уменьшения поступления этой аминокислоты в опухолевые клетки применяют введения в организм фермента (L-аспарагиназа). Среди других групп лекарственных препаратов, применяющихся при опухолях, следует отметить еще ряд адаптогенов растительного и животного происхождения, повышающих неспецифическую резистентность организма (апилак, чага, жень-шень), а также другие средства симптоматической терапии - препараты для нормализации белкового и углеводного состава плазмы крови, при необходимости - обезболивающие.
38. – Патология углеводного обмена. Гипогликемические состояния. Нарушения всасывания, синтеза, депонирования и расщепления углеводов.
Углеводы – это альдегидоспирты (кетоспирты) с одной карбонильной и несколькими гидроксильными группами, а также их производные. В организме углеводы выполняют следующие функции : 1. Источник энергии (обеспечивают около 67% суточного потребления энергии). 2. Резерв энергии (в виде гликогена). 3. Пластическая функция (продукты обмена участвуют в синтезе липидов, аминокислот, мукополисахаридов тканей). 4. Защитная функция (углеводные компоненты иммуноглобулинов участвуют в иммунитете).
Источник углеводов в питании человека - преимущественно пища растительного происхождения. Суточная потребность в углеводах составляет 400-500 г. Пищевые углеводы в основном представлены крахмалом, сахарозой (преобладают в пище взрослых людей) и лактозой (является основным углеводом в питании детей грудного возраста). Переваривание углеводов начинается в тонком кишечнике. Кратковременное воздействие амилазы слюны на крахмал пищи существенной роли не играет, так как в просвете желудка кислая среда инактивирует этот фермент. В тонком кишечнике крахмал под действием амилазы поджелудочной железы, выделяющейся в двенадцатиперстную кишку с панкреатическим соком, расщепляется до мальтозы и изомальтозы. Эти дисахариды, а также лактоза и сахароза, расщепляются специфическими ферментами (гликозидазами), продуцируемыми слюнными железами, поджелудочной железой и щеткообразным эпителием кишечника. Ферменты работают не в просвете кишечника, а на поверхности клеток (это т.н. пристеночное пищеварение). В результате образуются моносахариды (глюкоза, фруктоза, галактоза), которые затем транспортируются через плоский кишечный эпителий в воротную систему крови. Всасывание моносахаридов из кишечника происходит с помощью специальных белков-переносчиков (транспортеров). Кроме того, глюкоза и галактоза транспортируются в энтероцит путем активного транспорта, зависимого от градиента концентрации ионов Na+. Он обеспечивает перенос глюкозы в энтероцит против ее градиента концентрации. Энергия, необходимая для этого активного транспорта, обеспечивается Nа+/К+-АТФазой. Это обеспечивает всасывание глюкозы и галактозы даже при низкой концентрации в кишечнике. В отличие от глюкозы и галактозы фруктоза транспортируется системой, не зависящей от ионов Na+. На этом основана возможность лечения синдрома нарушенного всасывания глюкозы и галактозы.
Рис. 14.1. Схема переваривания углеводов [по Е.С. Северину, 2000]. Крахмал частично переваривается в полости рта под действием амилазы слюны, расщепляющей a1-4-гликозидные связи. Амилаза слюны инактивируется в желудке, так как оптимальное значение рН для ее активности составляет 6,7. Панкреатическая амилаза, расщепляющая a1-4-гликозидные связи, продолжает гидролиз крахмала в тонкой кишке, способствуя образованию дисахаридов мальтозы и изомальтозы. Далее мальтоза и изомальтоза вместе с другими пищевыми дисахаридами гидролизуются специфическими глюкозидазами на поверхности клеток кишечника (возможно, и внутри клеток) до соответствующих мономеров.
Рис. 14.2. Схема всасывания углеводов в кишечнике [по Dawn В., Marks, 1996], объяснение в тексте.
Из этих простых сахаров глюкоза по своей распространенности в качестве углеводного компонента пищи намного превосходит все остальные. Поскольку внутри клеток свободная глюкоза как таковая практически отсутствует, вся поглощаемая тканями глюкоза подвергается следующим основным метаболическим превращениям:
§ превращение в жирные кислоты и накопление в виде триглицеридов;
Нарушения всасывания углеводов могут возникать при врожденной недостаточности специфического фермента или транспортной системы, необходимой для обмена определенного сахара. В том и другом случаях сахар накапливается в просвете кишечника, повышая осмолярность кишечного сока и тем дополнительно увеличивая всасываемость воды в просвет кишечника. Общие признаки синдромов нарушения всасывания углеводов:
§ вздутие живота после приема в пищу определенного сахара, § кислая реакция кала (pH<6,0) - поскольку отдельные углеводы метаболизируются бактериями толстого кишечника до органических кислот,
Наследственная недостаточность сахаразы и изомальтазы проявляется, если в рацион ребенка добавляют сахарозу и крахмал, больные дети обычно неохотно едят сладкое. Первичное нарушение всасывания глюкозы и галактозы встречается редко, проявляется вскоре после первого кормления профузной диареей, дегидратацией, ацидозом и гипогликемией. Врожденная недостаточность лактазы. Гидролиз лактозы до глюкозы и галактозы опосредован лактазой кишечного эпителия. У детей с дефицитом этого фермента появляются стойкая диарея и гипотрофия. Нагрузка лактозой усиливает симптоматику. Безлактозная диета устраняет ее.
В эту же группу входят:
§ непереносимость лактозы без недостаточности лактазы (биохимия синдрома неизвестна),
В некоторых случаях встречается низкая активность лактазы вторичного характера, особенно при нарушении нейро-гуморальной регуляции, воспалении слизистой оболочки желудочно-кишечного тракта, отравлениях ядами типа монойодацетата и флоридзина, как следствие операций на ЖКТ.
Наследственные нарушения метаболизма фруктозы обусловлены дефектами ферментов: фруктокиназы, фруктозо-1-фосфатальдолазы и фруктозо-1,6-дифосфотазы.
Галактоземия - это результат нарушения обмена галактозы, обусловленное наследственным дефектом любого из трех ферментов, включающих галактозу в метаболизм (алактокиназа, галактозо-1-фосфатуридилтрансфераза (ГАЛТ), уридилфосфат-4-эпимераза). Галактоземия вследствие недостаточности галактозил-1-фосфатуридилтрансферазы (ГАЛТ) известна наиболее хорошо. Заболевание проявляется очень рано, особенно тяжело протекает у детей, так как основным источником углеводов служит грудное молоко, содержащее лактозу. Ранними симптомами являются рвота, диарея, дегидратация, снижение массы тела, желтуха. Они появляются вскоре после рождения, как только ребенок начинает получать молоко.
В крови, моче и тканях повышается концентрация галактозы и галактозо-1-фосфата. В тканях глаза (в хрусталике) галактоза восстанавливается алдольредуктазой с образованием галактитола (дульцит). Восстановление галактозы характерно и для нормального метаболизма, но протекает с небольшой скоростью. При галактоземии галактитол накапливается в стекловидном теле и связывает большое количество воды. Нарушается баланс электролитов, а чрезмерная гидратация хрусталика приводит к развитию катаракты, которая наблюдается уже через несколько дней после рождения. Катаракта может быть обнаружена только с помощью специальных методов и не определяется при помощи простого офтальмоскопа. Серьезные изменения наблюдаются в печени в связи с накоплением галактозо-1-фосфата. Нарушаются функции печени и почек. Выявляются нарушения в клетках полушарий большого мозга и мозжечка, в тяжелых случаях - отек мозга, задержка умственного развития; возможен летальный исход.
Первой внутриклеточной реакцией, в которой участвует глюкоза, является ее фосфорилирование в глюкозо-6-фосфат гексокиназой и глюкокиназой. Нарушение этого процесса также неблагоприятно сказывается на всасывании углеводов.
Дальнейший метаболизм глюкозо-6-фосфата идет по одному из 4-х возможных путей: 1. Аэробный гликолиз (основной). 2. Анаэробный гликолиз. 3. Пентозофосфатный цикл. 4. Синтез гликогена. Аэробный гликолиз проходит 3 этапа: 1) Образование пирувата. 2) Окислительное декарбоксилирование пирувата (включает образование АцКоА). 3) Цикл трикарбоновых кислот (цикл Кребса), в который включается АцКоА и щавелево-уксусной кислоты (ЩУК), образуя лимонную кислоту. В конце из каждой молекулы глюкозы образуется 6 молекул СО2.
На этапах метаболизма глюкозы запускается цепь ферментов тканевого дыхания, первым из которых является НАД-зависимая дегидрогеназа. Дыхательная цепь срабатывает 10 раз за цикл, перенося 2Н+ на внешнюю сторону митохондриальной мембраны, а 2 электрона - на внутреннюю, что сопровождается выделением энергии, достаточной для синтеза 3-х молекул АТФ, т.е. всего 30 молекул АТФ за цикл. Переход ФАД в ФАД Н2 дает укороченную цепь тканевого дыхания с 4-мя молекулами АТФ. Этот процесс, окислительное фосфорилирование сопряженное с дыханием, дает всего 34-е молекулы АТФ. Субстратное фосфорилирование еще 6 молекул АТФ. Итого 40 молекул АТФ минус 2 молекулы (затраченные на фосфорилирование глюкозы) = 38 молекул АТФ и 6 молекул СО2 на 1-ую молекулу глюкозы. КПД около 44%.
Рис. 14.3. Цикл трикарбоновых кислот (цикл Кребса) [по Т.Т. Березову, Б.Ф. Коровкину, 1998].
Рис. 14.4. Образование 38 молекул АТФ в результате окисления 1 молекулы глюкозы [по Б. Гринстейн, А. Гринстейн, 2000].
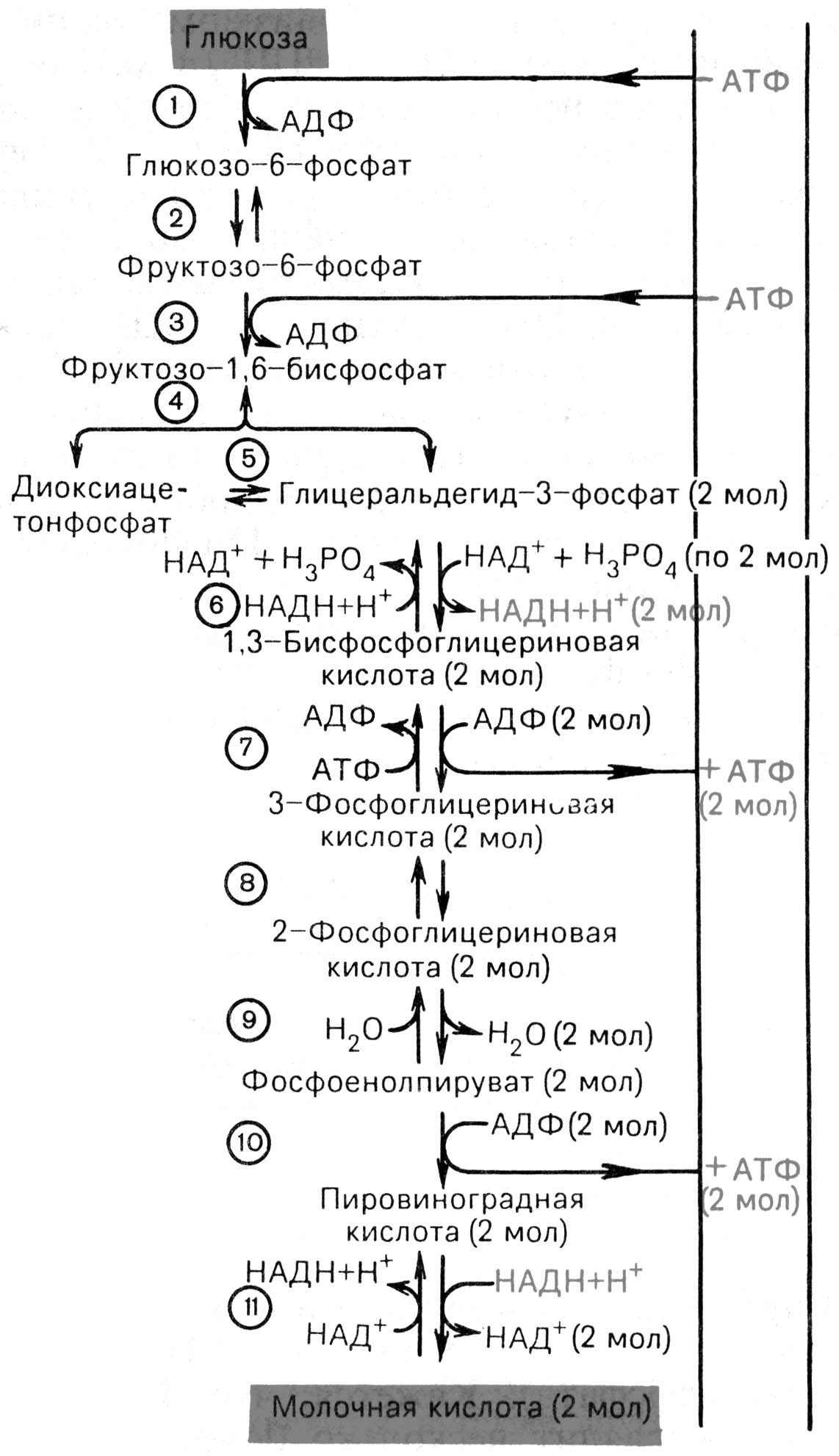
Анаэробный гликолиз совпадает до стадии пирувата. Далее вместо окислительного декарбоксилирования пируват подвергается восстановлению, приняв на себя 2Н+ от дегидрогенозы НАД Н2 с образованием лактата (молочной кислоты). Катализирует лактатдегидрогеназа. В эритроцитах только анаэробный гликолиз и большое значение в работающих мышцах. Эффективность - 2-е молекулы АТФ на 1-у молекулу глюкозы.
Рис. 14.5. Последовательность реакций гликолиза [по Т.Т. Березову, Б.Ф. Коровкину, 1998]. 1 - гексокиназа; 2 - фосфоглюкоизомераза; 3 - фосфофруктокиназа; 4 - альдолаза; 5 -триозофосфатизомераза; 6 - глицеральдегидфосфатдегидрогеназа; 7 -фосфоглицераткиназа; 8 - фосфоглицеромутаза; 9 - енолаза; 10 - пируваткиназа; 11 - лактатдегидрогеназа.
Пентозофосфатный путь -окислительная ветвь образует 2 молекулы НАДФ Н2 (необходимый для биосинтеза жирных кислот, холестерина и т.д.). В неокислительной ветви – рибозо-5-фосфат, который используется для синтеза РНК, ДНК, АТФ, КоА, НАД и ФАД.
Рис. 14.6. Схема пентозофосфатного пути метаболизма углеводов [по Т.Т. Березову, Б.Ф. Коровкину, 1998].
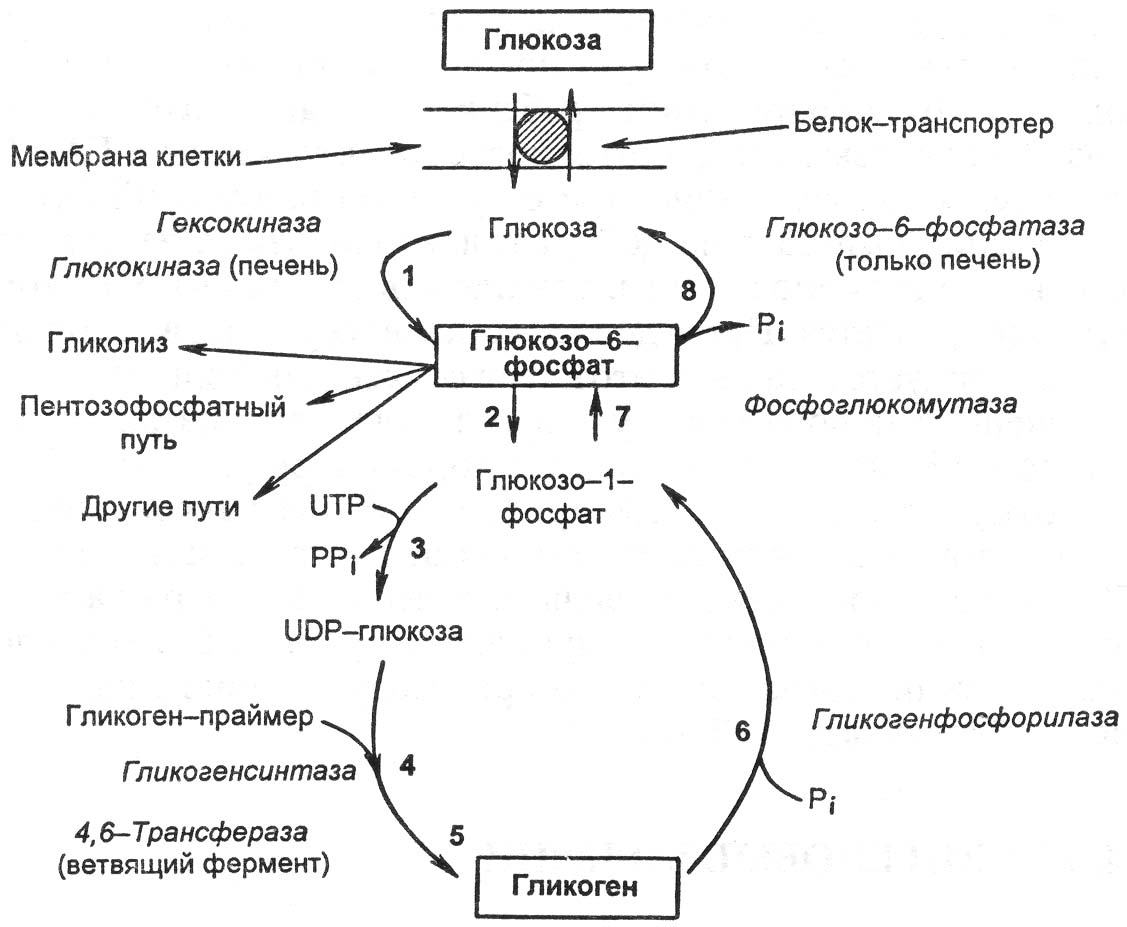
Глюконеогенез. Синтез глюкозы из неуглеводных продуктов; в первую очередь лактат и пируват, гликогенные аминокислоты, глицерол и ряд др. соединений. Т.е. предшественниками глюкозы может быть пируват или любое соединение, превращающееся в процессе катаболизма в пируват или один из промежуточных продуктов цикла Кребса. Нарушения депонирования углеводов. После приема пищи большая часть глюкозы, метаболизирующейся в печени, превращается в гликоген, который при первой необходимости служит готовым источником глюкозы. Однако общее содержание его в печени довольно ограничено (в среднем 70-100 г) и способно обеспечить потребности организма в глюкозе в течение не более 8-12 часов. Реакция образования гликогена зависит от активности гликогенсинтетазы, которая, в свою очередь, находится в обратной в зависимости от внутриклеточного уровня цАМФ.
До сих пор нет ясности в вопросе, опосредована ли активность гликогенсинтетазы главным образом гормонами (например, инсулином, глюкагоном или адреналином - первый ее повышает, два остальных - понижают) или субстратом, т.е. глюкозой.
Рис. 14.7. Синтез и распад гликогена [по Е.С. Северину, 2000]. 1, 2, 3, 4, 5 - реакции синтеза гликогена; 6, 7, 8 - реакции распада гликогена. Снижение синтеза гликогена отмечается при миастении, гипоксии, тогда как повышенный распад наблюдается при охлаждении, перегревании, боли, судорогах, эмоциональном стрессе. Выделяют т.н. агликогеноз - наследственное заболевание, вызванное дефектом гликогенсинтетазы. В печени почти или полностью отсутствует гликоген, выражена гипогликемия. Следует сказать, что гликогенолиз контролируется ферментом фосфорилазой, которая, подобно гликогенсинтетазе, существует в неактивной форме и должна активироваться. Гликогенолиз в печени и мышечной ткани приводит к образованию различных продуктов: в печени - к образованию свободной глюкозы, в мышцах - к высвобождению лактата и пирувата, поскольку глюкозо-6-фосфат не может превращаться в глюкозу, а вступает на гликолитический путь. Гликогенолиз может рассматриваться как средство адаптации только к острым потребностям организма в глюкозе. В условиях длительного дефицита глюкозы (голодание, нарушение реабсорбции глюкозы в почках, диабет) в ход идет другой, более продолжительный механизм – глюконеогенез. Единственной другой тканью (помимо печени), в которой возможен глюконеогенез и превращение глюкозо-6-фосфата в глюкозу, является корковый слой почек. Особую группу представляют болезни накопления гликогена, или гликогенозы. В основе этой патологии лежит энзиматический дефект, который проявляется необычной структурой гликогена или его избыточным накоплением в печени, почках, нервной системе. Характерны гепатоспленомегалия, задержка роста. Наиболее часто встречаются 6 типов гликогенозов.
I тип (гликогеноз Гирке) - следствие дефицита глюкозо-6-фосфатазы. Встречается наиболее часто, проявляется гипогликемией, накоплением гликогена в печени и почках, ацидозом (за счет накопления лактата) и гепатоспленомегалией. Больные отличаются малым ростом. II тип (гликогеноз Помпе) - обусловлен дефектом кислой альфа-1,4-глюкозидазы. Отличается от других гликогенозов тем, что дефектным становится лизосомальный фермент. Проявляется генерализованным накоплением гликогена, поражением печени, почек, нервной системы, гипертрофией миокарда. Болезнь быстро прогрессирует и никакое лечение не в состоянии предотвратить смерть больного. III тип (лимитдекстриноз, болезнь Кори, Болезнь Форбса) - вызывается дефицитом амило-1,6-гликозидазы. Больным свойственны гепатомегалия, мышечная, слабость, гипогликемия натощак, "кукольное личико". Течение относительно доброкачественное. IV тип (амилопектиноз, болезнь Андерсена) - редко встречающаяся тяжелая форма гликогенозов. Для нее характерен цирроз печени с желтухой и печеночной недостаточностью, развивающийся в грудном возрасте. Отложение гликогена генерализованное, гликоген структурно изменен с очень длинными наружными ветвями. До сих пор не предложено никакого лечения, кроме симптоматического. V тип (недостаточность миофосфорилазы, болезнь Мак-Ардла) - вызван дефицитом фосфорилазы, активирующей бета-киназу в мышцах и печени. Интересна история этого заболевания. Первый случай был расценен как психосоматическое нарушение. У больного в покое отсутствовали какие бы то ни было симптомы, но даже после умеренной нагрузки возникали боли в мышцах. Первые проявления болезни возникают обычно в 25-30 лет. Печень не поражается, структура гликогена нормальна, нет смертельных исходов, т.к. гамма-амилаза совместно с амило-1,6-гликозидазой расщепляют гликоген до глюкозы. Единственный признак - миастения, особенно после физической активности. VI тип (недостаточность печеночного фосфорилазного комплекса, болезнь Херса) - дефект печеночной фосфорилазы, ведущий и избыточному накоплению нормального гликогена в печени. Отмечают гепатомегалию, легкое замедление темпов роста. Прогноз для жизни хороший, умственное развитие нормальное. Достаточно редко встречается гликогеноз VII типа (дефект мышечной фосфофруктокиназы, болезнь Терье), схожий с болезнью Мак-Ардла и проявляющийся нарастанием уровня лактата и пирувата в крови после мышечной работы. Этиология и патогенез гипогликемических состояний.
|
||||
|
Последнее изменение этой страницы: 2016-06-19; просмотров: 1139; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.15.142.42 (0.016 с.) |