
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Сокращенное ионное уравнениеСодержание книги Похожие статьи вашей тематики
Поиск на нашем сайте
А) S2- + 2H+ = H2S Б) H+ + OH- = H2O В) Ag+ + Cl- = AgCl↓ Г) Fe3+ + 3OH- = Fe(OH)3↓ Д) 2H+ + Cu(OH)2 = Cu2+ + 2H2O Е) Ba2+ + SO42- = BaSO4↓
Часть 3 С1. В пробирку налили концентрированный раствор хлорида алюминия и добавили порошок магния, при этом происходит выделение газа. Объясните наблюдаемое явление. Ответы по теме «Электролитическая диссоциация Солей, кислот, щелочей. Реакции ионного обмена. Гидролиз солей»
Часть 3 Вариант 1 Первая ступень: 1)CO32- + H2O ↔ HCO3- + OH- или 2)Na2CO3 + H2O ↔ NaНCO3 + NaOH Вторая ступень: 3)HCO3- + H2O ↔ Н2CO3 + OH- или 4)NaНCO3 + H2O ↔ Н2CO3 + NaOН
Вариант 2 1. Na 2CO3 + 2HNO3 = 2 NaNO3 + CO2↑ + H2O 2. 2FeCl3 + 3Na 2CO3 + 3H2O = 2Fe(OH)3↓ + 3CO2↑ + 6NaCl 3. NaOH + HNO3 = NaNO3 + H2O 4. FeCl3 + 3NaOH = Fe(OH)3↓+ 3NaCl Вариант 3 И FeCl3 , и Na2CO3 подвергаются гидролизу, но FeCl3 гидролизуется по катиону, а Na2CO3 – по аниону. Поэтому гидролиз одной соли усиливает гидролиз другой. Следовательно, процесс гидролиза каждой из них доходит до конца. 2FeCl3 + 3Na2CO3 + 3H2O → = 2Fe(OH)3↓ + 3CO2↑ + 6NaCl Вариант 4 AlCl3 подвергается гидролизу по катиону: Al3+ + HOH = AlOH2+ + H+;
AlCl3 + HOH = AlOHCl2 + HCl.
В результате образуется кислота, она реагирует с магнием, и наблюдается выделение водорода.
Mg + 2HCL = MgCl2 + H2↑
Тема «Термохимия и химическая кинетика» Вариант 1 Часть 1 А1. Верны ли следующие суждения о горении фосфора в атмосфере кислорода: А. Это экзотермическая реакция. Б. Это реакция замещения. 1. Верно только А; 2. Верно только Б; 3. Верны оба утверждения; 4. Оба утверждения неверны.
А2. Быстрее всех при комнатной температуре будет протекать реакция между 10%-ным раствором соляной кислоты и цинком 1. В гранулах; 2. Большим куском; 3. Покрытым медью; 4. В порошке
А3. К эндотермическим реакциям относится: 1. Образование воды из простых веществ; 2. Образование иодоводорода из простых веществ;
3. Образование аммиака из простых веществ; 4. Восстановление оксида железа (III) алюминием
А4. На смещение равновесия 2NH3 = 3H2 + N2 + Q в сторону продуктов реакции влияет одновременное 1. Повышение температуры и повышение давления; 2. Понижение температуры и повышение давления; 3. Повышение температуры и понижение давления; 4. Понижение температуры и понижение давления
А5. Увеличить скорость реакции 4FеS2 + 11О2 = 2Fе2О3 + 8SO2 + Q можно 1. Измельчив пирит; 2. Используя воздух, обогащённый азотом; 3. Поглощая сернистый газ водой; 4. Снижая температуру
А6. При понижении температуры на каждые 100С скорость реакции 1. Увеличивается в 2-4 раза; 2. Увеличивается в 3-6 раз; 3. Уменьшается в 2-4 раза; 4. Не изменяется
А7. Вещества, которые повышают скорость химической реакции, оставаясь к концу её неизменными, называются: 1. Активаторами; 2. Катализаторами; 3. Ингибиторами; 4. Ферментами
А8. Французский химик А. Ле Шателье сформулировал 1. Условие необратимости химической реакции; 2. Общий закон смещения химического равновесия; 3. Закон действующих масс; 4. Определение ферментов
А9. При увеличении температуры на 300С скорость реакции возрастает в 8 раз. Температурный коэффициент реакции равен 1. 8; 2. 2; 3. 3; 4. 4
А10. Как называют уравнение, в котором указано количество теплоты: 1. Термодинамическим; 2. Термическим; 3. Химотермическим; 4. Термохимическим
Часть 2
В1. При полном сгорании 0,1 моль кокса в кислороде выделилось 40,2 кДж теплоты. Теплота образования углекислого газа из простых веществ ______________кДж/моль. В банк ответов запишите целое число без единиц измерения.
В2. Назовите пять факторов смещения химического равновесия вправо для реакции синтеза аммиака в промышленности.
Часть 3
С1. При горении магния в углекислом газе на каждый моль образовавшейся сажи (С) выделяется 810 кДж энергии. Сколько граммов магния требуется для того, чтобы выделилось 101 кДж теплоты?
Вариант 2 Часть 1 А1. При комнатной температуре с наименьшей скоростью протекает реакция: 1. Zn c 10%- ным раствором HCl; 2. Zn c 5%- ным раствором HCl; 3. Zn c 2%- ным раствором HCl; 4. Zn c 0,1%- ным раствором HCl; А2. Химической реакции в растворе отвечает уравнение А + В = АВ. Как изменится скорость этой реакции, если концентрацию вещества А увеличить в 3 раза, оставив концентрацию В прежней?
1. увеличится в 3 раза; 2. увеличится на 1/3; 3. не изменится; 4. уменьшится в 3 раза. А3.Каким образом можно сместить равновесие реакции 2SO2 + O2 ↔ 2SO3 + Q в сторону исходных веществ? 1. понизить давление; 2. повысить давление; 3. понизить температуру; 4. использовать катализатор. А4. Какой из факторов не оказывает влияния на скорость химической реакции в растворах: 1. концентрация вещества; 2. использование катализатора; 3. использование ингибитора; 4. объем реакционного сосуда; А5.Скорость химической реакции между металлом и серой не зависит: 1. от температуры; 2. от площади поверхности соприкосновения веществ; 3. от давления; 4. от природы металла. А6. Взаимодействие какой пары веществ будет протекать с большей скоростью, если известно, что концентрация растворов кислот во всех случаях одинакова: 1. Pb и HCl; 2. Fe и HCl; 3. Zn и HCl; 4. Mg и HCl. А7. Увеличение давления сместит равновесие в сторону исходных веществ в реакции: 1. 2NO↔ N2O4; 2. CH4 + H2O ↔ 3H2 + CO; 3. C + 2H2 ↔ CH4; 4. N2 + O2 ↔2NO. А8. К эндотермическим реакциям относится: 1. разложение известняка; 2. разложение гидрида титана; 3. окисление глюкозы; 4. нейтрализация кислоты щелочью; А9. Во сколько раз увеличивается скорость химической реакции при повышении температуры на 200С, если температурный коэффициент равен 3? 1. в 3 раза; 2. в 6 раз; 3. в 9 раз; 4. в 90 раз. А10. Скорость гетерогенной реакции, в отличие от скорости гомогенной реакции, зависит от: 1. молярных концентраций исходных и образовавшихся веществ; 2. молярных концентраций исходных и образовавшихся веществ и времени протекания реакции; 3. площади поверхности соприкосновения реагирующих веществ; 4. степени перемешивания. Часть 2 В1. В равновесной системе 3А + В ↔ 2С + Д концентрация вещества С = 1 моль/л, концентрация вещества А = 1,5 моль/л. Укажите исходную концентрацию вещества А.
В2. При 200С реакция протекает за 2 минуты. Сколько времени будет протекать эта же реакция при 00С, если температурный коэффициент равен 2? Часть 3 С1. Реакция синтеза иодоводорода обратима. Какие условия влияют на положение химического равновесия в этой системе? Какие условия не оказывают влияния? Дайте обоснованный ответ.
Вариант3 Часть 1 А1. Экзотермическая реакция обмена протекает, если взаимодействуют: 1. KOH и H2SO4; 2. CH4 и Cl2; 3. Mg и HCl; 4. CaO и CO2. А2. Максимальная скорость горения сероводорода в кислороде будет при: 1. уменьшении температуры и увеличении давления; 2. одновременном увеличении температуры и давления; 3. увеличении температуры и уменьшении давления; 4. одновременном уменьшении температуры и давления. А3. При комнатной температуре медленнее всего протекает реакция между: 1. Cu и O2; 2. Na2CO3 (твердый) и HCl (раствор); 3. NaOH (раствор) и HCl (раствор); 4. Na и O2. А4. Скорость горения водорода в кислороде можно уменьшить, если одновременно: 1. внести катализатор и повысить давление; 2. повысить температуру и понизить давление; 3. увеличить давление и температуру; 4. разбавить кислород азотом и понизить давление А5. Увеличение давления не повлияет на смещение равновесия в реакции: 1. 2NO↔ N2O4; 2. CH4 + H2O ↔ 3H2 + CO; 3. C + 2H2 ↔ CH4; 4. N2 + O2 ↔2NO. А6. На смещение равновесия CO2 + C ↔ 2CO + Q в сторону продуктов реакции влияет одновременное:
1. повышение температуры и повышение давления; 2. понижение температуры и повышение давления; 3. повышение температуры и понижение давления; 4. понижение температуры и понижение давления. А7. Как изменится молярный объем газов при увеличении температуры от 00С до 200С при постоянном давлении: 1. увеличится в 2 раза; 2. увеличится в 1,07 раз; 3. увеличится в 3 раза. 4. останется равным 22,4 л/моль. А8. В результате реакции, которая описывается уравнением MgCO3(ТВ) = MgO(ТВ) + CO2(г) – 102кДж, поглотилось 5,1 кДж теплоты. Объем выделившегося CO2(н.у.) равен: 1. 0,112л; 2. 1,12л; 3. 2,24л; 4. 22,4л. А9. Для увеличения скорости реакции в 81 раз (температурный коэффициент реакции равен 3) температуру газообразной смеси следует повысить на: 1. 200С; 2. 300С; 3. 400С; 4. 500С. А10. Скорость простой реакции вида mA + nB = pC + qD определяют по формуле: V = k* cAm * cBn, где k – это: 1. коэффициент, равный сумме молей реагирующих веществ; 2. константа для данного типа химических реакций; 3. константа, равная скорости реакции при концентрации реагирующих веществ 1 моль/л; 4. константа, равная концентрации лимитирующего вещества. Часть 2 В1. Теплота сгорания этана 1600 кДж/моль. Объем метана (н.у.), необходимый для получения 320 кДж теплоты ________ л. В бланк ответов перепишите ответ под номером соответствующего задания.
В2. Скорость некоторой реакции при 100С составляет 2 моль/лс. Рассчитайте скорость этой реакции (моль/лс) при 500С, если температурный коэффициент равен 3. Часть 3 С1. При горении магния в углекислом газе на каждый моль образовавшейся сажи (С) выделяется 810 кДж энергии. Сколько граммов магния требуется для того, чтобы выделилось 101 кДж теплоты? Ответ запишите на отдельном листе или на обратной стороне бланка. Вариант 4 Часть 1
А1. Реакции, которые протекают в однородной среде без образования поверхности раздела реагирующих веществ, называют 1. Гетерогенными 2. Гомогенными 3. Каталитическими 4. Обратимыми
А2. Как можно эффективно увеличить скорость образования водорода при реакции металлического цинка с соляной кислотой: 1. Увеличив молярные концентрации цинка и кислоты 2. Увеличив объём цинка 3. Измельчив цинк 4. Изменить скорость реакции нельзя
А3. Укажите реакцию, которая является необратимой 1. N2 +О2 = 2NО + Q 2. 2SO2 + О2 = 2SO3 + Q 3. СО2 + Н2О = Н2СО3 4. НСl +AgNO3=AgCl↓ + НNO3
А4. Скорость реакции измеряется в: 1. моль 2. моль/л 3. г/л 4. моль/лс
А5. Что произойдёт, если убрать часть иода из реакционной смеси
Н2 +I2 = 2НI + Q 1. Понизится температура 2. Равновесие сместится вправо 3. Равновесие сместится влево 4. Повысится температура
А6. Какое значение имеет изменение энтальпии для экзотермической реакции: 1. Положительное 2. Отрицательное 3. Не имеет знака 4. Правильного ответа нет
А7. «При повышении температуры на каждые 100С скорость реакции увеличивается в 2-4 раза». Это формулировка называется: 1. Правило Гульдберга и Вааге 2. Правило Вант-Гоффа 3. Правило Ле Шателье 4. Правило Клайперона
А8. Что нужно изменить, чтобы сместить равновесие реакции вправо: N2 +3H2 = 2NH3 +Q 1. Понизить температуру 2. Повысить температуру и давление 3. Повысить температуру и давление 4. Понизить температуру и повысить давление
А9. Химическое равновесие наступит быстрее, если: 1. Изменить температуру 2. Ввести катализатор 3. Изменить давление 4. Изменить концентрации конечных продуктов прямой реакции
А10. Смесь веществ, реагирующих при температуре 00С, нагрели до 200С. Как изменилась скорость данной реакции, если температурный коэффициент её равен 2? 1. Увеличилась в 4 раза 2. Увеличилась в 8 раз 3. Не изменилась 4. Увеличилась в 2 раза
Часть 2
В1. Исходные концентрации веществ, взаимодействие которых соответствует реакции 2А + В = А2В, равны по 4моль/л. Равновесная концентрация вещества А2В равна 0,5 моль/л. Укажите равновесную концентрацию вещества А.
В2. В результате реакции, термохимическое уравнение которой 2Аl + Fe2О3 = Аl2О3 + 2Fe +848 кДж, выделилось 169,6кДж теплоты. Масса образовавшегося железа равна _________ грамм. Укажите ответ с точностью до десятых. Часть 3
С1.В системе А + В = С, где А, В и С - газы, установилось равновесие. Какое влияние на равновесное количество вещества С в единице объёма системы окажут: 1. Увеличение давления 2. Увеличение количества вещества А в системе 3. Повышение температуры Ответы и решения по теме «Термохимия и химическая кинетика»
Часть 3 Вариант 1 2Мg + СО2 = С + 2МgО + 810 кДж n (С): n (Мg) = 1:2 m (Мg) = 101*2*24:810 = 6г Вариант 2 H2 + I2 ↔2HI + Q На положение химического равновесия в этой системе повлияют следующие условия: изменение температуры, изменение концентрации H2, I2, HI. На положение химического равновесия в этой системе не повлияет изменение давления. Вариант 3 1) Составлено термохимическое уравнение реакции горения угля в оксиде азота (I): C + 2N2O = CO2 + 2N2 + 558 кДж 2) Определено молярное соотношение оксидов по уравнению реакции: n (CO2): n (N2O) = 1: 2 3) Рассчитано количество вещества оксида азота (I), требующегося для образования 16,7 кДж теплоты:
N (N2O) = (16,7* 2): 558 = 0,06 (моль). Вариант 4 1. При протекании реакции общее количество газообразных веществ уменьшается (с 2 моль до 1 моль). В соответствии с правилом Ле Шателье повышение давления приведёт к смещению равновесия в сторону реакции, приводящей к уменьшению количества газов, то есть в сторону вещества С. Количество С увеличится. 2. При увеличении количества вещества А равновесие будет смещаться в сторону реакции, которая уменьшает количество А, то есть в сторону образования продукта С. Количество С увеличится. 3. Так как
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-04-23; просмотров: 733; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.118.55.201 (0.013 с.) |

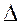 Н0 < 0,
Н0 < 0,


