Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Оптимальные условия осаждения катионов II группыСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Осаждение катионов II группы групповым реагентом (NH4)2CO3 надо проводить: 1) в присутствии NH4OН и NH4Cl (аммиачного буфера); 2) при значении рН = 9,0–9,2; 3) из горячего раствора (t0 = 50–700С). Эти условия осаждения являются оптимальными и создаются с целью полного отделения катионов II группы от катионов I группы. Присутствие NH4OН необходимо для: а) нейтрализации кислоты, которая может находиться в пробе; б) подавления гидролиза группового реагента (NH4)2CO3; в) создания буферного раствора с рН = 9,0–9,2; г) перевода NH4НCO3 в (NH4)2CO3 (гидрокарбонат аммония содержится в карбонате аммония как примесь), иначе образуются растворимые соли Ме(НCO3)2. Присутствие NH4Cl необходимо для: а) создания буферного раствора с рН = 9,0–9,2; б) удержания ионов Mg2+ в растворе. Когда к анализируемому раствору добавляют NH4OН, то создается такое значение рН, при котором ионы Mg2+ осаждаются. После введения NH4Cl образуется аммиачный буфер с меньшим, чем у слабого основания, значением рН. В результате полученный осадок Mg(OH)2 растворяется и ионы Mg2+ остаются в растворе вместе с другими катионами I группы. Роль значения рН: а) при рН < 9,0 катионы II группы осаждаются неполно, поскольку растворимость солей слабых кислот увеличивается при понижении рН раствора; б) при рН > 9,2 ионы Mg2+ осаждаются в виде основной соли (MgOH)2CO3 или гидроксида Mg(OH)2 и остаются в осадке вместе с катионами II группы. Таким образом, необходимо проводить осаждение в узком интервале значений рН, поддерживая кислотность среды с помощью аммиачного буферного раствора. Нагревание необходимо для: ─ перевода аморфного осадка в кристаллический; ─ смещения влево равновесия побочной реакции с участием группового реагента, в результате которой образуется карбаминат аммония: (NH4)2CO3 «NH2COONH4 + H2O. Систематический ход анализа катионов I–II групп При изучении реакций катионов II аналитической группы можно сделать следующие выводы: а) присутствие иона Ва2+ мешает открытию иона Са2+; б) присутствие иона Са2+ не мешает открытию иона Ва2+; в) ионы Ва2+ можно удалить из раствора осаждением в виде BaCrO4. Исходя из этого, систематический ход анализа катионов II группы должен включать следующие операции, которые выполняются в строго определенной последовательности: 1) обнаружение иона Ва2+; 2) осаждение иона Ва2+ (если обнаружен); 3) обнаружение иона Са2+. Катионы II группы мешают обнаружению катионов I группы, поскольку ионы Са2+ и Ва2+ образуют осадки с некоторыми реагентами, применяемыми при анализе катионов I группы. Следовательно, при проведении систематического анализа смеси катионов I и II аналитических групп необходимо, в первую очередь, разделить катионы на группы действием группового реагента (NH4)2СО3. Схема разделения ионов I и II аналитических групп и отделения ионов друг от друга внутри II группы при проведении систематического анализа смеси катионов I и II групп представлена на рис. 3.
Рис. 3. Схема разделения катионов I и II групп
«Катионы III аналитической группы» Общая характеристика В III аналитическую группу входит большое количество катионов, образованных различными элементами: а) s2- (Ве2+) и p1-элементами; б) 3d-, 4d- и 5d-элементами; в) f-элементами. Однако все они имеют общее свойство, отличающее их от катионов I и II групп. Это способность осаждаться в виде сульфидов или гидроксидов при действии группового реагента – (NH4)2S в присутствииаммиачного буфера. Сульфиды катионов III группы, не растворимые в воде, растворяются в разбавленных минеральных кислотах, поэтому они не осаждаются сероводородом из кислых растворов. Катионы III группы, в отличие от катионов II группы, образуют нерастворимые гидроксиды и растворимые в воде сульфаты. Одним из характерных свойств катионов III группы является их способность образовывать комплексные соединения. Многие из них вступают в реакции окисления-восстановления. Большинство соединений катионов III группы окрашено. Так, соли Cr3+ имеют сине-зелёную окраску, соли Fe3+ – жёлтую. Хром и марганец в высших степенях окисления образуют окрашенные анионы: CrO42– – жёлтого цвета, Cr2O72– – оранжевого, MnO4– – малиново-фиолетового. Окрашены также некоторые гидроксиды и все сульфиды, за исключением ZnS. В химической технологии наиболее часто используются следующие катионы III группы: Fe2+, Fe3+, Zn2+, Al3+, Cr3+, Mn2+
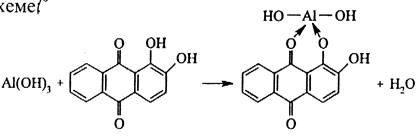
Опыт 7. Характерные реакции на ион Al3+ Описание 1. Реакция с ализарином. В пробирку к 2-3 каплям кислого раствора, содержащего ионы алюминия, добавляют 2-3 капли раствора ализарина (1,2-диоксиантрахинон), твердый ацетат натрия до слабокислой среды и нагревают. Образуется малорастворимое комплексное соединение, ярко-красный хлопьевидный осадок, называемое «алюминиевыми лаками». Реакция протекает по схеме
Комплексы устойчивы в уксуснокислой среде. Ализарин – специфический реактив, позволяющий определять Al3+ в присутствии других катионов. Реакция высокочувствительна – предел обнаружения 0,5 мкг. Мешают катионы Zn2+, Mn2+, Cr3+, Fe3+. Для их маскировки используют K4[Fe(CN)6], с которым мешающие ионы образуют нерастворимые в воде гексацианоферраты (II). Реакция выполняется в двух вариантах – как пробирочная и как капельная. Описание 2. Реакция с аммиаком. К 3-4 каплям раствора, содержащего ионы алюминия, осторожно по каплям добавляют гидроксида аммония до образования белого студенистого осадка гидроксида алюминия. Al3+ + 3OH– → Al(OH)3↓. Наиболее полное осаждение гидроксида происходит при рН≈5–6. Описание 3. Реакция со щелочами. Гидроксид натрия (калия) образуют с ионами Al3+ белый осадок гидроксида алюминия Al(OH)3. Наиболее полное осаждение наблюдается в интервале рН 4–7,8. При дальнейшем прибавлении щёлочи амфотерный гидроксид алюминия растворяется с образованием гидроксоалюминатов. Если снова понизить рН среды до значения ≈5, то гидроксоалюминаты разрушаются и снова выпадает осадок Al(OH)3. (Если добавить твердый хлорид аммония и нагреть, вновь образуется осадок гидроксида алюминия). Написать реакции.
Опыт 8. Характерные реакции на ион Cr3+ Описание 1. Реакция с пероксидом водорода. К 2-3 каплям раствора, содержащего ионы хрома (3), добавляют по каплям 2М гидроксида натрия до образования осадка гидроксида хрома и далее до его растворения и образования гидроксокомплексов. Затем добавляют 1 каплю 30%-ного или 6-8 капель 3%-ного раствора пероксид водорода и нагревают. Образуется жёлтый раствор хромата 2Cr(OH)3 + 3H2O2 + 4OH– → 2CrO42– +8H2O. При действии H2O2 на растворы хроматов образуются различные пероксокомплексы хрома, окраска которых зависит от рН среды. В кислой среде – образуются комплексные соединения голубого, а в нейтральной – фиолетового цвета. В водных растворах пероксидные комплексы хрома неустойчивы, но устойчивы в органических растворителях. Описание 2. Реакция с дифенилкарбазидом. Дифенилкарбазид (I) взаимодействует с ионами Cr (VI) в сильнокислой среде, при этом появляется фиолетовое окрашивание. Предполагается следующий механизм реакции. Сначала ионы Cr (VI) окисляют дифенилкарбазид до бесцветного дифенилкарбазона (II), восстанавливаясь при этом до Cr3+:
Ионы Cr3+ образуют с дифенилкарбазоном (II) красно-фиолето-вые внутрикомплексные соединения. Опыт 9. Характерные реакции на ион Fe3+ Описание 1. Реакция с гексацианоферратом (II) калия. Это наиболее характерная и чувствительная реакция на ионы Fe3+. К 1-2 каплям раствора, содержащего ионы железа(3) и имеющего рН 1-3, добавляют 1-2 капли реагента. В результате которой образуется тёмно-синий осадок «берлинской лазури 4Fe3+ + 3[Fe(CN)6]4– → Fe4[Fe(CN)6]3↓. Реакцию обязательно проводят в кислой среде, т. к. образующиеся комплексы легко разрушаются в щелочной среде с выделением гидроксида железа. Последующее подкисление смеси возвращает окраску. Описание 2. Реакция с роданидом аммония (тиоцианатом). К 1-2 каплям раствора, содержащего ионы железа (3), добавляют каплю раствора NH4SCN. Ионы Fe3+ образуют окрашенное в кроваво-красный цвет соединение, состав которого определяется концентрацией роданид-ионов: Fe3+ + nCNS– → Fe(CNS)n. С увеличением концентрации роданид-ионов окраска усиливается, поэтому реакцию необходимо проводить с избытком роданида. Для предотвращения выпадения бурого осадка гидроксида железа следует вести обнаружение в кислой среде. Описание 3 Реакция с гидроксидом натрия. К 1-2 каплям раствора, содержащего ионы железа(3), добавляют 1каплю щелочи. В результате реакции образуется осадок кирпично-красного цвета. В отличие от гидроксида алюминия, гидроксида хрома(3) и гидроксида цинка не растворяется в избытке щелочи. FeCl3 + 3NaOH →
Опыт 10.Характерные реакции на ион Fe2+ Описание 1. Реакция с гексацианоферратом (III) калия. Это наиболее характерная и чувствительная реакция на ионы Fe2+. К 1-2 каплям слабокислого раствора, содержащего ионы железа (2), добавляют 1-2 капли раствора реагента. В результате которой образуется интенсивно-синий осадок «турнбулевой синью»: 3Fe2+ +2[Fe(CN)6]3– → Fe3[Fe(CN)6]2↓. Осадок не растворяется в кислотах, но разлагается в щелочной среде с образованием гидроксидов железа. Реакция очень чувствительна: предел обнаружения составляет 0,05 мкг. Описание 2. Реакция с диметилглиоксимом К 2-3 каплям раствора, содержащего ионы железа (2), добавляют каплю 20%-ного раствора винной кислоты, 1 каплю диметилглиоксима (H2D) и по каплям раствор аммиака до щелочной реакции. Образуется устойчивое комплексное соединение красного цвета: Fe2+ + 2H2D + 3NH3 + H2O → Fe[(HD)2(H2O)(NH3)] + 2NH4+. Комплексные соединения Fe2+ с H2D хорошо растворимы в воде. Мешают катионы Ni2+, образующие нерастворимые в воде диметилглиоксиматы никеля. Мешающее влияние ионов Fe3+, образующих в аммиачной среде окрашенный гидроксид, устраняют добавлением лимонной, щавелевой или винной кислоты.
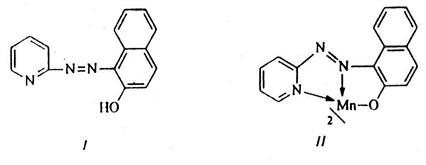
Опыт 11. Характерные реакции на ион Mn2+ Описание 1. Реакция со щавелевой кислотой. Щавелевая кислота образует с MnO(OH)2 комплексное соединение состава H[Mn(C2O4)2], окрашенное в малиново-розовый цвет: 2MnO(OH)2 + 5H2C2O4 → 2H[Mn(C2O4)2] + 2СО2↑ + 6H2O. Мешают катионы Fe2+ и Fe3+. Для их маскировки используют NaF. Описание 2. Реакции окисления катионов Mn2+ до перманганат-ионов. Катионы Mn2+ под действием различных окислителей окисляются до перманганат-ионов, окрашенных в малиново-фиолетовый цвет. В качестве окислителей используют висмутат натрия NaBiO3, диоксид свинца PbO2, персульфат аммония (NH4)2S2O8 и др. Окисление висмутатом натрия протекает по схеме: 2Mn2+ + 5NaBiO3 + 14H+ → 2MnO4– + 5Bi3+ + 5Na+ + 7H2O. К 5-6 каплям раствора персульфата аммония прибавляют каплю 2М серной кислоты, 1-2 капли фосфорной кислоты(кон.), 1-2 капли раствора нитрата серебра и нагревают. В нагретую окислительную смесь вносят при помощи стеклянной палочки минимальное количество раствора, содержащего ионы марганца(2) и не содержащего хлорид-ионов, перемешивают и наблюдают красно-фиолетовую окраску раствора. Описание 3. Реакция с ПАН (1-(2-пиридилазо)-2-нафтол). К 2-3 каплям раствора, содержащего ионы марганца (2). Добавляют 5-7 капель воды, 4-5 капель 0,1%-ного раствора ПАН (структура I), который образует с ионами Mn2+ при рН=7‑10 малорастворимые в воде комплексные соединения красно-фиолетового цвета с предполагаемой структурой II:
Опыт 12. Характерные реакции на ион Zn2+ Описание 1. Реакция с дитизоном. К 1-2 каплям исследуемого раствора прибавляют 1-2 капли 20%-ного раствора Na2S2O3, 1-2 капли 10%-ного раствора KCN и доводят рН раствора до 4-5 20%-ным раствором уксусной кислоты. Экстрагируют 0,02%-ным раствором дитизона (дифенилтиокарбазон) в CCl4. Образует с ионами Zn2+ внутрикомплексные соединения, хорошо растворимые в органических растворителях (CCl4, CHCl3): H2Dz + Zn2+ + → Zn(HDz)2 + 2H+. Эти соединения в щелочной среде окрашены в красный цвет, причём слой органического растворителя имеет более интенсивную окраску, чем водный. Мешающие ионы, способные к образованию дитизонатных комплексов (Cd2+, Pb2+, Cu2+), маскируют тиосульфатом, цианидом или осаждают в виде сульфидов. Описание 2. Реакция с аммиаком. При постепенном добавлении гидроксида аммония к раствору, содержащему ионы Zn2+, выпадает белый осадок гидроксида цинка, который растворяется в избытке аммиака с образованием комплексов: Zn(OH)2 + 6NH3 → [Zn(NH3)6](OH)2.
|
||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-04-23; просмотров: 1824; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.117.71.239 (0.013 с.) |


 +СН3СООН
+СН3СООН
 +K2Cr2O7
+K2Cr2O7