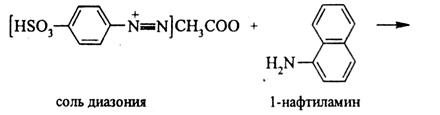Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Общая характеристика анионы II группыСодержание книги
Поиск на нашем сайте
Ко II группе анионов относятся ионы Cl–, Br–, I– и S2–, образующие в разбавленных растворах азотной кислоты малорастворимые соединения с ионами Ag+. Групповой реагент – раствор AgNO3 в присутствии 2 н. HNO3. Большинство хлоридов и бромидов хорошо растворимо в воде. Малорастворимы хлориды и бромиды серебра, ртути, свинца и меди (I). Иодид-ионы обладают восстановительными свойствами. Опыт 4. Характерные реакции на ион Cl – Описание 1. Реакция с нитратом серебра. К 2-3 каплям раствора, содержащего хлорид-иона, добавляют 2-3 капли раствора нитрат серебра. Образуется белый творожистый осадок AgCl: Cl– + Ag+ → AgCl↓. Осадок не растворяется в HNO3, но растворяется в NH3: AgCl + 2NH4OH → [Ag(NH3)2]Cl + 2H2O. Описание 2. Реакция с катионами Pb2+. Растворимые соли Pb2+ реагируют с хлорид-ионами с образованием белого осадка: Pb2+ + 2Cl– → PbCl2↓. В горячем растворе осадок растворяется полностью, а при охлаждении вновь выпадает. Опыт 5. Характерные реакции на ион Br – Описание 1. Реакция с нитратом серебра. К 2-3 каплям раствора, содержащего бромид-ионы, добавляют 2-3 капли раствора нитрата серебра. Образуется бледно-жёлтый осадок AgBr: Br– + Ag+ → AgBr↓. Окраска осадка зависит от размеров частиц. Часто осадок получается белым. В отличие от AgCl осадок AgBr не растворяется в гидроксиде аммония. Описание 2. Реакция с сильными окислителями (KMnO4, KBrO3, CrO3 и др.). Сильные окислители в кислой среде окисляют бромид-ионы до молекулярного брома: 10Br– + 2MnO4– + 16H+ → 5Br2 + 2Mn2+ + 8H2O. Молекулярный бром окрашивает раствор в бурый цвет, а над раствором появляются бурые пары брома, особенно при нагревании (реакцию надо проводить под тягой!). Образующийся бром можно экстрагировать из водной фазы органическими растворителями, слой которых окрашивается после экстракции в жёлто-бурый цвет. Опыт 6. Характерные реакции на ион I – Описание 1. Реакция с нитратом серебра. К 2-3 каплям раствора, содержащего иодид-ионы, добавляют 2-3 капли раствора нитрата серебра. Образуется светло-жёлтого осадка AgI: I– + Ag+ → AgI↓. Осадок AgI практически не растворим в HNO3 и NH3. Описание 2. Реакция с хлорной водой. К 1-2 каплям раствора, содержащего иодид-ионы, добавляют 2-3 капли 1М серной кислоты, 1-2 капли хлорной воды и 1-2 капли раствора крахмала. Появляется синее окрашивание. Вместо крахмала можно добавить несколько капель CHCl3, CCl 4 или С6Н6 и встряхнуть. Хлорная вода окисляет ионы I– до молекулярного иода I2: 2I– + Cl2 → I2 + 2Cl–. Выделяющийся иод окрашивает раствор в жёлто-коричневыйцвет. Органические растворители хорошо экстрагируют I2 из водной фазы, в результате чего органический слой окрашивается в фиолетово-розовый цвет. «Качественные реакции на анионы III группы». Общая характеристика анионов III группы К III группе анионов относятся ионы NO2– и NO3–. Анионы Нитрит-ионы являются анионами слабой кислоты и подвергаются гидролизу в водных растворах. Ионы NO2– обладают окислительными и восстановительными свойствами, а ионы NO3– – восстановительными. Все нитриты хорошо растворимы в воде. Все нитраты (кроме нитратов висмута и ртути) также хорошо растворимы в воде. Опыт 7. Характерные реакции на ион NO2 – Описание 1. Реакция с реактивом Грисса–Илосвая. Реактив Грисса–Илосвая (смесь сульфаниловой кислоты HSO3C6H4NH2 с α-нафтиламином C10H7NH2) с нитрит-ионами в нейтральных и уксуснокислых растворах придает раствору ярко-красный цвет за счёт образования азокрасителя. В кислой среде в присутствии нитрит-ионов образуется азотистая кислота, реагирующая с сульфаниловой кислотой с образованием соли диазония:
Соль диазония вступает в реакцию азосочетания с
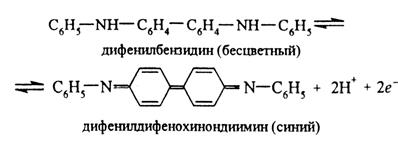
Описание 2. Реакция с солями аммония. Нитрит-ионы при нагревании окисляют ионы аммония NH4+ и карбамид до свободного N2: NO2– + NH4+ → N2 + 2H2O, 2NO2– + 2H+ + CO(NH2)2 → 2N2 + CO2 + 3H2O. Эти реакции используют с целью удаления нитрит-ионов. Описание 3. Реакция с иодидом калия. К 2-3 каплям раствора, содержащего нитрит-ионы, добавляют 1-2 капли 2М соляной кислоты или уксусной кислоты и 2-3 капли раствора иодида калия. Иодид калия в разбавленных кислых растворах окисляется нитрит-ионами до молекулярного иода I2: 2NO2– + 2I– + 4H+ → I2 + 2NO + 2H2O. Выделившийся иод окрашивает раствор в бурый цвет. При добавлении крахмала появляется синее окрашивание. Описание 4. Реакция с перманганатом калия. К 2-3 каплям раствора KMnO4 прибавляют 2-3 капли 1М серной кислоты, несколько капель раствора, содержащего нитрит-ионы, и слегка подогревают. Осуществляется превращение иона NO2– до NO3–: 5NO2– + 2MnO4– +6H+ → 5NO3– + 2Mn2+ + 3H2O. При этом раствор KMnO4 обесцвечивается. Опыт 8. Характерные реакции на ион NO3 – Описание 4. Реакция с дифениламином. На стеклянную пластинку помещают 2-3 капли раствора дифениламина в концентрированной серной кислоте и 1-2 капли раствора, содержащего нитрат-ионы. Дифениламин (C6H5)2NH в среде концентрированной H2SO4 окисляется нитрат-ионами вначале в бесцветный дифенилбензидин, а затем в дифенилдифенохинондиимин, окрашенный в интенсивно-синий цвет. Предполагают следующий механизм окисления дифениламина в кислой среде. Вначале происходит необратимое окисление дифениламина в дифенилбензидин: 2C6H5NHC6H5 → C6H5–NH–C6H4–C6H4–NH–C6H5 + 2H+ + 2e. дифениламин дифенилбензидин (бесцветный) Затем происходит обратимое окисление дифенилбензидина до окрашенного в синий цвет дифенилдифенохинондиимина:
Описание 2. Реакция с металлическим цинком или алюминием. К 3-4 каплям раствора, содержащего нитрат-ионы, прбвляют несколько капель 2М гидроксида натрия и 1-2 кусочка металлического алюминия. Пробирку закрывают не очень плотно ватой, поверх которой помещают влажную красную лакмусовую бумагу и нагревают на водяной бане. Выделяющийся аммиак окрашивает предварительно увлажнённую индикаторную бумагу в синий цвет. Нитрат-ионы в щелочной среде восстанавливаются металлическим цинком до аммиака: NO3– + 4Zn + 7OH– → NH3↑ + 4ZnO22– + 2H2O. Лабораторная работа №5 «Анализ смеси анионов» Цель работы: провести качественный анализ раствора, в котором возможно присутствие анионов 1, 2 и 3 аналитической группы. В противоположность катионам, анионы в большинстве случаев не мешают обнаружению друг друга, поэтому их открывают дробным методом, т.е. в отдельных порциях исследуемого раствора. В соответствии с этим при анализе анионов групповые реагенты применяют обычно не для разделения групп, а лишь для того, чтобы установить их наличие или отсутствие. Если установлено отсутствие анионов всей группы, то не следует проводить реакции на отдельные анионы. В этом смысле проведение групповых реакций значительно облегчает работу и экономит время. Существуют некоторые смеси анионов, для определения состава которых необходимо проведение систематического анализа. Поскольку в данной работе вы познакомились лишь с элементами качественного анализа анионов, то задача на смесь анионов будет включать не все, а некоторые анионы 1,2 и 3 аналитических групп: SO42-, CO32-, PO43-, Cl-, J-, NO3-,NO-2. Подготовка к выполнению работы и проведение анализа. 1. Повторить технику выполнения основных операций (см. приложение) 2. Изучить основные аналитические реакции указанных анионов, используя растворы их солей. 3. Ознакомиться с рекомендациями к выполнению контрольных анализов (см.приложение) 4. после этого получить у лаборантов контрольный (анализируемый) раствор и выполнить лабораторную работу в соответствии со схемой анализа (см. схему 4 в приложении) и приведенным ниже ходом выполнения. Результаты анализа представить в виде таблицы (образец - табл.1).
Предварительные испытания
|
||||
|
Последнее изменение этой страницы: 2016-04-23; просмотров: 3184; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.15.211.55 (0.008 с.) |