Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Т. Г. Кудырко, Е.В. МальевскаяСодержание книги
Поиск на нашем сайте
Т. Г. Кудырко, Е.В. Мальевская
Химические методы Разделения И обнаружения
Методические указания к лабораторным работам по курсу «Аналитическая химия и методы качественного анализа» для студентов химико-технологических специальностей.
Гродно 2006 УДК 543.061 (075.8) ББК 24.4 Р 15
Рассмотрено и рекомендовано к изданию редакционно-издательским советом университета
Рецензенты: доцент кафедры химии ГГАУ,
Т.Г. Кудырко, Е.В. Мальевская Химические методы разделения и обнаружения: Методические указания к лабораторным работам по курсу «Аналитическая химия и методы качественного анализа» для студентов химико-технологических специальностей /Т.Г. Кудырко, Е.В. Мальевская – Гр.: ГГАУ, 2006. – с.
ISBN 985-434-345-6
В пособии рассматриваются общие вопросы качественного химического анализа, а также методы разделения и обнаружения катионов и анионов, имеющих наибольшее значение в химической технологии. Предназначается для студентов химико-технологических специальностей.
УДК 543.061 (075.8) ББК 24.4
© Т.Г. Кудырко, Е.В. Мальевская 2006 © Учреждение образования «Гродненский государственный ISBN 985-434-345-6 Аграрный университет», 2006 ВВЕДЕНИЕ Предмет, методы и задачи аналитической химии Аналитическая химия – это наука о методах определения химического состава веществ. Предметом её является теория и практика химического анализа. Химический анализ – это совокупность действий, которые имеют своей целью получение информации о химическом составе объекта. Для проведения анализа необходимо, чтобы вещество обладало аналитическими свойствами (признаками) – химическими или физическими свойствами, которые позволяют обнаружить вещество или определить его количество. К ним относятся цвет, запах, способность вещества образовывать окрашенные и малорастворимые соединения, газы при взаимодействии с определенными реагентами и т. д. В зависимости от цели различают следующие виды химического анализа: ü качественный (обнаружение компонентов пробы, или идентификация); ü количественный (установление количества компонента в пробе). Теоретические основы качественного и количественного анализа являются общими, в обоих видах анализа используются одни и те же химические реакции или физические явления. Различия заключаются в том, что в качественном анализе только фиксируют аналитический эффект или аналитическое свойство, а в количественном основное внимание уделяют измерению аналитического сигнала. Качественный анализ обычно предшествует количественному. В зависимости от поставленной задачи методы аналитической химии классифицируются следующим образом: ü методы обнаружения – используются для качественного анализа; ü методы определения – используются для количественного опреде-ления веществ в пробе; ü методы разделения – используются и в качественном, и в количественном анализе для выделения определяемого вещества и отделения мешающих анализу веществ. Химический анализ широко используется на предприятиях химической промышленности для контроля хода технологического процесса, качества сырья и готовой продукции, промышленных отходов. ОБЩИЕ ВОПРОСЫ КАЧЕСТВЕННОГО АНАЛИЗА Таблица 1 Сравнительная характеристика свойств
Отсюда следует, что в случае коллоидообразования осадок не выпадает, его нельзя отделить от раствора фильтрованием или центрифугированием, в то время как большинство разделений в качественном анализе проводится именно с использованием реакций осаждения. Следовательно, коллоидообразование играет отрицательную роль в анализе и химику-аналитику необходимо предпринимать специальные меры с целью коагуляции коллоидных растворов. Коагуляции способствуют: 1. наличие в растворе сильного электролита; 2. нагревание раствора; 3. перемешивание раствора. Например, осаждение катионов III группы в виде сульфидов, которые склонны к образованию коллоидных растворов, ведут из горячих растворов при непрерывном перемешивании и в присутствии электролита-коагулятора NH4Cl. Однако в ряде случаев коллоидообразование играет положительную роль в качественном анализе, т. к. при этом увеличивается чувствительность реакций и становится возможным обнаружение следовых количеств веществ. Например, малые количества иона NH4+ невозможно открыть реакцией со щёлочью, но можно обнаружить по жёлто-бурому окрашиванию коллоидного раствора, полученного при действии на пробу реактива Несслера. Органические аналитические реагенты и их применение Органические реагенты (ОР) – это органические соединения, вступающие в реакции с веществами неорганической или органической природы с образованием продуктов, обладающих аналитическими свойствами. ОР широко используют в аналитической химии благодаря ряду их преимуществ перед неорганическими реагентами: 1) высокая избирательность действия. По этой причине многие ОР являются специфическими реагентами на неорганические ионы. Например, реактив Грисса является специфическим ОР на нитрит-ионы NO2–; 2) высокая чувствительность реакций с участием ОР, что позволяет обнаружить вещество в очень малых концентрациях. Высокая чувствительность и селективность органических реагентов обусловлены их высокой молярной массой, низкой растворимостью в воде комплексов органических реагентов с ионами металлов, а также интенсивной окраской таких комплексов. В качественном анализе органические реагенты применяют для: А) обнаружения с использованием реакций осаждения и реакций, протекающих с образованием окрашенных продуктов; Б) маскирования мешающих ионов с целью подавления побочных реакций аналитического реагента с посторонними ионами, присутствующими в анализируемом растворе. Обнаружение катионов и анионов осуществляется с помощью органических реагентов, образующих с открываемыми ионами комплексные соединения с интенсивной характерной окраской. Наиболее часто для этой цели используют ализарин (реагент на ион Al3+), дифенилкарбазид (реагент на ион Cr3+), диметилглиоксим (реагент на ион Ni2+), дитизон (реагент на ион Zn2+), дифениламин (реагент на ион NO3-) и др. Маскирование проводят, используя органические комплексообразующие реагенты. Например, Fe3+ мешает определению никеля с диметилглиоксимом в аммиачных растворах из-за осаждения гидроксида Fe(ОН)3. Для маскирования ионов Fe3+ к анализируемому раствору добавляют винную, щавелевую или лимонную кислоту, которые связывают их в бесцветные растворимые комплексы. Кроме органических реагентов, в качественном анализе применяют также органические растворители. Их используют для приготовления растворов органических реагентов и проведения экстракции. Например, раствор дитизона для обнаружения ионов Zn2+ готовят на хлороформе или четырёххлористом углероде. При экстракции вещество переходит из одной жидкой фазы (чаще всего – водного раствора) в другую (органическую), которая не смешивается с ней. Примером использования экстракции в качественном анализе является реакция обнаружения иодид-ионов: 2I– + Cl2 = I2 + Cl–. Образовавшийся продукт реакции I2 плохо растворяется в воде, поэтому аналитический эффект реакции – появление жёлто-бурой окраски раствора выражен очень слабо. Однако если провести последующую экстракцию I2 в органическую фазу (хлороформ, бензол), то слой органического растворителя приобретает характерную для I2 интенсивную фиолетово-розовую окраску. Причина заключается в том, что неполярное вещество I2 лучше растворяется в неполярном органическом растворителе, чем в полярном (воде). Лабораторная работа №1 «Качественные реакции на катионы I аналитической группы». Общая характеристика В I аналитическую группу входят катионы Na+, K+, NH4+, Mg2+. Ионы Na+ и K+относятся к I группе Периодической системы элементов Д. И. Менделеева. Большинство солей катионов этой группы хорошо растворимо в воде. Главное отличие катионов I группы – растворимость в воде их сульфидов, гидроксидов, карбонатов и хлоридов. Поэтому катионы I группы не осаждаются групповыми реагентами других групп, а остаются в растворе. Ионы магния, который находится во II группе Периодической системы элементов, по некоторым химическим свойствам ближе к катионам щелочных, а не щелочноземельных металлов. При осаждении II аналитической группы карбонатом аммония в присутствии NH4Cl ионы Mg2+ остаются в растворе. Все катионы I аналитической группы бесцветны. Окраска некоторых солей обусловлена окраской анионов. Группового реагента, осаждающего все катионы I аналитической группы, нет.
Опыт 1. Характерные реакции на ион Na+ Описание 1. Микрокристаллоскопическая реакция с антимонатом калия. Если в анализируемом растворе отсутствуют ионы NH4+ и Mg2+, то ионы Na+ открывают микрокристаллоскопической реакцией с антимонатом калия KH2SbO4. При этом в нейтральной среде образуется белый мелкокристаллический осадок антимоната натрия NaH2SbO4: Na+ + KH2SbO4 → NaH2SbO4↓ + K+. В сильнощелочной среде осадок не образуется, а из сильнокислых растворов выпадает белый аморфный осадок метасурьмяной кислоты HSbO3, поэтому при рассмотрении под микроскопом необходимо убедиться в том, что полученный осадок – кристаллический. Реакцию проводят на холоду. Мешающие ионы – Li+, NH4+, Mg2+. Описание 2. Микрокристаллоскопическая реакция с цинкуранилацетатом. КатионыNa+ открывают также микрокристаллоскопической реакцией с цинкуранилацетатом, образующим характерные жёлтые октаэдрические и тетраэдрические кристаллы натрийцинкуранилацетата, не растворимого в уксусной кислоте: Na+ + Zn[(UO2)3(CH3COO)8] + CH3COO– + 9H2O → → NaZn[(UO2)3(CH3COO)9]·9H2O. Мешающие ионы – Li+, K+, NH4+, Mg2+. На предметное стекло помещают каплю раствора, содержащего ионы натрия, и каплю уксуснокислого раствора цинкуранилацетатом. При облучении ультрофиолетовым светом наблюдают образование характерных кристаллов. Описание 3. Окрашивание пламени. Соли натрия окрашивают пламя в интенсивно-жёлтый цвет. Опыт 2. Характерные реакции на ион K+
Описание1. Микрокристаллоскопическая реакция с гексанитрокупратом (II) натрия и свинца. КатионыK+ в нейтральной среде образуют с гексанитрокупратом (II) натрия и свинца Na2Pb[Cu(NO2)6] чёрные кубические кристаллы K2Pb[Cu(NO2)6]: 2K+ + Na2Pb[Cu(NO2)6] → K2Pb[Cu(NO2)6] + 2Na+. На предметное стекло помещают 1 каплю раствора, содержащего ионы калия. Рядом помещают 1 каплю раствора K2Pb[Cu(NO2)6]. Стеклянной палочкой соединяют капли и дают постоять. Рассматривают под микроскопом образовавшиеся кристаллы. Описание 2. Реакция с гексанитрокобальтатом (III) натрия. Ионы K+образуют с гексанитрокобальтатом (III) натрия жёлтый кристаллический осадок состава K2Na[PbCo(NO2)6]: 2K+ + Na3[Co(NO2)6] → K2Na[Co(NO2)6] + 2Na+. К 2-3 каплям раствора, содержащего ионы калия, добавляют 2-3 капли раствора реагента и слегка нагревают в водяной бане. Образуется желтый осадок. Если раствор кислый, необходимо добавить СН3СООNa до рН 4-5. Описание 3. Окрашивание пламени. Соли калия окрашивают пламя в фиолетовый цвет.
Опыт 3. Характерные реакции на ион NH 4+ Описание 1. Реакция со щелочами. В пробирку поместить 5-6 капель раствора соли аммония, добавить столько же раствора NaOH. Нагреть пробирку и выделяющиеся из пробирки пары внести мокрую фенолфталеиновую бумажку. Она краснеет. Обратите внимание на запах выделяющегося газа. NH4Cl + NaOH = NH4+ + OH– → NH3↑ + H2O. Описание 2.Реакция с реактивом Несслера. К 1-2 каплям раствора, содержащего ионы аммония, добавляют 1-2 капли реактив Несслера в щелочной среде образует с ионами аммония характерный красно-бурый (оранжевый)осадок: NH4+ + 2K2[HgI4] + 4KOH → [OHg2NH2]I↓ + KCl + 7KI + 3H2O. Если концентрация ионов NH4+ мала, осадок не выпадает, а раствор окрашивается в оранжевый цвет. Это наиболее специфическая реакция на ионы NH4+. Катионы I и II групп не мешают определению, т. к. образуют бесцветные гидроксиды.
Опыт 4. Характерные реакции на ион Mg2+ Описание 1. Реакции со щелочами и аммиаком. К 1-2 каплям раствора, содержащего катионы Mg2+, прибавляют 1-2 капли гидроксида аммиака или натрия, образуется белый аморфный осадок гидроксида магния Mg(OH)2: Mg2+ + 2OH– → Mg(OH)2↓. Осадок не растворяется в щелочах, но растворяется в кислотах. Описание 2. Реакция с гидрофосфатом натрия. К 1-2 каплям раствора, содержащего катионы Mg2+, прибавляют 2-3 капли 2М раствора соляной кислоты, 1 каплю гидрофосфата натрия и при присутствии аммиачного буферного раствора (рН=9) выпадает белый мелкокристаллический осадок магнийаммонийфосфата NH4MgPO4: Mg2+ + HPO42– + NH3 → NH4MgPO4↓. Реакцию можно провести как микрокристаллоскопическую.
Методы разложения и удаления солей аммония
Ионы NH4+ мешают открытию ионов Na+ и K+, поэтому при проведении анализа поступают следующим образом: ─ сначала открывают ионы NH4+; ─ затем полностью удаляют ионы NH4+ (если обнаружены); ─ после полного удаления ионов NH4+ открывают Na+ и K+. Существуют следующиеспособы удаления катионов NH4+: 1) анализируемый раствор, содержащий катионы аммония, подкисляют концентрированной азотной или соляной кислотой, досуха упаривают в фарфоровой чашке, а затем прокаливают сухой остаток до полного удаления NH4+. Полноту удаления контролируют качественной реакцией с реактивом Несслера; 2) к анализируемому раствору добавляют раствор щёлочи с последующим нагреванием до полного удаления NH4+. Полноту удаления контролируют по влажной индикаторной бумаге.
Систематический ход анализа катионов I группы
При изучении реакций катионов I аналитической группы можно сделать следующие выводы: а) присутствие иона NH4+ мешает открытию иона К+ всеми реактивами и открытию иона Na+ реактивом KH2SbO4; б) обнаружению ионов NH4+ и Mg2+ другие катионы I группы не мешают; в) ион К+ может быть обнаружен в присутствии ионов Na+ и Mg2+; г) ионы NH4+ можно удалить из раствора выпариванием и последующим прокаливанием; д) ионы Mg2+ можно удалить из раствора осаждением в виде Mg(OH)2. Исходя из этого, систематический ход анализа должен включать следующие операции, которые выполняются в строго определённой последовательности: 1) обнаружение иона NH4+; 2) удаление иона NH4+ (если обнаружен); 3) обнаружение иона К+; 4) обнаружение иона Mg 2+; 5) осаждение иона Mg 2+ (если обнаружен); 6) обнаружение иона Na+. Схема отделения и разделения ионов внутри I аналитической группы при проведении систематического анализа представлена на рис. 2.
Рис. 2. Схема разделения катионов I группы «Качественные реакции на катионы II аналитической группы». Общая характеристика Во II аналитическую группу входят катионы Ca2+, Ba2+, Sr2+. Катионы II аналитической группы осаждаются из водных растворов в виде малорастворимых карбонатов. Групповым реагентом является карбонат аммония (NH4)2CO3 в присутствии NH4OH и NH4Cl (pH≈9,2). При этом значении рН достигается практически полное осаждение карбонатов II группы, а ионы I группы остаются в растворе. Все карбонаты хорошо растворимы в кислотах, в том числе и слабой уксусной кислоте, с выделением газообразного диоксида углерода, поэтому их осаждение нельзя проводить в кислой среде. Соли Ca2+ и Ba2+ бесцветны. Окраска некоторых солей обусловлена окраской анионов. Растворы гидроксидов Ca2+ и Ba2+ – сильные основания. Опыт 5. Характерные реакции на ион Ca2+ Описание 1. Реакция с оксалатом аммония. К 2-3 каплям раствора, содержащего ионы Ca2+, добавляют 2-3 капли раствора реагента. В результате реакции образуется белый кристаллический осадок оксалата кальция CaC2O4: Ca2+ + C2O42– → CaC2O4↓. Реакцию проводят в слабокислой среде (рН ≈6–6,5) в присутствии уксусной кислоты, в которой CaC2O4 не растворяется. Мешают ионы Mg2+, Ba2+, Sr2+, дающие аналогичные осадки. Описание 2. Реакция с гексацианоферратом (II) калия. На часовом стекле перемешивают каплю раствора с 2-3 каплями раствора реагента, затем добавляют 1-2 капли раствора хлорида аммония, каплю этанола и снова перемешивают. В результате образуется белый кристаллический осадок гексацианоферрата (II) аммония и кальция (NH4)2Ca[Fe(CN)6]: 2NH4+ + Ca2+ + [Fe(CN)6]4– → (NH4)2Ca[Fe(CN)6]↓. Осадок не растворим в уксусной кислоте. Общая характеристика В III аналитическую группу входит большое количество катионов, образованных различными элементами: а) s2- (Ве2+) и p1-элементами; б) 3d-, 4d- и 5d-элементами; в) f-элементами. Однако все они имеют общее свойство, отличающее их от катионов I и II групп. Это способность осаждаться в виде сульфидов или гидроксидов при действии группового реагента – (NH4)2S в присутствииаммиачного буфера. Сульфиды катионов III группы, не растворимые в воде, растворяются в разбавленных минеральных кислотах, поэтому они не осаждаются сероводородом из кислых растворов. Катионы III группы, в отличие от катионов II группы, образуют нерастворимые гидроксиды и растворимые в воде сульфаты. Одним из характерных свойств катионов III группы является их способность образовывать комплексные соединения. Многие из них вступают в реакции окисления-восстановления. Большинство соединений катионов III группы окрашено. Так, соли Cr3+ имеют сине-зелёную окраску, соли Fe3+ – жёлтую. Хром и марганец в высших степенях окисления образуют окрашенные анионы: CrO42– – жёлтого цвета, Cr2O72– – оранжевого, MnO4– – малиново-фиолетового. Окрашены также некоторые гидроксиды и все сульфиды, за исключением ZnS. В химической технологии наиболее часто используются следующие катионы III группы: Fe2+, Fe3+, Zn2+, Al3+, Cr3+, Mn2+
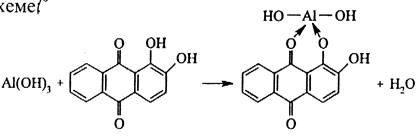
Опыт 7. Характерные реакции на ион Al3+ Описание 1. Реакция с ализарином. В пробирку к 2-3 каплям кислого раствора, содержащего ионы алюминия, добавляют 2-3 капли раствора ализарина (1,2-диоксиантрахинон), твердый ацетат натрия до слабокислой среды и нагревают. Образуется малорастворимое комплексное соединение, ярко-красный хлопьевидный осадок, называемое «алюминиевыми лаками». Реакция протекает по схеме
Комплексы устойчивы в уксуснокислой среде. Ализарин – специфический реактив, позволяющий определять Al3+ в присутствии других катионов. Реакция высокочувствительна – предел обнаружения 0,5 мкг. Мешают катионы Zn2+, Mn2+, Cr3+, Fe3+. Для их маскировки используют K4[Fe(CN)6], с которым мешающие ионы образуют нерастворимые в воде гексацианоферраты (II). Реакция выполняется в двух вариантах – как пробирочная и как капельная. Описание 2. Реакция с аммиаком. К 3-4 каплям раствора, содержащего ионы алюминия, осторожно по каплям добавляют гидроксида аммония до образования белого студенистого осадка гидроксида алюминия. Al3+ + 3OH– → Al(OH)3↓. Наиболее полное осаждение гидроксида происходит при рН≈5–6. Описание 3. Реакция со щелочами. Гидроксид натрия (калия) образуют с ионами Al3+ белый осадок гидроксида алюминия Al(OH)3. Наиболее полное осаждение наблюдается в интервале рН 4–7,8. При дальнейшем прибавлении щёлочи амфотерный гидроксид алюминия растворяется с образованием гидроксоалюминатов. Если снова понизить рН среды до значения ≈5, то гидроксоалюминаты разрушаются и снова выпадает осадок Al(OH)3. (Если добавить твердый хлорид аммония и нагреть, вновь образуется осадок гидроксида алюминия). Написать реакции.
Опыт 8. Характерные реакции на ион Cr3+ Описание 1. Реакция с пероксидом водорода. К 2-3 каплям раствора, содержащего ионы хрома (3), добавляют по каплям 2М гидроксида натрия до образования осадка гидроксида хрома и далее до его растворения и образования гидроксокомплексов. Затем добавляют 1 каплю 30%-ного или 6-8 капель 3%-ного раствора пероксид водорода и нагревают. Образуется жёлтый раствор хромата 2Cr(OH)3 + 3H2O2 + 4OH– → 2CrO42– +8H2O. При действии H2O2 на растворы хроматов образуются различные пероксокомплексы хрома, окраска которых зависит от рН среды. В кислой среде – образуются комплексные соединения голубого, а в нейтральной – фиолетового цвета. В водных растворах пероксидные комплексы хрома неустойчивы, но устойчивы в органических растворителях. Описание 2. Реакция с дифенилкарбазидом. Дифенилкарбазид (I) взаимодействует с ионами Cr (VI) в сильнокислой среде, при этом появляется фиолетовое окрашивание. Предполагается следующий механизм реакции. Сначала ионы Cr (VI) окисляют дифенилкарбазид до бесцветного дифенилкарбазона (II), восстанавливаясь при этом до Cr3+:
Ионы Cr3+ образуют с дифенилкарбазоном (II) красно-фиолето-вые внутрикомплексные соединения. Опыт 9. Характерные реакции на ион Fe3+ Описание 1. Реакция с гексацианоферратом (II) калия. Это наиболее характерная и чувствительная реакция на ионы Fe3+. К 1-2 каплям раствора, содержащего ионы железа(3) и имеющего рН 1-3, добавляют 1-2 капли реагента. В результате которой образуется тёмно-синий осадок «берлинской лазури 4Fe3+ + 3[Fe(CN)6]4– → Fe4[Fe(CN)6]3↓. Реакцию обязательно проводят в кислой среде, т. к. образующиеся комплексы легко разрушаются в щелочной среде с выделением гидроксида железа. Последующее подкисление смеси возвращает окраску. Описание 2. Реакция с роданидом аммония (тиоцианатом). К 1-2 каплям раствора, содержащего ионы железа (3), добавляют каплю раствора NH4SCN. Ионы Fe3+ образуют окрашенное в кроваво-красный цвет соединение, состав которого определяется концентрацией роданид-ионов: Fe3+ + nCNS– → Fe(CNS)n. С увеличением концентрации роданид-ионов окраска усиливается, поэтому реакцию необходимо проводить с избытком роданида. Для предотвращения выпадения бурого осадка гидроксида железа следует вести обнаружение в кислой среде. Описание 3 Реакция с гидроксидом натрия. К 1-2 каплям раствора, содержащего ионы железа(3), добавляют 1каплю щелочи. В результате реакции образуется осадок кирпично-красного цвета. В отличие от гидроксида алюминия, гидроксида хрома(3) и гидроксида цинка не растворяется в избытке щелочи. FeCl3 + 3NaOH →
Опыт 10.Характерные реакции на ион Fe2+ Описание 1. Реакция с гексацианоферратом (III) калия. Это наиболее характерная и чувствительная реакция на ионы Fe2+. К 1-2 каплям слабокислого раствора, содержащего ионы железа (2), добавляют 1-2 капли раствора реагента. В результате которой образуется интенсивно-синий осадок «турнбулевой синью»: 3Fe2+ +2[Fe(CN)6]3– → Fe3[Fe(CN)6]2↓. Осадок не растворяется в кислотах, но разлагается в щелочной среде с образованием гидроксидов железа. Реакция очень чувствительна: предел обнаружения составляет 0,05 мкг. Описание 2. Реакция с диметилглиоксимом К 2-3 каплям раствора, содержащего ионы железа (2), добавляют каплю 20%-ного раствора винной кислоты, 1 каплю диметилглиоксима (H2D) и по каплям раствор аммиака до щелочной реакции. Образуется устойчивое комплексное соединение красного цвета: Fe2+ + 2H2D + 3NH3 + H2O → Fe[(HD)2(H2O)(NH3)] + 2NH4+. Комплексные соединения Fe2+ с H2D хорошо растворимы в воде. Мешают катионы Ni2+, образующие нерастворимые в воде диметилглиоксиматы никеля. Мешающее влияние ионов Fe3+, образующих в аммиачной среде окрашенный гидроксид, устраняют добавлением лимонной, щавелевой или винной кислоты.
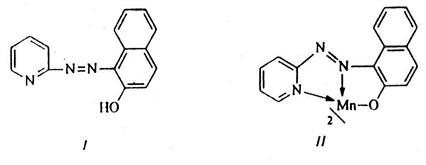
Опыт 11. Характерные реакции на ион Mn2+ Описание 1. Реакция со щавелевой кислотой. Щавелевая кислота образует с MnO(OH)2 комплексное соединение состава H[Mn(C2O4)2], окрашенное в малиново-розовый цвет: 2MnO(OH)2 + 5H2C2O4 → 2H[Mn(C2O4)2] + 2СО2↑ + 6H2O. Мешают катионы Fe2+ и Fe3+. Для их маскировки используют NaF. Описание 2. Реакции окисления катионов Mn2+ до перманганат-ионов. Катионы Mn2+ под действием различных окислителей окисляются до перманганат-ионов, окрашенных в малиново-фиолетовый цвет. В качестве окислителей используют висмутат натрия NaBiO3, диоксид свинца PbO2, персульфат аммония (NH4)2S2O8 и др. Окисление висмутатом натрия протекает по схеме: 2Mn2+ + 5NaBiO3 + 14H+ → 2MnO4– + 5Bi3+ + 5Na+ + 7H2O. К 5-6 каплям раствора персульфата аммония прибавляют каплю 2М серной кислоты, 1-2 капли фосфорной кислоты(кон.), 1-2 капли раствора нитрата серебра и нагревают. В нагретую окислительную смесь вносят при помощи стеклянной палочки минимальное количество раствора, содержащего ионы марганца(2) и не содержащего хлорид-ионов, перемешивают и наблюдают красно-фиолетовую окраску раствора. Описание 3. Реакция с ПАН (1-(2-пиридилазо)-2-нафтол). К 2-3 каплям раствора, содержащего ионы марганца (2). Добавляют 5-7 капель воды, 4-5 капель 0,1%-ного раствора ПАН (структура I), который образует с ионами Mn2+ при рН=7‑10 малорастворимые в воде комплексные соединения красно-фиолетового цвета с предполагаемой структурой II:
Опыт 12. Характерные реакции на ион Zn2+ Описание 1. Реакция с дитизоном. К 1-2 каплям исследуемого раствора прибавляют 1-2 капли 20%-ного раствора Na2S2O3, 1-2 капли 10%-ного раствора KCN и доводят рН раствора до 4-5 20%-ным раствором уксусной кислоты. Экстрагируют 0,02%-ным раствором дитизона (дифенилтиокарбазон) в CCl4. Образует с ионами Zn2+ внутрикомплексные соединения, хорошо растворимые в органических растворителях (CCl4, CHCl3): H2Dz + Zn2+ + → Zn(HDz)2 + 2H+. Эти соединения в щелочной среде окрашены в красный цвет, причём слой органического растворителя имеет более интенсивную окраску, чем водный. Мешающие ионы, способные к образованию дитизонатных комплексов (Cd2+, Pb2+, Cu2+), маскируют тиосульфатом, цианидом или осаждают в виде сульфидов. Описание 2. Реакция с аммиаком. При постепенном добавлении гидроксида аммония к раствору, содержащему ионы Zn2+, выпадает белый осадок гидроксида цинка, который растворяется в избытке аммиака с образованием комплексов: Zn(OH)2 + 6NH3 → [Zn(NH3)6](OH)2. Лабораторная работа №2 «Анализ смеси катионов первой и второй группы». Цель работы: провести качественный анализ раствора, в котором возможно присутствие ионов NH4+, K+, Na+, Mg2+, Ca2+, Ba2+. Подготовка к выполнению работы и проведение анализа. 1.Ознакомиться с техникой выполнения основных операций (см. приложение); 2. Изучить основные аналитические реакции указанных ионов, используя растворы их солей; 3. Ознакомиться с рекомендациями к выполнению контрольных анализов (см. приложение); 4. Получить у лаборантов контрольный (анализируемый) раствор и выполнить лабораторную работу в соответствии со схемой (см. схему 1,2) анализа и приведенным ниже ходом выполнения. Результаты анализа представить в виде таблицы Таблица 1.
Анализируемый раствор делят на три части: с одной проводят предварительные испытания, другую подвергают систематическому анализу, третью оставляют для проверки полученных результатов. Предварительные испытания (проводят с отдельными порциями исследуемого раствора) Реакция среды. Определяют рН раствора с помощью универсальной бумаги. 1.2. Обнаружение ионов NH4+. Определение проводят, действуя на исследуемый раствор раствором щелочи NaOH или КОН при нагревании: NH4+ + OH– → NH3↑ + H2O. Определение проводят в «газовой камере», состоящей из двух часовых стекол одинакового размера. На нижнее стекло помещают 1-2 капли анализируемого раствора, 1-2 капли 1н раствора NaOH и накрывают другим стеклом, на вогнутую поверхность которого прикреплен кусочек влажной индикаторной бумаги. Для ускарения реакции камеру слегка нагревают на водяной бане. Посинение индикаторной бумаги свидетельствует о наличии в растворе ионов NH4+ 1.3. Проба на присутствие ионов К+ (выполняется толь в случае отсутствия ионов NH4+). Если проба 1.2 дала отрицательный результат, на предметное стекло помещают каплю исследуемого раствора и нагревают его на плитке до появления каемочки сухой соли. На некотором расстоянии от нее наносят каплю Na2PbCu(NO2)6 (реактив для обнаружения ионов К+). Реактив осторожно подводят к сухой каемочке соли и через 2-3 мин рассматривают выпавшие кристаллы под микроскопом. Форма кристаллов показана на рисунке в учебнике. Если в растворе присутствуют ионы К+, то образуются кубические кристаллы К2PbCu(NO2)6 черного или коричневого цвета. Ионы NH4+ образуют такие же кристаллы и поэтому мешают реакции. При выполнении этой реакции полезно провести холостой опыт. Выполнение холостого опыта. При проведении реакции обнаружения полезно сравнивать наблюдаемый эффект с результатом холостого опыта, в котором использовались все те же реагенты в тех же условиях, что и в основном, но в отсутствии определяемого иона. Заключения о наличии иона в системе можно делать лишь в то случае, если наблюдаемый эффект реакции гораздо интенсивнее, чем в холостом опыте. Систематический ход анализа Анализ фильтрата 2.2.1 Удаление ионов NH4+ . Фильтрат перенося в фарфоровый тигель, выпаривают досуха и прокаливают на плитке до полного разложения аммонийных солей. Когда прекратится выделение белого дыма, и тигель (после полного остывания!) добавляют несколько капель дистиллированной воды для растворения сухого остатка. Капля полученного раствора переносят на часовое стекло и добавляют 1-2 капли реактива Несслера. При действии его на раствор, содержащие ионы NH4+, образуется красно-бурый осадок: NH3 + 2K2[HgI4] + 3KOH → HN-Hg2IOH ↓+ 7KI + 2H2O Таким способом проверяют полноту удаления ионов NH4+ 2.2.2. Обнаружение ионов К+. 1-2 капли раствора, полученного по п. 2.2.1, переносят на предметное стекло и анализируют аналогично п 1.3. 2.2.3. обнаружение ионов Mg2+. К отдельной порции раствора (2-3 капли), полученного по п.2.2.1, добавляют несколько капель 2н раствора гидроксида калия. Содержимое пробирки нагревают на водяной бане. Образование белого аморфного осадка указывает на присутствие ионов Mg2+ 2.2.4. Обнаружение ионов Na+ ведут различно в зависимости от присутствия или отсутствия в исследуемом растворе ионов Mg2+. Ионы Mg2+ отсутствуют. Порцию исследуемого раствора, не содержащего ионов Mg2+ и NH4+, выпаривают досуха в фарфоровой чашке. На предметное стекло наносят каплю раствора KH2SbO4 и вносят в нее несколько крупинок сухого остатка. Если ионы Na+ присутствуют, под микроскопом отчетливо видны прозрачные кристаллы зернообразной формы. (см. рисунок в учебнике) При выполнении э
|
||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-04-23; просмотров: 411; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.219.119.163 (0.011 с.) |


 Упаривание раствора и прокаливание сухого остатка
Упаривание раствора и прокаливание сухого остатка