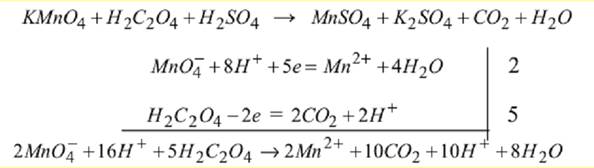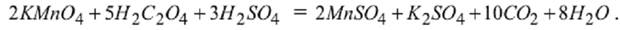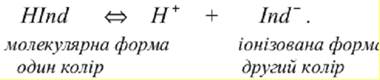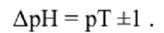Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Метод оксидиметрії (на прикладі визначення концентрації калій перманганату).Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Класифікація методів окисно-відновного титрування (редокс-методів) За характером титранта редокс– методи поділяють на: • оксидиметрія – методи визначення відновників за допомогою титранту– окисника; • редуктометрія – методи визначення окисників за допомогою титранту–відновника. Перманганатометрія. Головною реакцією метода є окиснення відновників перманганатом калію в кислому середовищі: MnO4⁻ + 9H+ +5e = Mn2+ + 4H2O Перманганат калію – дуже сильній окисник. Найбільшу окисну властивість він має в кислому середовищі. Визначення точної концентрації (стандартизацію) приготовленого приблизно 0,01н. розчину KMnO4 (fекв = 1/5) за0,01 н. розчином оксалатної кислоти проводять наступним чином. Заповнюють бюретку до верхнього меніску робочим розчином KMnO4, перед тим двічі ополіскуючи її розчином KMnO4. До конічної колби відбирають піпеткою 20–25 мл 0,01 н. розчину оксалатної кислоти, додають до нього 10–15 мл 2 н. розчину H2SO4 і нагрівають до 80–900С, ні в якому разі не доводячи до кипіння, бо оксалатна кислота розкладається при кип’ятінні. Отриманий гарячий розчин оксалатної кислоти титрують ~ 0,01 н. розчином KMnO4 (fекв = 1/5), додаючи його повільно по краплях доти, доки розчин у колбі не забарвиться у стійкий блідо–рожевий колір, що не зникає протягом 1–2 хвилин. При цьому має місце перебіг такої реакції:
Після підбору подібних членів і підстановки коефіцієнтів остаточна реакція набуває вигляду:
Молярну концентрацію еквівалента (1/5 KMnO4) у розчині розраховують за формулою:
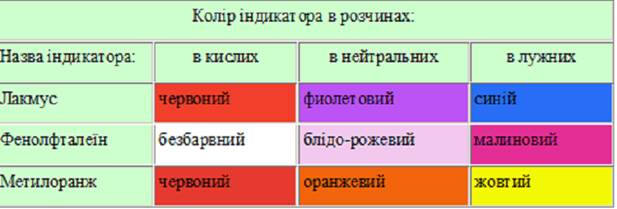
Перманганатометрія використовується для визначення перманганатної окисності води. Кислотно-основні індикатори. Пояснити механізм зміни кольору за іонною теорією Оствальда. Існує декілька теорій, які пояснюють природу зміни забарвлення індикаторів – це іонна, хромофорна і іонно-хромофорна. Найбільш простою є теорія іонного забарвлення Оствальда. Згідно з теорією Б. Освальда (1984 р.), індикаторами в методі нейтралізації є речовини, забарвлення яких залежить від рН розчину. За хімічною природою кислотно-основні індикатори є слабкими органічними кислотами (HInd) або основами (IndOH), які у воді частково дисоціюють. При цьому недисоційовані молекули і утворені іони мають різний колір. Наприклад, для індикатора– кислоти:
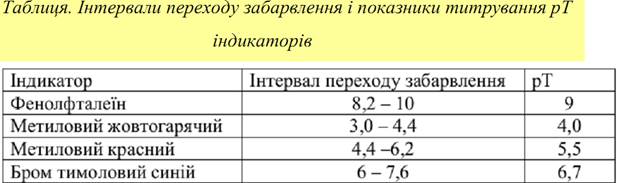
З рівняння очевидно, що зміна кольору індикатора викликається зміщенням хімічної рівноваги реакції при збільшенні чи зменшенні рН розчину. Індикатори змінюють своє забарвлення не при будь-яких значеннях рН, а лише у вузькому інтервалі рН, який має назву інтервал переходу забарвлення індикатору ∆ рН. Він розраховується за формулою:
Значення рН, при якому закінчується титрування в присутності даного індикатора, називається показником титрування (рТ).
Дати визначення основним поняттям титриметричного аналізу (титрант, стандартний розчин, точка еквівалентності, кінцева точка титрування). Титриметричний метод аналізу (титриметрія) – це кількісний метод аналізу, що ґрунтується на точному вимірюванні об’єму стандартного розчину, який витрачається на титрування точно взятого об’єму розчину речовини, що визначається. Титрування – повільне (по краплях) додавання стандартного розчину до розчину, що аналізується, до моменту встановлення точки еквівалентності. Стандартний (робочий, титрований) розчин або просто титрант – це розчин, концентрація якого відома з високою точністю. Точка еквівалентності (ТЕ) – це момент титрування, коли кількість еквівалентів титранту дорівнює кількості еквівалентів речовини, що визначають. Точка еквівалентності визначається з допомогою індикаторів – речовин, які повинні змінювати своє забарвлення в точці еквівалентності. Кінцева точка титрування (КТТ) – момент титрування, коли змінюється якась властивість розчину, наприклад, забарвлення. КТТ не завжди співпадає з ТЕ, але бажано, щоб вона була близькою до неї. Буферні системи, їх класифікація за теорією Бренстеда-Лоурі. Навести приклади.
|
||||
|
Последнее изменение этой страницы: 2016-04-19; просмотров: 1338; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.149.29.98 (0.009 с.) |