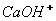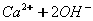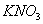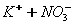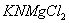Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Теорія електролітичної дисоціації.Содержание книги
Поиск на нашем сайте
Уже відомо, що особливості водних розчинів електролітів пояснив шведський вчений С. Арреніус. Він запропонував теорію електролітичної дисоціації. Основні положення його теорії такі: 1. Електроліти під час розчинення у воді розпадаються на позитивно і негативно зарядженні йони. 2. Позитивно зарядженні йони, які притягуються до катода (негативно зарядженого полюса), називаються катіонами. 3. Негативно зарядженні йони, які притягуються до анода(позитивно зарядженого полюса), називаються аніонами. 4. Дисоціація – процес оборотний. З огляду на положення теорій електролітичної дисоціації, можна скласти рівняння дисоціації кислот, основ, і солей та описати властивості цих класів речовин. Дисоціація кислот. Під час дисоціації розчинних у воді кислот завжди утворюfються йони Гідрогену
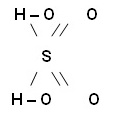
Інші позитивно заряджені йони, крім йонів Гідрогену, підчас дисоціації не утворюються. Щоб краще зрозуміти суть процесу дисоціації слід розглянути структурну формулу кислоти наприклад, сульфатної, та визначити найбільший полярний зв'язок:
У сульфатній кислоті найбільш полярними є зв'язок між Гідрогеном і Оксигеном, отже, у розчині саме він уде розриватися. Зв'язок між Сульфуром та Оксигеном є слабко полярним(різниця електронегативностей дуже мала), отже, при дисоціації він розриватися не буде. Рівняння електролітичної дисоціації сульфатної кислоти виглядає таким чином:
Число йонів Гідрогену, які утворюються під час розчеплення однієї молекули кислоти, визначає її основність. Так
Двох – і багато основні кислоти дисоціюють ступінчасто, тобто поступово відщеплюють Гідрогену, в зв’язку з тим, що Перший ступінь: Другий ступінь: Отже, з точки зору електролітичної дисоціації Арреніуса, кислоти – це електроліти, під час дисоціації яких утворюються катіони Гідрогену та аніони кислотного залишку. Дисоціація основ. Під час дисоціації основ утворюються гідроксид – йони
Для кращого розуміння цього процесу давайте розглянемо структурну формулу кальцій гідроксиду:
У кальцій гідроксиду найбільш полярним є зв'язок між Кальцієм та Оксигеном, отже, у розчині саме він буде розриватися. Зв'язок між Гідрогеном і Оксигеном є слабо полярним (різниця електронегативностей невелика), отже, при дисоціації основ утворюються катіони металів і гідроксид – аніони. До складу Перший ступінь: Другий ступінь: Загальне ж рівняння електролітичної дисоціації основи виглядає таким чином:
З точки зору електролітичної дисоціації, основи – це електроліти, під час дисоціації яких утворюються катіони металічного елемента, та гідроксид аніон ОН.
Дисоціація солей. Під впливом води кристали солей розщеплюються на позитивно заряджені йони металів і негативно заряджені йони кислотних залишків, наприклад:
Розглянемо також, наприклад структурну формулу натрій сульфату:
У натрій сульфаті найбільш полярним є зв'язок між Натрієм та Оксигеном, отже, у розчині саме він буде розриватисяю Зв'язок між Сульфуром та Оксигеном є слабко полярним(різниця електронегативностей дуже мала), отже, при дисоціації вона розриватися не буде. Структурна формула:
Важливим є той момент, що в розчині дисоціюють лише розчинні солі. З точки зору електролітичної дисоціації, солі – це електроліти, під час дисоціації яких утворюються катіони металічного елемента і аніони кислотного залишку.
|
|||||
|
Последнее изменение этой страницы: 2016-04-19; просмотров: 742; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.144.39.40 (0.008 с.) |

 , точніше гідратовані йони Гідрогену
, точніше гідратовані йони Гідрогену  , або
, або  , які називають йонами гідроксонію. Вони зумовлюють найважливіші властивості кислот(кислий смак, дію на індикатори, взаємодію з основами):
, які називають йонами гідроксонію. Вони зумовлюють найважливіші властивості кислот(кислий смак, дію на індикатори, взаємодію з основами):


 ,
,  – одноосновні кислоти,
– одноосновні кислоти, 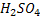 ,
, – двоосновні,
– двоосновні, 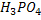 - триосновна.
- триосновна.

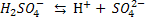
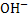 , наявність яких зумовлює основні властивості (зміну забарвлення індикатора, взаємодію з кислотами). Наприклад, розчинні у воді основи (луги) дисоціюють так:
, наявність яких зумовлює основні властивості (зміну забарвлення індикатора, взаємодію з кислотами). Наприклад, розчинні у воді основи (луги) дисоціюють так: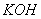


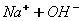

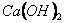 входить дві гідроксильні групи, тому процес дисоціації відбувається ступінчасто:
входить дві гідроксильні групи, тому процес дисоціації відбувається ступінчасто: