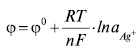Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Електродні потенціали та механізм їх виникнення.Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Різниця потенціалів (стрибок потенціалу), що виникає на межі поділу електрод — розчин, називається електродним потенціалом,це різниця електричних потенціалів між електродом та електролітом, в контакті з яким він знаходиться (найчастіше всього між металом ірозчином електроліту). Наприклад, при зануренні металевої пластинки у розчин власної солі на місці зіткнення металу з розчином виникає стрибок потенціалу, величина і знак якого залежать від хімічної природи металу та від активності його йонів у розчині. Провідник (метал), занурений у розчин електроліту, називається електродом. Різниця потенціалів (стрибок потенціалу), що виникає на межі поділу електрод — розчин, називається електродним потенціалом. Величину електродного потенціалу можна розрахувати за рівнянням Нернста: E = E` + nq ld a, Для Т=298к Е.е. 1-го роду — металеві або газові, занурені у розчин електроліту, що містить іони матеріалу Е.е. Такі Е.е. оборотні до цих іонів. Напр. на срібному Е.е. Ag|Ag+ відбувається потенціалотвірна реакція: AgDAg+ + 1ē. Рівняння Нернста для такого Е.е. має вигляд:
де n — кількість електронів, які беруть участь у реакції; aAg+ — активність іонів срібла у розчині ⱷ — електродний потенціал; ⱷ0-стандартний електродний потенціал (потенціал, який виникає на границі метала з розчином його іонів при концентрації останніх 1 моль/л) R-універсальна газова стала (R =8,31 Дж/(моль. К) T-абсолютна температура n-число електронів, які беруть участь в електрохімічному процесі F-число Фарадея (F= 96 500 Кл); Спільна:
Men+- концентрація іонів металу, моль/л. Стандартний електродний потенціал. Водневий електрод. Стандартний електродний потенціал - це потенціал,який виникає на границі метала з розчином його іонів при концентрації останніх 1 моль/л. Роль електрода порівняння частіше за все відіграє водневий електрод, умовно визначається приймається за нуль… Величина електродного потенціалу залежить від активності речовин-учасників електродного процесу і вимірюється за допомогою рівняння Нернста:
Водневий електрод — відновно-окисний електрод, що береться за основу термодинамічної шкали відновлювально-окисних потенціліалів.Водневий електрод являє собою платинову пластинку, покриту платиновою черню, занурену в розчин кислоти активність іонів Н+ у якому дорівнює 1 моль/л.
Електроди порівняння а) Хлорсрібний електрод (Аg | АgCl, КСl) Хлорсрібний електрод можна приготувати, наприклад, покривши анод зі срібного дроту арґентум (І) хлоридом методом електролізу 0,1М розчину хлориду.Дріт, покритий арґентум (І) хлоридом, занурюють у розчин КСl з відомоюконцентрацією. Найчастіше це насичений розчин 3,8 М, іноді 1,0 М чи 0,1 М.Потенціал хлорсрібного електрода виникає в результаті напівреакції: АgСl (тв.) + е ↔ Аg(тв.) + Сl Хлорсрібний електрод – найбільш відтворюваний електрод порівняння з доброю електричною і хімічною стабільністю за 25°С. Потенціал електрода залежить від усіх компонентів розчину, що впливають на концентрацію іонів аргентуму. Тому його не можна використовувати без додаткового сольового містка в розчинах, що містять білки,бромід- чи сульфід-іони, що утворюють нерозчинні сполуки з іонами аргентуму, а також у присутності лігандів, взаємодіючих з АgСl, таких як CN-, SCN-, і сильнихокисників чи відновників. Температурний коефіцієнт хлорсрібного електрода дуже малий. Завдяки цьому він зручний у тих випадках, коли неможливо підтримувати температуру сталою або за температур вище 80°С. б) Каломельний електрод (Нg | Нg2Сl2, КСl) Каломельний електрод – найпоширеніший електрод порівняння. Каломельнийелектрод складається з платинового дроту, зануреного в пасту з ртуті і меркурій (І)хлориду у скляній трубці. Внутрішнім розчином служить розчин калій хлориду відомої концентрації, насичений меркурій (І) хлоридом.Потенціал каломельного електрода визначається напівреакцією: Нg2С12(тв.) + 2е-↔ 2 Hg(р.) + 2 Сl- і відповідно до рівняння Нернста залежить від концентрації хлорид-іонів: Е = Е0 –0,05916/2*lg [Cl-]2=E0 - 0,05916[Cl-].
|
|||||
|
Последнее изменение этой страницы: 2016-04-19; просмотров: 1710; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.142.54.83 (0.01 с.) |