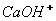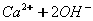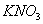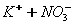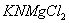Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Поянити механізм утворення ковалентного полярного зв'язку на прикладі хлороводню. Характеристики ковалентного полярного зв'язку: енергія, довжина, полярність.Содержание книги
Поиск на нашем сайте
Частина 1 Поянити механізм утворення ковалентного полярного зв'язку на прикладі хлороводню. Характеристики ковалентного полярного зв'язку: енергія, довжина, полярність.
Ковалентний зв'язок виникає між атомами неметалічних елементів завдяки утворенюю між атомами однієї або кількох спільних електронних пар. У разі полярного ковалентного зв’язку електронна хмара зв’язку зміщена в бік атома з більшою відносною електронегативністю. Утворення молекули НСl можна зобразити схемою
Електронна пара зміщена в бік атома хлору, оскільки відносна електронегативність атома хлору (2,83) більша, ніж атома гідрогену (2,1). Довжина зв'язку - це відстань між центрами ядер атомів, які утворюють зв'язок. Чим вища кратність зв'язку, тим менша довжина зв'язку. Енергія зв'язку - це енергія, яку потрібно затратити, щоб зруйнувати зв'язок, або енергія, яка виділяється при утворенні зв'язку. Що вища кратність, то більша енергія. Полярність зв'язку визначається асиметричністю розподілу спільної електронної хмари відносно ядер атомів, що утворюють зв'язок. Щільність електронної хмари зміщується в бік більш електронегативного елемента внаслідок чого молекула стає полярною. Пояснити механізм утворення йонного зв'язку на прикладі хлориду натрію. Характеристика йонного зв'язку. Йонний зв'язок виникає між металічними і неметалічними елементами. Атоми металічних елементів віддають електрони і перетворюються на позитивно заряджені йони - катіони. Атоми неметалічних елементів приєднують електрони і перетворюються на негативно заряджені йони - аніони. Так при утворенні сполуки натрій хлориду атом Натрія віддає електрони атома Хлору. Пояснити механізм утворення водневого зв'язку на прикладі води. Характеристика водневого зв'язку. Водневий зв’язок виникає внаслідок електростатичної взаємодії між атомом Гідрогену, що має частково позитивний заряд, та атомами з неподіленими парами електронів. (Що мають велику електронегативність F, N, O) Особливо великий вплив має водневий зв’язок на властивості води. Це є наслідком того, що в кожній молекулі води є два протони, які можуть брати участь в утворенні двох водневих зв’язків. Щоб відірвати їх одна від одної, потрібна порівняно велика енергія. Цим пояснюється надзвичайно висока температура кипіння води. Класифікація біогенних елементів за вмістом в організмі людини. Навести приклад. Органогенні елементи. Біогенні елементи, масова частка яких перевищує 0,01 % маси тіла, належать до макроелементів. До них віднесено 12 елементів: органогени (С, Н, О, И, Р, S), йони електролітів (Na, К, Са, Мg, СІ) і Ферум. Вони становлять 99,99 % живого субстрату. Біогенні елементи, сумарний уміст яких становить близько 0,01 %, відносять до мікроелементів. За вмістом у організмі: макроелементи (>0,01% маси тіла) – О(62%), С(21%), Н(10%), N(3%), Са2+(2%), Р(1%), К+(0,23%), S(0,16%), олігобіогенні Сl-(0,1%), Nа+(0,08%), Мg2+(0,027%), Fе2+(0,01%); мікроелементи (10-3-10-5% маси тіла) – Zn2+, Сu2+, Со2+, Вr-, І-, Мn2+, V+5, Мо+6, В+3, Сr3+, Сs+, Sі+4, Аl3+, Ва2+; ультрамікроелементи: (<10-5% маси тіла) – Ве2+, Аg+, Nі2+, Gа+3, Gе+4, Аs+5, Нg2+, Ві+5, Sе+6, Sb+5, Органогенні елементи – це перша група хімічних елементів живих організмів (кисень, водень, вуглець, азот). Приклад: Кисень є життєво важливим для всіх живих організмів (виняток становлять анаеробні бактерії). Він бере участь у процесах дихання. Крізь легені кисень потрапляє у кров, розноситься з нею по всьому організму і в клітинах забезпечує перебіг реакції окислення. Реакції окиснення відбуваються і в рослинах, які також поглинають кисень під час дихання. Властивості та біологічна роль деяких d-елементів (Ферум, Манган, Купрум, Цинк) Ферум. Даний елемент відноситься до групи життєво необхідних. Йони Феруму (ІІ) та Феруму (ІІІ) мають важливе значення для життєдіяльності організму людини. Вони необхідні для процесів кровотворення, нормальної діяльності багатьох ферментів, перенесення кисню від легень до тканин, а також електронів у ланцюзі дихання. Біологічна роль Мангану обумовлена здатністю утворювати метало комплекси з білками, нуклеїновими кислотами АТФ, АДФ та амінокислотами. Манган впливає на дію ферментів, гормонів, вітамінів (В, Е) та інші функції організму, а саме: жировий, білковий, вуглеводний обміни, приймає участь у синтезі аскорбінової кислоти. Манган здійснює специфічний вплив на процеси розмноження, позитивно впливає на ріст та розвиток. Великий вплив Манган здійснює на мінеральний обмін. Цинк впливає на активність тропних гормонів гіпофізу, бере участь в реалізації біологічних функцій інсуліну, нормалізуючи жировий обмін. Цинк бере участь у кровотворенні, а також необхідний для нормального функціонування гіпофіза, підшлункової залози, сім'яних міхурів. Купрум. Даний елемент відноситься до групи життєво необхідних, відіграє виключно важливу біологічну роль у всіх процесах, що протікають в організмі людини. Значення комплексних сполук в біологічних системах. Хлорофіл - це комплексне з'єднання магнію з порфіринами, гемоглобін містить комплекс заліза (II) з порфіриновими циклами. Значна кількість лікарських препаратів містить комплекси металів як фармакологічно активних речовин, наприклад інсулін (комплекс цинку), вітамін B12 (комплекс кобальту), платінол (комплекс платини) Пояснити суть електролітичної теорії Арреніуса на прикладі солі(натрію хлориду),сульфатної кислоти та барій гідроксиду. Дисоціація кислот. Під час дисоціації розчинних у воді кислот завжди утворюfються йони Гідрогену
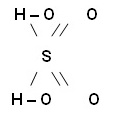
Інші позитивно заряджені йони, крім йонів Гідрогену, підчас дисоціації не утворюються. Щоб краще зрозуміти суть процесу дисоціації слід розглянути структурну формулу кислоти наприклад, сульфатної, та визначити найбільший полярний зв'язок:
У сульфатній кислоті найбільш полярними є зв'язок між Гідрогеном і Оксигеном, отже, у розчині саме він уде розриватися. Зв'язок між Сульфуром та Оксигеном є слабко полярним(різниця електронегативностей дуже мала), отже, при дисоціації він розриватися не буде. Рівняння електролітичної дисоціації сульфатної кислоти виглядає таким чином:
Число йонів Гідрогену, які утворюються під час розчеплення однієї молекули кислоти, визначає її основність. Так
Двох – і багато основні кислоти дисоціюють ступінчасто, тобто поступово відщеплюють Гідрогену, в зв’язку з тим, що Перший ступінь: Другий ступінь: Отже, з точки зору електролітичної дисоціації Арреніуса, кислоти – це електроліти, під час дисоціації яких утворюються катіони Гідрогену та аніони кислотного залишку. Дисоціація основ. Під час дисоціації основ утворюються гідроксид – йони
Для кращого розуміння цього процесу давайте розглянемо структурну формулу кальцій гідроксиду:
У кальцій гідроксиду найбільш полярним є зв'язок між Кальцієм та Оксигеном, отже, у розчині саме він буде розриватися. Зв'язок між Гідрогеном і Оксигеном є слабо полярним (різниця електронегативностей невелика), отже, при дисоціації основ утворюються катіони металів і гідроксид – аніони. До складу Перший ступінь: Другий ступінь: Загальне ж рівняння електролітичної дисоціації основи виглядає таким чином:
З точки зору електролітичної дисоціації, основи – це електроліти, під час дисоціації яких утворюються катіони металічного елемента, та гідроксид аніон ОН.
Дисоціація солей. Під впливом води кристали солей розщеплюються на позитивно заряджені йони металів і негативно заряджені йони кислотних залишків, наприклад:
Розглянемо також, наприклад структурну формулу натрій сульфату:
У натрій сульфаті найбільш полярним є зв'язок між Натрієм та Оксигеном, отже, у розчині саме він буде розриватисяю Зв'язок між Сульфуром та Оксигеном є слабко полярним(різниця електронегативностей дуже мала), отже, при дисоціації вона розриватися не буде. Структурна формула:
Важливим є той момент, що в розчині дисоціюють лише розчинні солі. З точки зору електролітичної дисоціації, солі – це електроліти, під час дисоціації яких утворюються катіони металічного елемента і аніони кислотного залишку. H2PO4-/HPO42- (б) слабка основа і спряжена до неї кислота (аміачний) NН 3/NH4+
(в) солі багатоосновних слабких кислот(фосфатна, гідрогенкарбонатна) (г) іони та молекули амфолітів (білкова)
Частина 2 Види термохімічних реакцій. Реакції бувають: Екзотермічні (з виділенням теплоти) і Ендотермічні (з поглинанням теплоти) Термохімічне рівняння – хімічне рівняння,в якому зазначено агрегатний стан речовин і тепловий ефект реакції: C(т)+O2(г)=СО2(гг)+Q кДж Значення теплового ефекту відносять до того числа молів вихідних речовин та продуктів реакції,яке відповідає стехіометричним коефіцієнтам. В термохімічних рівняннях зазначають агрегатний стан речовин: Стехіометрична кількість – це кількість речовин,взятих в співвідношеннях пропорційних коефіцієнтам реакції. Закон Гесса. Тепловий ефект не залежить від шляху протікання хімічних реакцій,тобто від кількості стадій. Стандартна теплота утворення – це тепловий ефект реакції утворення 1 моля складної речовини з простих речовин,взятих в стійких алотропних модифікаціях за стандартних умов. Стандартна теплота згортання – це тепловий ефект реакції окиснення даної сполуки киснем за стандартних умов із утворенням вищих оксидів елементів,що входять до складу цієї сполуки.
4. Наслідки з закону Гесса. Розрахунок ΔН реакції за стандартними теплотами утворення і згорання речовини. 2Наслідок: Якщо здійснюється дві реакціі з різними початковими станами,результатом яких є однаковий кінцевий стан,то різниця між їх тепловими ефектами являє собою тепловий ефект переходу з одного початкового стану в інший 3 Наслідок: дві реакціі з різних початкових положень до однакового кінцевого положення дають різницю теплоти,яка дорівнює теплоті реакціі переходу з одного початкового положення в друге 5. Дати визначення 2-го закону термодинаміки. Поняття про ентропію та енергію Гіббса. Їх використання для інтерпретації самочинності процесів.
6. Прогнозування направлення самодовільних процесів. Екзергонічні та ендергоічні процеси, які відбуваються в організмі. 7. Дати визначення макроергічним сполукам. Гідроліз АТФ. Характеристика макроергічних зв’язків. АДФ + H2O → АМФ + H3PO4 + енергія Порядок реакції. Порядок реакції — це важлива кінетична характеристик, величина формальна й дорівнює сумі показників степенів у кінетичному рівнянні. Для визначення загального порядку реакції необхідно спочатку встановити порядок реакції за кожною реагуючою речовиною.. Для визначення порядку реакції за даною речовиною необхідно створити такі умови, щоб в процесі реакції змінювалася концентрація тільки даної речовини. Для цього концентрації всіх інших учасників повинні бути настільки великими, щоб зміною їх в часі можна було знехтуватиЗі співвідношення загальний порядок n даної реакції дорівнює n = nA + nB + nD. При цьому величини nA, nB, nD називаються приватними порядками реакції за речовинами А, В і D. Отже, загальний порядок реакції n дорівнює сумі приватних порядків. Для елементарних реакцій nA = a, nB = b, nD = d.
З точки зору хімічної кінетики всі елементарні реакції можна класифікувати на реакції нульового, першого, другого та третього порядків. Реакції нульового порядку – це реакції, які проходять при надлишку реагентів так, що змінювання концентрації не впливає на швидкість реакції. Реакції нульового порядку. Трапляються рідко. Прикладом таких є реакція розкладання N2O5 у газовій фазі за наявності твердого N2O5, коли постійна концентрація реагенту в газовій фазі підтримується сталою за рахунок випарювання твердого оксиду. у реакціях нульового порядку концентрація лінійно зменшується з часом. Реакції першого порядку. відмітна ознака реакцій першого порядку- період напівперетворення не залежить від початкової концентрації реагенту. До елементарних реакцій першого порядку належать такі, які можна подати у вигляді А--- продукти. Частіше за все це реакції розкладання. Наприклад, реакція розкладання ацетону. Класичним прикладом реакції першого порядку є реакція інверсії тростинного цукру До істинно молекулярних або, краще сказати, моноатомних процесів першого порядку відносять усі численні перетворення радіоактивних речовин. Реакції другого порядку. Такі проходять за участі двох частинок (молекул, атомів) А1 + А2 продукти, причому концентрації речовин А1 та А2 різні
Pеакціі другого порядку бувають двох типів: у одному випадку реагують один з одним дві молекули одного і того ж речовини, а в іншому - дві молекули різних речовин. Реакцій другого порядку багато. Наприклад: Утворення йодоводню у газовій фазі, або його розклад Н2 + І2(пар) 2HI, 2HI H2 + I2 (пар),
Омилення естеру лугом: CH3COOC2H5+NaOH=CH3COONa+C2H5OH Розклад нітроген оксиду: 2NO2= 2NO+O2 Хімічна рівновага. Хімічна рівновага називається такий стан системи, при якому концентрації всіх речовин залишаються незмінними, а швидкості прямої та зворотьною реакціїї є однакові Стан хімічної рівноваги зберігається до тих пір, доки залишаються незмінними умови реакції: концентрація, температура і тиск. Багато хімічних продуктів отримують в результаті оборотних хімічних реакцій. Тому необхідно знати, за яких умов в стані рівноваги вихід продукту збільшується. Багаточисельні дослідження показали, що зсув хімічної рівноваги підкоряється правилу, названому принципом Ле - Шателье: Електроди порівняння а) Хлорсрібний електрод (Аg | АgCl, КСl) Хлорсрібний електрод можна приготувати, наприклад, покривши анод зі срібного дроту арґентум (І) хлоридом методом електролізу 0,1М розчину хлориду.Дріт, покритий арґентум (І) хлоридом, занурюють у розчин КСl з відомоюконцентрацією. Найчастіше це насичений розчин 3,8 М, іноді 1,0 М чи 0,1 М.Потенціал хлорсрібного електрода виникає в результаті напівреакції: АgСl (тв.) + е ↔ Аg(тв.) + Сl Хлорсрібний електрод – найбільш відтворюваний електрод порівняння з доброю електричною і хімічною стабільністю за 25°С. Потенціал електрода залежить від усіх компонентів розчину, що впливають на концентрацію іонів аргентуму. Тому його не можна використовувати без додаткового сольового містка в розчинах, що містять білки,бромід- чи сульфід-іони, що утворюють нерозчинні сполуки з іонами аргентуму, а також у присутності лігандів, взаємодіючих з АgСl, таких як CN-, SCN-, і сильнихокисників чи відновників. Температурний коефіцієнт хлорсрібного електрода дуже малий. Завдяки цьому він зручний у тих випадках, коли неможливо підтримувати температуру сталою або за температур вище 80°С. б) Каломельний електрод (Нg | Нg2Сl2, КСl) Каломельний електрод – найпоширеніший електрод порівняння. Каломельнийелектрод складається з платинового дроту, зануреного в пасту з ртуті і меркурій (І)хлориду у скляній трубці. Внутрішнім розчином служить розчин калій хлориду відомої концентрації, насичений меркурій (І) хлоридом.Потенціал каломельного електрода визначається напівреакцією: Нg2С12(тв.) + 2е-↔ 2 Hg(р.) + 2 Сl- і відповідно до рівняння Нернста залежить від концентрації хлорид-іонів: Е = Е0 –0,05916/2*lg [Cl-]2=E0 - 0,05916[Cl-]. Правило Дюкло-Траубе Збільшення довжини ланцюга в даному гомологічному ряду на одну -CH2- групу викликає зростання поверхневої активності речовини в 3-3,5 раза. Йонообмінна адсорбція. Йонообмінна адсорбція Сильні електроліти у водних розчинах (навіть в конц ентрованих) дисоціюють практично повністю і тому присутні виключно у вигляді іонів. Отже, ці частинки і будуть поглинатися твердим адсорбентом, тому даний вид адсорбції називається йонною. Йонна адсорбція є більш складним явищем, ніж молекулярна. Для неї істотне значеннямає природа адсорбенту, оскільки йони можуть адсорбуватися лише на заряджених поверхнях, утворених йонами або полярними молекулами. Причому, напозитивно заряджених ділянках поверхні адсорбуються з розчину аніони, а на негативно заряджених - катіони.
Адсорбенти, здатні обмінюватися з розчином відповідними іонами, називаються йонітами.Це найчастіше тверді природніабо синтетичні речовини, що мають як неорганічну, так і органічну природу, і практично нерозчинні у воді і органічних розчинниках, але зате здатні до обмеженого набухання у рідинах. Іоніти широко використовуються для зменшення твердості води та її знесолювання, для виділення і розділення неорганічних і органічних йонів. Йонний обмін використовують у шкіряній, гідролізній, фармацевтичній промисловості для очищення розчинів, для видалення солей з молока, цукру, вин. За допомогою іонітів вловлюють йони цінних елементів з природних розчинів і відпрацьованих вод різних виробництв.
Хроматографія. Хроматогра́фія — високоефективний фізико-хімічний метод розділення і аналізу, в якому речовина розподіляється між двома фазами: рухомою і нерухомою. Класифікація хроматографічних методів Варіанти хроматографії за фазовим станом [ · Газова хроматографія (використовується наприклад для визначення якості харчового спирту) · Рідинна хроматографія (використовується для аналізу та виділення органічних сполук) · Хроматографія над критичними рідинами/газами (рідкісний вид, проміжний між першими двома. Найчастіше використовують як елюєнт вуглекислий газ під високим тиском та підвищених температурах) · Газо-рідинна хроматографія · Газо-твердофазна хроматографія Високомолекулярні сполуки ВИСОКОМОЛЕКУЛЯРНІ СПОЛУКИ (ВМС), або полімери — сполуки з молекулами від декількох тисяч до багатьох мільйонів.Складаються з мономерів. За походженням їх поділяють на природні(білки) і синтетичні(поліетилен), за структурою полімерного ланцюга: лінійні, розгалужені і сітчасті.За хімічним складом макромолекули розрізняють гомополімери і співполімери. Частина 1 Поянити механізм утворення ковалентного полярного зв'язку на прикладі хлороводню. Характеристики ковалентного полярного зв'язку: енергія, довжина, полярність.
Ковалентний зв'язок виникає між атомами неметалічних елементів завдяки утворенюю між атомами однієї або кількох спільних електронних пар. У разі полярного ковалентного зв’язку електронна хмара зв’язку зміщена в бік атома з більшою відносною електронегативністю. Утворення молекули НСl можна зобразити схемою
Електронна пара зміщена в бік атома хлору, оскільки відносна електронегативність атома хлору (2,83) більша, ніж атома гідрогену (2,1). Довжина зв'язку - це відстань між центрами ядер атомів, які утворюють зв'язок. Чим вища кратність зв'язку, тим менша довжина зв'язку. Енергія зв'язку - це енергія, яку потрібно затратити, щоб зруйнувати зв'язок, або енергія, яка виділяється при утворенні зв'язку. Що вища кратність, то більша енергія. Полярність зв'язку визначається асиметричністю розподілу спільної електронної хмари відносно ядер атомів, що утворюють зв'язок. Щільність електронної хмари зміщується в бік більш електронегативного елемента внаслідок чого молекула стає полярною.
|
||||
|
Последнее изменение этой страницы: 2016-04-19; просмотров: 1818; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 52.15.92.58 (0.011 с.) |


 , точніше гідратовані йони Гідрогену
, точніше гідратовані йони Гідрогену  , або
, або  , які називають йонами гідроксонію. Вони зумовлюють найважливіші властивості кислот(кислий смак, дію на індикатори, взаємодію з основами):
, які називають йонами гідроксонію. Вони зумовлюють найважливіші властивості кислот(кислий смак, дію на індикатори, взаємодію з основами):


 ,
,  – одноосновні кислоти,
– одноосновні кислоти, 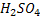 ,
, – двоосновні,
– двоосновні, 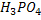 - триосновна.
- триосновна.

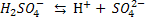
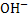 , наявність яких зумовлює основні властивості (зміну забарвлення індикатора, взаємодію з кислотами). Наприклад, розчинні у воді основи (луги) дисоціюють так:
, наявність яких зумовлює основні властивості (зміну забарвлення індикатора, взаємодію з кислотами). Наприклад, розчинні у воді основи (луги) дисоціюють так: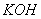


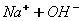

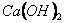 входить дві гідроксильні групи, тому процес дисоціації відбувається ступінчасто:
входить дві гідроксильні групи, тому процес дисоціації відбувається ступінчасто: