Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
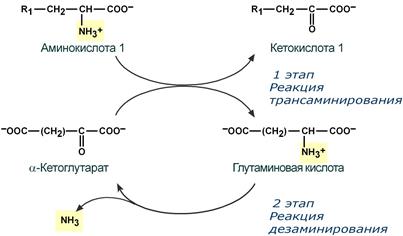
Схема реакции трансаминированияСодержание книги
Поиск на нашем сайте
В результате трансаминирования свободные аминокислоты теряют α-NH2-группы и превращаются в соответствующие кетокислоты. Далее их кетоскелет катаболизирует специфическими путями и вовлекается в цикл трикарбоновых кислот и тканевое дыхание, где сгорает до СО2 и Н2О. При необходимости (например, голодание) углеродный скелет глюкогенных аминокислот может использоваться в печени для синтеза глюкозы в глюконеогенезе. В этом случае количество аминотрансфераз в гепатоците увеличивается под влиянием глюкокортикоидов. Второй этап состоит в отщеплении аминогруппы от аминокислоты 2 – дезаминирование. Т.к. в организме коллектором всех аминокислотных аминогрупп является глутаминовая кислота, то только она подвергается окислительному дезаминированию с образованием аммиака и α-кетоглутаровой кислоты. Этот этап осуществляется глутаматдегидрогеназой (перейти вверх к ее реакции), которая имеется в митохондриях всех клеток организма, кроме мышечных. Учитывая тесную связь обоих этапов, непрямое окислительное дезаминирование называют трансдезаминирование.
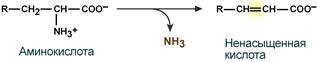
Схема обоих этапов трансдезаминирования Если реакция прямого дезаминирования идет в митохондриях печени, аммиак используется для синтеза мочевины, которая в дальнейшем удаляется с мочой. В эпителии канальцев почек реакция необходима для удаления аммиака в процессе аммониегенеза. Так как НАДН используется в дыхательной цепи и α-кетоглутарат вовлекается в реакции ЦТК, то реакция активируется при дефиците энергии и ингибируется избытком АТФ и НАДН. Роль трансаминирования и трансдезаминирования Реакции трансаминирования: · активируются в печени, мышцах и других органах при поступлении в клетку избыточного количества тех или иных аминокислот – с целью оптимизации их соотношения, · обеспечивают синтез заменимых аминокислот в клетке при наличии их углеродного скелета (кетоаналога), · начинаются при прекращении использования аминокислот на синтез азотсодержащих соединений (белков, креатина, фосфолипидов, пуриновых и пиримидиновых оснований) – с целью дальнейшего катаболизма их безазотистого остатка и выработки энергии, · необходимы при внутриклеточном голодании, например, при гипогликемиях различного генеза – для использования безазотистого остатка аминокислот в печени для кетогенеза и глюконеогенеза, в других органах – для его прямого вовлечения в реакции цикла трикарбоновых кислот. При патологиях (сахарный диабет 1 типа, гиперкортицизм) реакции трансаминирования обусловливают появление субстратов для глюконеогенеза и способствуют патологической гипергликемии. Продукт трансаминирования глутаминовая кислота: · является одной из транспортных форм аминного азота в гепатоциты, · способна реагировать со свободным аммиаком, обезвреживая его (синтез глутамина). Процесс трансдезаминирования идет в организме непрерывно, потому что: · сопряженные реакции трансаминирования и дезаминирования создают поток лишнего аминного азота из периферических клеток в печень для синтеза мочевины и в почки для синтеза аммонийных солей. Превращение аминокислот с участием NH 2 -группы сводится к ее отщеплению от углеродного скелета в реакции дезаминирования. Виды дезаминирования · внутримолекулярное – с образованием ненасыщенной жирной кислоты:
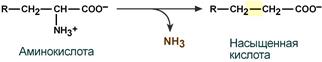
· восстановительное с образованием насыщенной жирной кислоты:
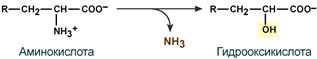
· гидролитическое – с образованием карбоновой гидроксикислоты:
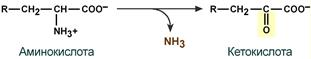
· окислительное с образованием кетокислот:
У человека окислительное дезаминирование является основным путем катаболизма аминокислот. Не все аминокислоты подвергаются окислительному дезаминированию. Гистидин теряет аминогруппу с использованием внутримолекулярного дезаминирования, а треонин и серин сразу подвергаются прямому расщеплению до глицина и ацетальдегида (треонин) или до глицина и гидроксиметила (серин).
|
||||
|
Последнее изменение этой страницы: 2021-07-18; просмотров: 91; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.139.72.210 (0.007 с.) |