Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Реакции глюкозо-аланинового цикла (выделен рамкой).
Реакции, связанные с транспортными формами аммиака Целевыми органами для транспорта аммиака являются печень, почки и кишечник. В печени: a. аспарагин и глутамин дезаминируются соответственно аспарагиназой и глутаминазой, образующийся аммиак используется для синтеза мочевины, b. аланин вступает в реакции трансаминирования с α-кетоглутаратом, c. глутаминовая кислота подвергается окислительному дезаминированию. В кишечнике часть глутамина дезаминируется глутаминазой. После этого образованный аммиак выделяется в просвет кишечника (не более 5%) или через кровь воротной вены уходит в печень, а глутамат вступает в трансаминирование с пируватом, в результате чего аминоазот переходит на аланин и с ним также поступает в печень, В почках идет образование аммонийных солей с использованием глутамата, глутамина и аспарагина. Судьба углеводородного скелета аминокислот. Глюкопластические и кетопластические аминокислоты. Углеродные скелеты аминокислот, образующиеся при дезаминировании аминокислот могут использоваться в клетках по различным направлениям. 1- Они могут использоваться в качестве субстратов для глюконеогенеза (синтез глюкозы из неуглеводных предшественников) 2- Превращение углеродных скелетов в ацетоновые тела 3- Окисление до углекислого газа и воды 4- Использование углеродного скелета для ресинтеза аминокислот. Первые три направления могут быть прослежены на данной схеме. Углеродные остовы аминокислот серина, глицина, треонина, цистиина, аланина превращаются в пируват, далее карбоксилируются с образованием оксалоацетата. Углеродные скелеты аспартата и аспаргина за счет дезаминирования превращаются в ЩУК. Пролин, гистидин, глютомат, глютамин, валин, изолейцин, метионин превращаются в промежуточные продукты цикла Кребса и то же могуть превращаться в оксалоацетат, который за счет активного фермента может давать фосфоэнолпируват, в связи с обратимостью реакций гликолиза из него могут, при наличии энергии, синтезироваться молекулы глюкозы. Поэтому эти аминокислоты получили название гликогенных или глюкопластических. Аминокислота, которая при распаде дает любое промежуточное соединение гликолиза или цикла Кребса может использоваться в клетке для синтеза глюкозы. Глюкозы мы синтезируем в сутки до 120 грамм - это интенсивный синтез, причем синтез идет в основном за счет углеродного скелета аминокислот.
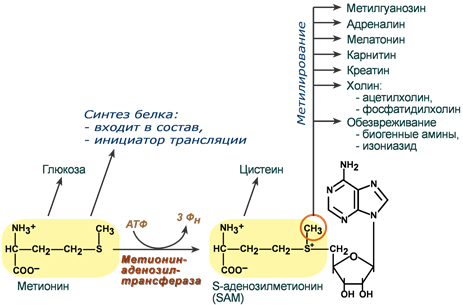
Хотя следует отметить, что часть углеродного скелета фенилаланина и тирозина превращается в фумаровую кислоту и может использоваться для синтеза глюкозы, т.е. эти аминокислоты (их скелеты) являются аминокислотами со смешанными функциями: часть может давать глюкозу, часть ацетоновые тела. По сути кетопластическими являются лейцин, лизин и триптофан. Углеродные остовы как глюко-, так и кетопластических аминокислот могут окисляться до углекислого газа и воды в цикле Кребса. Особенности обмена серусодержащих аминокислот. Роль метионина Метионин является серусодержащей незаменимой аминокислотой, несущей ряд уникальных функций. Первая функция заключается в инициации синтеза белка(трансляция). Взаимодействие метионина с первым кодоном мРНК является необходимым для создания первой пептидной связи будущего белка. Вторая функция метионина основана на наличии в его структуре реакционноспособной метильной группы. Для того, чтобы ее активировать, к метионину присоединяется остаток аденозина и образуется S-аденозилметионин (SAM). В результате реакций метаболизма эта метильная группа переносится на ряд субстратов. При этом образуются адреналин, мелатонин, креатин, карнитин, холин, фосфатидилхолин, гликозаминогликаны. Также S-аденозилметионин необходим для формирования 7-метилгуанозина ("кэпа" на матричной РНК) – структуры, защищающей мРНК от преждевременного разрушения.
|
|||||
|
Последнее изменение этой страницы: 2021-07-18; просмотров: 99; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.145.173.112 (0.006 с.) |