
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Заболевания экстрапирамидной нервной системы. ПаркинсонизмСодержание книги
Поиск на нашем сайте
Генуинный паркинсонизм и вторичный паркинсонизм (симптоматический) – это группа хронических прогрессирующих нейродегенеративных заболеваний, которая характеризуется преимущественной деструкцией допамин-содержащих нейронов черной субстанции, ведущей к нарушению деятельности базальных ганглиев головного мозга. Заболевание названо по имени Джеймса Паркинсона (James Parkinson), описавшего симптомы болезни в своей книге "Эссе о дрожательном параличе" (An essay on the shaking palsy) в 1817. ЭПИДЕМИОЛОГИЯ ПАРКИНСОНИЗМА Среди дегенеративных заболеваний ЦНС болезнь Паркинсона стоит на втором месте по частоте встречаемости после болезни Альцгеймера. Риск развития паркинсонизма в течение жизни составляет 1:40, причем в последние десятилетия наблюдается неуклонный рост заболеваемости. Болезнь Паркинсона значительно больше распространена в Европе, чем в Азии и Африке. В средних широтах Европы уровень заболеваемости составляет 1% среди взрослого населения в возрасте до 60 лет, от 60 до 80 лет– 5-10% и старше 80 лет – свыше 20%. Однако, в настоящее время отмечается «омоложение» заболевания и появление «раннего паркинсонизма» с дебютом болезни в 40-50 лет, а также наличием «ювенильного паркинсонизма» - до 40 лет. Классификация паркинсонизма I. Первичный (генуинный или идиопатический) · Болезнь Паркинсона · Ювенильный паркинсонизм II. Вторичный паркинсонизм (симптоматический): · Сосудистый · При наличии объемных образований головного мозга. · Травматический (при повторных черепно-мозговых травмах) · Лекарственный o блокаторы бета1-адренорецепторов (резерпин) o антидепрессанты (селективные ингибиторы обратного захвата серотонина) o антогонисты дофамина (метоклопрамид, проклоперазин) o противоопухолевые (винкристин) o антипсихотические (бутерофеноны, фенотиазины) o блокаторы кальциевых каналов o вальпроаты · Токсический o пестициды, гербициды, o соединения марганца o наркотический препарат, содержащий вещество МФТП (1-метил-4-фенил 1,2,3,6-тетрагидропиридин) o оксид углерода o цианиды o нефтепродукты. · Инфекционный o постэнцефалитический o болезнь Крейтцфельдта-Якоба и др. · Метаболический o гипо- и гипертироидизм, o гипо- и гиперпаратироидизм III. Паркинсонизм в сочетании с другими нейродегенеративными нарушениями – «плюс паркинсонизм»:
· Болезнь Альцгеймера · Кортико-базальная дегенерация · Стриато-нигральная и паллидо-нигральная дегенерация · Прогрессивный супрануклеарный паралич (синдром Стила-Ричардсона-Ольшевского) · Мультисистемная атрофия: o Оливопонтоцеребеллярная атрофия o Синдром Шая-Дреджера Этиология Этиология идиопатического паркинсонизма до конца не известна. В настоящее время развитие заболевания связывают как с наличием генетической предрасположенности, так и влиянием факторов окружающей среды. К факторам риска относят: · отягощенный семейный анамнез (10-24% случаев); · пожилой возраст (менее 10 случаев на 100 000 в 50 лет и 200 на 100 000 в возрасте 80 лет); · пол (в 1,5 раза чаще страдают мужчины) Генетическая предрасположенность определяется наличием ряда генов и генных локусов с доминантным и рецессивным типом наследования и различной степенью пенетрантности: · ген PRKN (паркин), локус PARK2 на хромосоме 6q25.2-27; · ген LRRK2 (дардарин), локус PARK8 на хромосоме 12p11.2; · ген SNCA (a-синуклеин), локус PARK1 на хромосоме 4q21; · ген GBA (глюкоцереброзидаза) в локусе 1q21. Патогенез Патогенез заболевания связан с недостаточностью дофаминергической системы мозга, его нигро-стриарного пучка, основным медиатором которого является дофамин. Происходит повреждение нигральных дофаминергических нейронов, приводящее к резкому снижению концентрации дофамина в полосатом теле и значимым изменениям его функционального состояния. При этом относительно или абсолютно повышается активность холинергической системы. Показано, что в субталамическом ядре (nSTh) нарушаются процессы торможения, что приводит к патологической возбудимости внутреннего сегмента globus pallidus (Gpi) и pars reticulata черной субстанции (SNpr). Нарушение нормальных взаимодействий в системе Gpi- nSTh-SNpr приводят к развитию основных симптомов болезни. В базальных ганглиях больных паркинсонизмом (в хвостатом ядре, скорлупе, бледном шаре) снижено содержание не только дофамина, но и других биогенных аминов: норадреналина и серотонина, снижена активность тирозингидроксилазы. Наблюдаются значительные изменения норадренергической, холинергической, серотонинергической нейротрансмиссии. Происходит гибель дофаминовых рецепторов неостриатума (преимущественно рецепторы Д-2 типа). В патологический процесс вовлекаются и другие нейропептиды (ацетилхолин, ГАМК, энкефалины). Таким образом, при паркинсонизме дисбаланс одного медиатора (дофамина) приводит к патологическому нарушению многих медиаторов и дезорганизации деятельности всего головного мозга и экстрапирамидной системы прежде всего. Дисфункция дофаминергической системы обуславливает развитие двигательных, эмоциональных и психических расстройств, норадренергической системы – вегетативных, когнитивных и постуральных, холинергической – когнетивных и психических, глутаматэргической – дискинезий, когнитивных и психических, серотонинэргической - эмоциональных и психических. Важное значение имеют факторы аутоиммунноагрессии, и, как следствие, появление антител к собственным катехоламинам и особенно к дофамину.
Ключевыми патогенетическими процессами, приводящими к гибели меланинсодержащих нигральных нейронов, являются оксидантный стресс, эксайтотоксичность и митохондриальные нарушения. В процессе катаболизма дофамина черной субстанции при участии МАО-В в тканях мозга формируется избыток перекиси водорода и свободных радикалов, которые в свою очередь вызывают перекисное окисление липидов, повреждение мембран и гибель клетки. Гиперактивность глутаматергической иннервации стриатума сопровождается активацией NMDA- рецепторов, избыточным выделением нейротрансмиттера глутамата и повышением внутриклеточной концентрации Са2+, что инициирует генерацию свободных радикалов посредством активации нейронной синтазы NO, которая участвует в образовании оксида азота. Выделяемый в результате этого NO выполняет роль посредника нейротоксического действия глутамата на клетку. Свободные радикалы вызывают перекисное окисление липидов клеточной мембраны и обуславливают развитие митохондриальной дисфункции. Однако, оксид азота оказывает на клетку и прямое цитотоксическое действие, обусловленное образованием пероксинитрита ONOO-, как продукта взаимодействия NO и супероксида аниона – О2--.
Рис. 3 Факторы и процессы, приводящие к гибели клетки. Уменьшение числа меланин-содержащих дофаминергических нейронов компактной части черной субстанции, наличие внутриклеточных эозинофильных, включений (телец Леви) в сохранившихся нейронах является важнейшим признаком болезни Паркинсона. Паталогоанатомические исследования выявляют значительное уменьшение числа пигментированных нейронов черной субстанции среднего мозга по сравнению с нормой (400 000). Тяжесть клинической картины, как правило, прямо пропорционально зависит от количества дофаминергических нейронов черной субстанции. Чем меньше количество нейронов, тем тяжелее клинические проявления заболевания и в первую очередь выраженность брадикинезии. У умерших снижено количество допаминергических нейронов более 90%, первые симптомы болезни появляются при гибели примерно 70%-80% и асимптомное течение наблюдается при гибели 50% нейронов.
Рис. 4. Факторы, влияющие на агрегацию альфа-синуклеина
6. Болезнь Паркинсона. Этиология, патогенез, клиника, диагностика и лечение. Клиника паркинсонизма По преобладанию клинического синдрома выделяют следующие формы болезни: акинетико-ригидная, дрожательная (моносимптомная), акинетическая и смешанная (ригидно-акинетико-дрожательная). На долю смешанных и дрожательных форм приходится примерно 80% случаев. Основными клиническими проявлениями заболевания являются моторные симптомы: тремор, мышечная ригидность, гипокинезия и постуральные нарушения. Тремор при паркинсонизме наблюдается у 75% пациентов и характеризуется низкой частотой колебаний (5-7 Гц). Дрожание, как правило, начинается в кистях или стопах и более выражено в покое (тремор «покоя»). Тремор в дистальных отделах рук представлен в виде характерного движения «счета монет». При прогрессировании заболевания тремор захватывает проксимальные отделы верхних и нижних конечностей, может распространяться на подбородок, губы. При активных движениях паркинсонический тремор уменьшается. Дрожание головы для паркинсонизма не характерено и встречается преимущественно при эссенциальном треморе. Ригидность скелетной мускулатуры («пластический гипертонус») характеризуется равномерным повышением тонуса при пассивных движениях. При этом может выявляться феномен «зубчатого колеса». Из-за преобладания мышечного тонуса в мышцах-сгибателях изменяется поза больного - нарастает сгорбленность (поза «просителя») Характерно развитие гипокинезии вплоть до полной акинезии. При этом снижается спонтанная локомоторная активность, отсутствуют содружественные движения конечностей при ходьбе, затруднена инициация движения (феномен «прилипания»), нарушается точность при выполнении движений. Походка становится «шаркающая» - длина шага укорачивается, стопы при ходьбе не отрываются от пола. Однако спонтанная двигательная активность может восстанавливаться при воздействии психоэмоциональных факторов и стрессовых ситуаций. Для пациентов характерен феномен пропульсии (двигаясь по инерции больному трудно остановиться) и ретропульсии (императивно пятится назад). Гипокинезия в сочетании с гипертонусом приводит к амимии, редкому миганию, изменению речи (тихая монотонная, затухающая)
К немоторным симптомам относятся: интеллектуальные нарушения, расстройства эмоциональной сферы и вегетативные расстройства, проявляющиеся со стороны желудочно-кишечного тракта (запоры, диспепсии), сердечно-сосудистой системы (гипотония, брадикардия), вегетативно-трофические нарушения (сальность и шелушение кожных покровов). Таблица 1. Основные симптомы паркинсонизма Моторные симптомы:
Для оценки тяжести болезни Паркинсона наиболее часто применяется шкала HOEHN, YAHR (1967) в модификации Lindvall (1989) с выделением следующих стадий:
Клиническими критериями диагностики болезни Паркинсона являются: 1. наличие брадикинезии и как минимум еще одного из моторных симптомов 2. асимметричное начало 3. высокая эффективность дофаминэргических средств
Критериями исключения диагноза болезни Паркинсона являются: 1. острое начало и спонтанный регресс симптомов 2. быстрое прогрессирование 3. раннее развитие постуральных расстройств (1-4-й год заболевания) и тяжелых бульбарных, вегетативных и когнитивных расстройств (2-3-й год заболевания) 4. мозжечковые и пирамидные знаки Лечение паркинсонизма должно носить комплексный характер. Можно выделить несколько направлений: фармакотерапия, хирургические методы лечения, клеточная и генная терапия.
Так как патогенез заболевания связан с дисбалансом нейромедиаторов, обусловленный в первую очередь снижением активности дофаминергических систем и активацией холинергических систем, основные подходы фармакотерапии направлены на их коррекцию.
Для дофаминэргической системы применяют ДОФА-содержащие средства, производные аминоадамантана, ингибиторы моноаминоксидазы (МАО) типа В, ингибиторы катехол-О- метилтрансферазы (КОМТ) и агонисты дофаминовых рецепторов.
Дофа - содержащие препараты
Нативный дофамин не проходит через гематоэнцефалический барьер, поэтому для заместительной терапии применяют метаболический предшественник дофамина - леводопу (левовращающий стереоизомер дезокси-фенил-аланин), которая проходит через гематоэнцефалический барьер и в дофаминергических нейронах под действием церебральной ДОФА-декарбоксилазы (ДДК) превращается в дофамин.
Для предупреждения периферических симпатических реакций комбинацию леводопы с ингибиторами периферической L-ДДК (карбидопа или бензеразид). Это позволяет уменьшить дозу и увеличить длительность действия препарата. Наиболее часто применяемые препараты этой группы - мадопар, наком, синемет.
Препараты дофамина эффективны в лечении основных симптомов заболевания – гипокинезии и ригидности.
Побочные эффекты леводопы проявляются в трех сферах: в вегетативной нервной системе (тошнота, рвота, ортостатическая гипотония, тахикардия), моторной системе (дискинезии, клинические флюктуации), психической сфере (беспокойство, возбуждение, галлюцинации, депрессии с опасностью суицида), кроме того, отмечено тератогенное действие препарата. Необходимо соблюдать осторожность при одновременном применении лекарственных средств, которые могут усилить и побочные эффекты леводопы (агонисты адренорецепторов, трициклические антидепрессанты) или, наоборот, ослабить их (витамин В6, нейролептики, резерпин, метилдофа). Требуется осторожность при оперативных вмешательствах с общей анестезией.
Для предотвращения катаболизма дофамина используют ингибиторы МАО–В -селегилин, юмекс, разагилин (азилект) и КОМТ: энтакапан, толкапон. Ингибиторы КОМТ применяют только в комбинации с L- допой.
Производные амантадина относительно мало эффективны, но обладают нейропротективным действием, возможно их парентеральное введение (ПКмерц) для коррекции дискинезий и имеют мало побочных явлений.
Агонисты дофаминовых рецепторов способных, действовать "в обход" дегенерирующего нейрона, минуя пресинаптическую его часть, непосредственно на дофаминовые рецепторы.
Применяются эрголиновые (бромокриптина, перголида, лизурида) и неэрголиновые агонистоы (прамипексола, ропинирола, пирибедила и др.)
Холинолитики в настоящее время используются редко только в сочетании с другими антипаркинсоническими средствами. Они относительно эффективны при треморе. Применение их показано в начальных стадиях заболевания и вегетативных проявлениях паркинсонизма. К числу широко используемых холинолитических препаратов относят циклодол, бипериден, тремблекс.
Учитывая неизбежность развития флюктуаций и дискинезий при лечении L-допа в течении 5-10 лет прием её надо начинать как можно позже. В возрасте до 50 лет начинать лечение надо с агонистов ДА-рецепторов или в сочетании их с амантадином или ингибиторами МАО-В или холинолитиками. При отсутствии эффекта добавлять низкие дозы (100-200мг/сут) L-допы.
Приблизительно 20% пациентов оказываются резистентными к проводимой лекарственной терапии или имеют выраженные побочные эффекты. В этих случаях возможно использование стереотаксических операций с длительной электростимуляцией субталамического ядра и бледного шара или с деструкцией в области таламуса (купирование тремора), бледного шара (уменьшение акинетико-ригидного синдрома) или микроинъекции дофамина, пептидов в базальные ганглии.
Клинические испытания проводились так же по трансплантации в мозг больных эмбриональных мезенцефальных нейронов (предшественников дофаминэргических нейронов). Показано, что эти клетки способны не только выживать, но и функционировать. После пересадки в комплексе с иммуносупрессорной терапией наблюдается устойчивый положительный эффект и в ряде случаев возможна отмена L-ДОФА терапии. В последние годы большое внимание уделяется вопросам качества жизни больных, возможностям их медико-социальной реабилитации, активного участия в повседневной жизни. В большинстве реабилитационных программ предусматривается участие и обучение не только самого больного, но и лица, осуществляющего уход. Основой подобных программ являются комплексный подход при активном участии самого пациента, применение физиотерапии, трудовой и речевой терапии, лечебной физкультуры в сочетании с групповой терапией, специальным обучением и работой с лицом, осуществляющим уход за больным.
7. Гиперкинезы, клинические формы: атетоз, хорея, гемибаллизм, тремор, тики, дистонии, миоклонии. Гиперкинезы – это автоматические насильственные чрезмерные движения, мешающие выполнению произвольных двигательных актов. Единой классификации гиперкинезов не существует, но есть несколько классификаций, подразделяющих различные виды насильственных движений по ряду признаков: по характеру возникновения (спонтанные, акционные, рефлекторные, индуцированные); по двигательному рисунку (ритмические, тонические, фазические); по временному рисунку (постоянные и пароксизмальные); по локализации (фокальные, сегментарные, мультифокальные, генерализованные) и.т.п. Существуют также синдромальные и нозологические классификации гиперкинезов. Каждый вид насильственного движения имеет ряд признаков, позволяющих отличить его от другого вида насильственных движений. Предлагаем вашему вниманию некоторые наиболее часто встречающиеся разновидности гиперкинезов. Атетоз – червеобразные замедленные движения пальцев, кистей, стоп, предплечий, голеней, мышц лица, являющиеся результатом асинхронно возникающего гипертонуса мышц агонистов и антагонистов. Характерен для перинатального поражения ЦНС. Хорея – аритмичные порывистые гиперкинезы, часто большой амплитуды. Базовый симптом малой хореи, хореи Гентингтона. Произвольные движения затруднительны. Типично начало гиперкинеза в дистальных отделах конечностей. Гемибаллизм — отдельный вид гиперкинеза, обусловленный поражением субталамического тела Люиса. Характеризуется типичными насильственными высокоамплитудными движениями, охватывающими проксимальные отделы конечностей одной половины тела. Диагностируется по данным неврологического статуса, томографии головного мозга, анализа цереброспинальной жидкости. Медикаментозное лечение осуществляется блокаторами дофаминовых рецепторов, ГАМК-ергическими средствами на фоне терапии причинной патологии. В резистентных случаях возможно нейрохирургическое лечение (таламотомия, паллидотомия). Тремор – ритмичные низко- и высокоамплитудные колебания, обусловленные попеременным сокращением мышц-антагонистов. Может охватывать различные части тела, усиливаться в покое или в движении. Сопровождает мозжечковую атаксию, болезнь Паркинсона, синдром Гийена-Барре, атеросклеротическую энцефалопатию. Тики – отрывистые низкоамплитудные аритмичные гиперкинезы, захватывающие отдельные мышцы, частично подавляемые волей больного. Чаще наблюдается подмигивание, моргание, подёргивание угла рта, области плеч, повороты головы. Тик речевого аппарата проявляется произношением отдельных звуков. Миоклонии – беспорядочные сокращения отдельных пучков мышечных волокон. При распространении на группу мышц обуславливают резкое непроизвольные движение, рывковое изменение положения тела. Аритмичные фасцикулярные подёргивания, не приводящие к двигательному акту, называют миокимиями, ритмичные подёргивания отдельной мышцы – миоритмиями. Сочетание миоклонических феноменов с эпилептическими пароксизмами формирует клинику миоклонической эпилепсии.
8. Мышечные дистонии. Основные признаки мышечных дистоний. Классификация. Клиника, диагностика, лечение. Дистониями называют стойкие непроизвольные мышечные сокращения антагонистических групп мышц в одной области тела, приводящие к появлению ненормального положения тела или резким скручивающим перемежающимся спазмам, которые могут напоминать тремор, атетоз, или хореоатетоз. Дистонии могут быть первичными или вторичными, а также могут быть генерализованными, очаговыми или сегментарным. Диагноз ставится на основе клинических данных. Для лечения фокальных или сегментарных дистоний применяют инъекции ботулотоксина. При лечении тяжелых генерализованных форм дистонии может потребоваться сочетание принимаемых внутрь холиноблокаторов, миорелаксантов, и бензодиазепинов. При некупируемой тяжелой сегментарной или генерализованной дистонии может потребоваться хирургическое вмешательство. Дистония может быть · Первичные (идиопатические) · Вторичной, обусловленной расстройствами ЦНС или приемом лекарственных препаратов Расстройства ЦНС, которые могут привести к дистонии включают · Болезнь Вильсона · Пантотенаткиназа-ассоциированную нейродегенерацию [PKAN], связанную с мутациями гена PANK2 [ранее, болезнь Галлервордена-Шпатца] · Различные липидозы · Рассеянный склероз · церебральный паралич, · Инсульт · Гипоксия мозга К лекарственным средствам, наиболее часто вызывающим дистонии, относятся: · Нейролептики (например, фенотиазины, производные тиоксантена, бутирофеноны) · Противорвотные средства (например, метоклопрамид, прохлорперазин) Дистония может напоминать атетоз и хореоатетоз, но ее следует отличать от этих заболеваний, потому что этиология и тактика лечения могут отличаться. Классификация Классификация дистоний основывается на: · Этиология · Клинические симптомы Этиологию классифицируют следующим образом: · Наследственная: имеет доказанное генетическое происхождение (ранее известная как первичная) и включает в себя расстройства с аутосомно-доминантным, аутосомно-рецессивным или сцепленным с Х-хромосомой наследованием · Идиопатическая: может быть семейной или спорадической · Приобретенная: связанная с нейроанатомическими патологиями, обусловленными другими расстройствами Клинические признаки включают следующие: · Начало: может возникнуть в любом возрасте, от младенчества до поздней зрелости · Распределение по телу: может быть очаговой (ограничивается одной частью тела), сегментарной (с вовлечением ≥ 2 смежных частей тела, таких как верхняя и нижняя половины лица или лицо и шея), мультифокальной (поражает ≥ 2 несмежных частей тела, таких как шея и нижняя конечность), генерализованной (с вовлечением туловища плюс 2 различных частей тела), или гемикорпоральной (охватывает половину тела; также называется гемидистонией) · Хронология: может быть статической, прогрессирующей, пароксизмальной или постоянной, а также может иметь суточные колебания или быть вызванной определенными задачами (специфическая дистония) · Изолированная (нет данных относительно других двигательных расстройств) или комбинированная (сопровождается другими непроизвольными движениями [отличными от тремора], но преобладающими при дистонии) Цервикальная дистония (спастическая кривошея) – непроизвольные сокращения мышц шеи – является наиболее распространенным видом дистонии. Генерализованная дистония может быть наследственной или вызвана другим расстройством или применением лекарственного препарата. Первичная генерализованная дистония (обусловленная мутацией в гене DYT1) Эта редкая форма дистонии является прогрессирующей и характеризуется формированием устойчивых, часто причудливых, поз. Она часто наследуется аутосомно-доминантно, и обусловлена мутацией в гене DYT1 с частичной пенетрантностью; у некоторых членов семьи больного ген экспрессируется в минимальной степени. У бессимптомных братьев и сестер больного (носителей) могут иметься очень слабые нарушения (forme fruste). Как правило, симптомы первичной генерализованной дистонии проявляются в детстве в виде подворачивания стопы и сгибания голеностопного сустава при ходьбе. Вначале дистония может локализоваться только в туловище или ноге, но часто прогрессирует, как правило, в краниальном направлении, и затрагивает весь организм. При наиболее тяжелых формах могут формироваться вычурные патологические, почти неподвижные позы, в конечном счете не позволяющие больным встать с инвалидного кресла. При дебюте заболевания во взрослом возрасте симптомы заболевания чаще всего проявляются в лицевой мускулатуре или руках. Интеллект, как правило, остается сохранным. Дофа-зависимая дистония Это редкая наследственная дистония. Симптомы дофа-зависимой дистонии обычно развиваются в детском возрасте. Как правило, вначале поражение развивается только в одной ноге. В результате, ребенку приходится ходить на цыпочках. Симптомы утяжеляются по ночам. Ходить ребенку становится все труднее, нарушаются движения рук и ног. Тем не менее, у некоторых детей симптомы лишь незначительные, например, мышечные судороги после физических упражнений. Иногда симптомы появляются в более старшем возрасте, и напоминают болезнь Паркинсона. Движение может быть медленным, может быть трудно поддерживать равновесие тела, в руках в покое может возникать тремор. После назначения низких доз леводопы выраженность симптомов резко уменьшается. Если леводопа купирует симптомы, диагноз считают подтвержденным. Фокальные дистонии При фокальной дистонии клинические признаки заболевания наблюдаются в какой-либо одной части тела. Они, как правило, начинаются в зрелом возрасте, от 20 до 30 лет. Первоначально патологические положения тела могут быть непостоянными или появляться только при определенных движениях (и, таким образом, иногда их описывают как спазмы). Патологические движения, как правило, более заметны во время целенаправленных движений, и менее выражены в покое, но эти различия с течением времени сглаживаются, что часто приводит к перекашиванию пораженной части тела и развитию тяжелой инвалидности. Тем не менее, боль появляется редко, за исключением фокальной первичной дистонии шеи (шейной дистонии) и дистонии при начальном снижении эффективности леводопы при болезни Паркинсона (при этом чаще поражаются нижней конечности, например, в виде выворота стопы). Профессиональные дистонии представляют собой вариант целенаправленных фокальных дистоний, провоцируемых выполнением определенных рабочих движений (например, писчий спазм, дистония музыкантов, судороги рук у игроков в гольф). Спастическая дисфония характеризуется напряженным, хриплым или скрипучим голосом вследствие фокальной дистонии мышц гортани. Цервикальная дистония проявляется непроизвольными тоническими сокращениями или интермиттирующими спазмами мышц шеи. Сегментарные дистонии Эти дистонии поражают ≥ 2 смежных частей тела. Синдром Мейжа (блефароспазм плюс оромандибулярная дистония) включает в себя насильственное моргание, жевательные движения нижней челюстью, гримасничанье, и развивается, как правило, в старшем взрослом возрасте. Его следует отличать от щечно-язычно-лицевой хореи в рамках поздней дискинезии и поздней дистонии (вариант поздней дискинезии). Диагностика · Клиническая оценка Дистонию диагностируют клинически. Лечение · При генерализованной дистонии – холиноблокаторы, миорелаксанты или их сочетание · При фокальной или сегментарной дистонии – инъекции ботулотоксина, чтобы парализовать мышцы · Иногда нейрохирургическая манипуляция При генерализованной дистонии, как правило, применяют холиноблокаторы (тригексифенидил от 2 до 10 мг перорально 3 раза/день, бензатропин от 3 до 15 мг перорально 1 раз/день); дозу обычно подбирают до достижения желаемого эффекта. Дополнительного положительного эффекта можно достичь с помощью миорелаксантов (обычно баклофена) и/или бензодиазепинов (например, клоназепама). При тяжелых формах генерализованной дистонии или в случае резистентности к терапии возможно проведение стереотаксической нейрохирургической операции по имплантации электродов для стимуляции внутреннего сегмента бледного шара (GPi). В некоторых случаях показано стереотаксическое унилатеральное абляционное хирургическое вмешательство на внутреннем сегменте бледного шара. При фокальных или сегментарных дистониях, или при генерализованной дистонии с преимущественным вовлечением в гиперкинез какой-либо определенной части тела, предпочтение в лечении отдают · Очищенному ботулотоксину типа А или В, который опытный практикующий врач вводит в пораженные мышцы под электромиографическим контролем или без него Ботулинический токсин ослабляет чрезмерные мышечные сокращения путем химической денервации, но не влияет на вызывающие дистонию патологические нервные пути в головном мозге. Инъекция токсина наиболее эффективна для лечения блефароспазма и кривошеи, и может быть очень эффективна при большинстве других форм фокальной дистонии. Дозировка сильно варьирует. Лечение необходимо повторять каждые 3-4 мес., поскольку продолжительность действия токсина ограничена. Тем не менее, в некоторых случаях при повторном введении эффективность токсина снижается, потому что к белку токсина образуются нейтрализующие антитела; способностью нейтрализовать токсин обладают не все образующиеся антитела.
9. Виды расстройств чувствительности: поверхностной, глубокой. Сложные виды нарушений чувствительности. Виды боли.
|
|||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-07-18; просмотров: 86; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.188.245.152 (0.017 с.) |

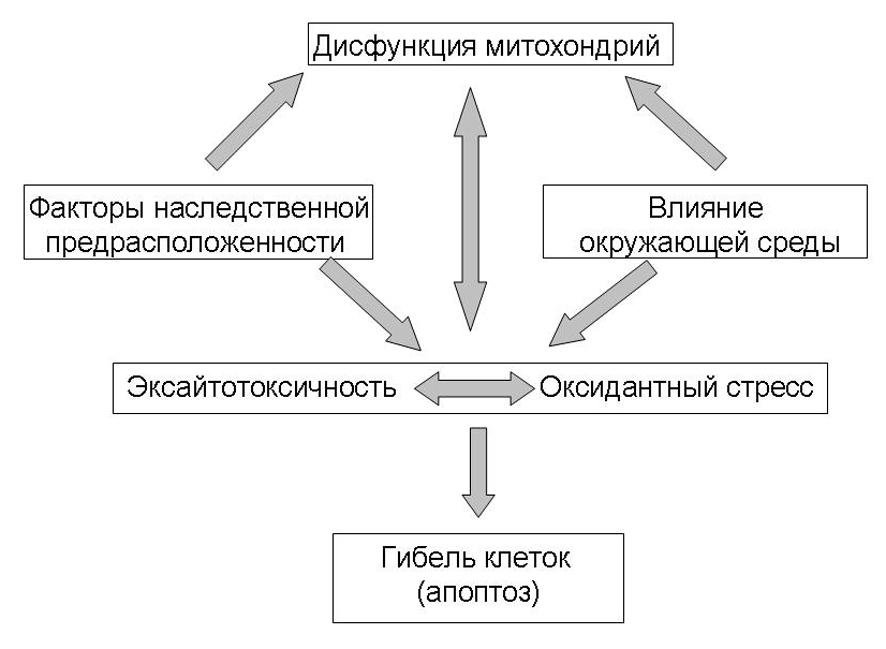 Многочисленные исследования последнего десятилетия показали, что одним из механизмов гибели нервной клетки при дегенеративных заболеваниях нервной системы, и в частности при болезни Паркинсона, является апоптоз. Программированная гибель клеток, наблюдаемая при физиологическом процессе старения, может усиливаться под влиянием различных экзогенных и эндогенных факторов.
Многочисленные исследования последнего десятилетия показали, что одним из механизмов гибели нервной клетки при дегенеративных заболеваниях нервной системы, и в частности при болезни Паркинсона, является апоптоз. Программированная гибель клеток, наблюдаемая при физиологическом процессе старения, может усиливаться под влиянием различных экзогенных и эндогенных факторов.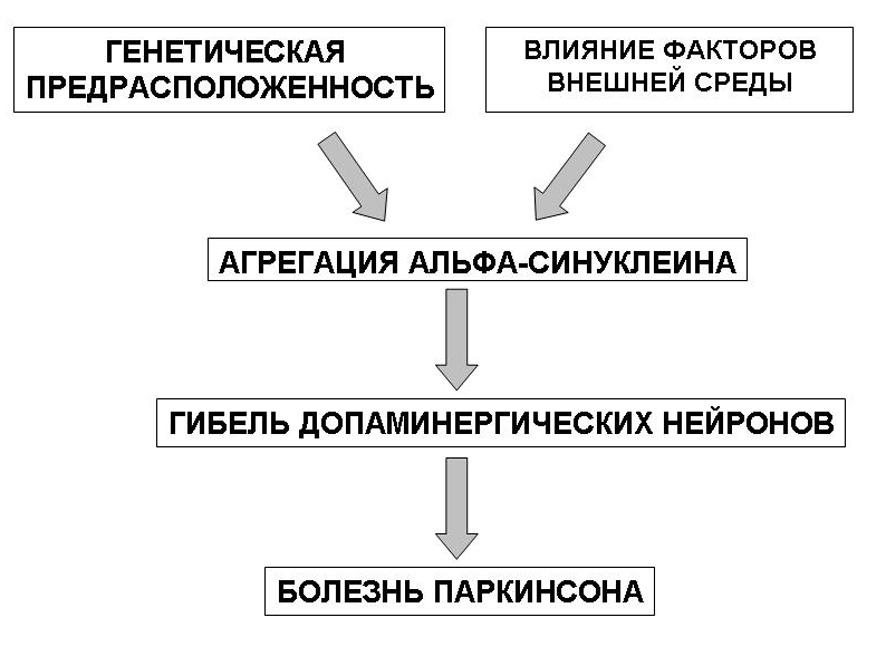 Тельца Леви могут быть обнаружены в черной субстанции, голубом пятне, дорзальном двигательном ядре блуждающего нерва, таламусе, гипоталамусе, а также в коре головного мозга преимущественно пожилых пациентов с длительной историей течения болезни Паркинсона, у которых развились симптомы деменции. Тельца Леви содержат протеин под названием альфа- синуклеин, основной функцией которого является модуляция синаптической пластичности. Появление и роль альфа- синуклеина в гибели нейронов объясняют с позиций оксидантного стресса, а также наличием генетических мутаций, ведущих к повреждению и интранейрональному его накоплению.
Тельца Леви могут быть обнаружены в черной субстанции, голубом пятне, дорзальном двигательном ядре блуждающего нерва, таламусе, гипоталамусе, а также в коре головного мозга преимущественно пожилых пациентов с длительной историей течения болезни Паркинсона, у которых развились симптомы деменции. Тельца Леви содержат протеин под названием альфа- синуклеин, основной функцией которого является модуляция синаптической пластичности. Появление и роль альфа- синуклеина в гибели нейронов объясняют с позиций оксидантного стресса, а также наличием генетических мутаций, ведущих к повреждению и интранейрональному его накоплению.


