
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Закон объемных отношений (Гей-Люссак, 1808 г.)Содержание книги
Поиск на нашем сайте
Установленный французским ученым Гей-Люссаком закон объемных отношений, гласит: «При постоянном давлении и температуре объемы реагирующих друг с другом газов, а также объемы газообразных продуктов реакции относятся как небольшие целые числа». Например, в реакции Закон Авогадро (А. Авогадро, 1811 г.) «В равных объемах различных газов при одинаковых условиях содержится оди-наковое число молекул». Другими словами, можно сказать, что моль любого газа при оди-наковой температуре и давлении занимает один и тот же объем. Из вычислений Авогадро следует, что моль любого газа при давлении 760 мм рт. ст. и при температуре 0 оС занимает объем, равный 22,4 литра. На законах постоянства состава Гей-Люссака, Авогадро и кратных отношений основывается стехиометрия – учение о количественных соотношениях между массами веществ, вступающих в реакцию, и продуктами реакции. Однако развитие химии и изучение все большего числа соединений показало, что наряду с веществами, имеющими определенный состав, существуют еще и соединения переменного состава. В честь Дальтона и Бертолле в 1911 г. Н.С. Курнаковым были введены термины дальтониды и бертоллиды для обозначения химических соединений соответственно постоянного и переменного состава. К дальтонидам относятся, например, газы и твердые тела с молекулярной кристаллической решеткой, к бертоллидам – ионные кристаллы, многие окислы и сульфиды металлов. Обнаружение бертоллидов явилось причиной пересмотра представлений о молекуле в целом. Молекулой, как и прежде, продолжали называть наименьшую частичку вещества, способную определять его свойства и существовать самостоятельно. Но теперь к молекулам стали относить системы, такие как ионные, атомные и металлические монокристаллы, а также полимеры, образованные за счет водородных связей. В результате применения физических методов исследования вещества стало ясно, что свойства реального тела определяются не столько тем, постоянен или не постоянен состав химического соединения, а скорее физической природой тех сил, которые заставляют несколько атомов объединяться в одну частицу – молекулу, комплекс, монокристалл или иной агрегат.
Следующий этап развития классической химии начинается открытием в 1869 году Д.И. Менделеевым периодического закона химических элементов и завершается полуклассической теорией – строения атома Н. Бора. Современная формулировка периодического закона изложена в разделе 7.
Природа химической связи Центральной проблемой химии является проблема химической связи. Под химической связью понимается взаимодействие между атомами, в результате чего возникает определенная конфигурация связанных атомов, отличающая один тип молекулы от другого. Энергия связанной системы меньше, чем суммарная энергия отдельных атомов, понижение энергии – движущая сила процесса образования химической связи. Теория химической связи должна отвечать на ряд вопросов, наиболее важными из которых являются следующие. 1. Как образуется связь? Каков механизм ее образования? Что происходит при соединении атомов? 2. Почему при образовании молекулы происходит понижение энергии и какова энергия химической связи? 3. Какова геометрия, пространственная структура молекулы? 4. Каково распределение электронной плотности в пространстве между ядрами? Первые попытки выяснить природу химической связи были предприняты еще до создания квантовой механики. Открытие Дж. Томсона в 1897 г. электрона как составной части атома инициировало создание теории химической связи. Первая электромагнитная концепция химической связи была предложена Томсоном в 1907 г. Он предположил наличие в атомах особо устойчивых электронных конфигураций, которые могут достигаться путем потери или присоединения электронов. Построение теории химической связи на основе перераспределения электронов между атомами были предприняты в работе В. Косселя и Дж. Льюиса в 1916 г. Рассматривая соединения щелочных металлов с галогенами, Коссель обратил внимание на образование устойчивых электронных конфигураций, подобных конфигурациям инертных газов, не вступающих в химические реакции. При взаимодействии атомов металлов с атомами неметаллов первые отдают, а вторые присоединяют число электронов, недостающее до октета (восьми). В результате такого перераспределения электронов атом металлов превращается в положительно заряженный ион, а атом неметаллов – в отрицательный. Химическая связь между разнозаряженными ионами осуществляется силами электростатического притяжения. Такая связь называется ионной.
Аналогичную схему химической связи предложил Льюис. Он также исходил из особой стабильности октета электронов во внешней оболочке атома. При этом он рассматривал два механизма образования химической связи. Согласно первому электроны расположены в вершинах куба и объединение атомов происходит путем переноса электронов от одного атома к другому с образованием октетных конфигураций, что совпадает с теорией Косселя. Во втором случае электроны заполняют пустые вершины благодаря обобществлению электронов соединяющихся атомов. Квантовая природа химической связи. Согласно современным представлениям химическая связь между атомами возникает в результате движения внешних (валентных) электронов в поле нескольких ядер. Квантовомеханический способ описания молекул предполагает известность электронной структуры изолированных атомов. Вследствие волновых свойств микрочастиц взаимодействие электронов нужно рассматривать не как взаимодействие точечных зарядов, а как взаимодействие зарядов, распределенных в виде облака. В настоящее время существует несколько квантовомеханических методов решения проблемы образования химической связи. Все они тождественны в своей физической основе и опираются на один и тот же математический аппарат квантовой механики – уравнение Шредингера, а различие их заключается лишь в исходных приближениях. В квантовой химии широко используется метод молекулярных орбиталей (МО), который позволяет обосновать математически то, что здесь излагается лишь качественно. В основе метода МО лежит представление о полной потере индивидуальности атомов, соединившихся в молекулу. Это означает, что молекула представляет собой качественно новую систему, образованную несколькими атомными ядрами и движущимися в их поле электронами. Атомы соединяются в молекулы, если при этом уменьшается полная энергия системы, что происходит при увеличении электронной плотности в пространстве между ядрами. Рассмотрим образование химической связи на примере молекулы водорода (Н2). Это наиболее простая молекула, состоящая из двух атомов водорода. Представим себе два атома водорода, находящихся на столь далеком расстоянии друг от друга, что каждый из электронов этих атомов движется под действием поля ядра своего атома и не ощущает воздействия второго атома. Атомы находятся в основном
1 S
Рисунок 106
Возникшим молекулярным энергетическим уровням
Поэтому этот метод в квантовой химии называется МО-ЛКАО. Плотность вероятности распределения электронов в пространстве определяется квадратом волновой функции
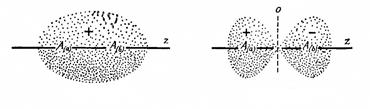
В последнем уравнении знак плюс соответствует повышенной электронной плотности между ядрами (рисунок 107а), благодаря которой ядра притягиваются друг к другу на расстояние, когда сила притяжения будет уравновешиваться силой отталкивания ядер. Поэтому молекулярная орбиталь
а)
Рисунок 107
Состоянию, описываемому молекулярной орбиталью
Способность атомов к образованию тех или иных химических связей называется Молекула гелия Не2 существовать не может. Электронная конфигурация гелия Рассмотрим теперь химическую связь в более сложных молекулах, образованных многоэлектронными атомами. Рассмотрение проведем на примере двухатомных молекул, составленных некоторыми элементами II периода, а именно Li, B, C, N, O, F. Валентными орбиталями этих атомов являются Для В качестве единой оси для всех молекул выберем ось Тогда
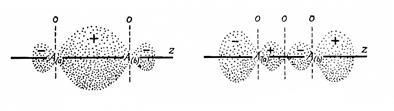
Рисунок 108
Орбитали
Рисунок 109 Следует подчеркнуть, что мы не рассматривали перекрытие Таким образом, в молекулах, состоящих из атомов II периода, кроме
Молекула лития ( Молекула бериллия ( Молекула углерода ( Молекула азота ( Молекула кислорода ( Предсказание парамагнетизма молекулы кислорода с помощью метода молекулярных орбиталей вызвало большой интерес к этой теории, поскольку в рамках представлений Льюиса об образовании химической связи наличие двух неспаренных электронов в молекуле Молекула неона ( Мы рассмотрели химическую связь в гомоядерных молекулах. Аналогичная связь образуется и между гетероядерными молекулами (образованными разными атомами). Например, в молекуле HCl атом водорода предоставляет для образования связи неспаренный 1 S электрон, а атом Cl – неспаренный 3 Р электрон. Существует принципиальное различие в свойствах ковалентной связи в зависимости от того, связывает она два одинаковых или два разных атома. В первом случае электронное облако совершенно симметрично относительно ядер обоих атомов. Если два равных по абсолютной величине разноименных заряда q находятся на некотором расстоянии l один от другого, то их называют диполем. Величина Р = ql называется электрическим дипольным моментом. Для молекулы водорода ее дипольный момент равен нулю. Такая связь называется гомеополярной, или неполярной. Во втором случае электронное облако несимметрично и смещено к одному из ядер атомов. Такая связь имеет дипольный момент и называется полярной. В случае таких молекул, как HCl, вероятность пребывания связующих электронов в поле ядра атома Cl больше, чем в поле ядра атома Н. Это приводит к появлению дипольного момента, направленного от атома Н к атому Cl. Полярность молекулы HCl невелика и связь в основном ковалентная. Существуют и сильнополярные молекулы, например, молекула NaCl, дипольный момент которых значителен. В предельных случаях полярная связь называется ионной. Поскольку дипольный момент определяют экспериментально, то ионный ха-рактер связи можно оценить количественно. Например, дипольный момент LiН равен Отличительной особенностью III и следующих периодов от II периода является существование на валентных состояниях d -электронов, которые также могут принимать участие в образовании молекулярных орбиталей, что часто приводит к усилению связи. Многоатомные молекулы. Многоатомными называются молекулы, содержащие более двух ядер. Многоатомные молекулы характеризуются пространственным распре-делением электронного облака. Естественно предположить, что электроны образуют связь в том направлении, в котором расположена большая часть их облака. Простейшей многоатомной молекулой является органическое соединение метан СН4. При образовании химической связи конфигурация основного состояния свободного атома изменяется. Чаще всего это происходит при возбуждении атома, когда электрон переходит из n s 2 состояния в состояние пр, если последнее заполнено менее чем наполовину. При образовании химической связи в молекуле СН4 происходит перестройка электронной конфигурации углерода по схеме Характером химической связи определяется пространственная структура молекул. В случае метана к каждой из четырех гибридных sp -орбиталей, направленных от атома углерода в углы воображаемого тетраэдра, подходят атомы водорода. Электронные облака углерода и водорода перекрываются, что приводит к образованию химической связи. Угол между связями Н–С–Н в молекуле СН4 составляет 109° Кроме рассмотренной пространственной структуры молекул, многоатомные молекулы бывают линейными (ВеН2) и плоскими (ВF3) (рисунок 111). Н
C
Рисунок 110
Н Ве Н
Рисунок 111
Однако валентные возможности атомов при образовании химической связи ограничены. В этом проявляется одно из важнейших свойств химической связи – насыщаемость химических сил, обуславливающих возникновение химической связи. Каждая ковалентная связь между атомами образуется парой электронов с противоположными спинами (в соответствии с принципом Паули). Взаимодействие такой пары электронов с третьим электроном приводит к эффекту отталкивания (обменное взаимодействие электронов, принадлежащих разным связям, вызывает отталкивание). В этом заключается физический смысл явления насыщаемости. Вследствие насыщаемости «сил» химической связи молекулы имеют определенный состав, например Н2, но не Н3, Н4 или Н20 ; СН4, но не СН5 и СН9 ; NH3, но не NH5 и NH8. Таким образом, молекулы существуют в виде дискретных образований с определенной структурой, а не представляют собой какие-то конгломераты атомов. До сих пор рассматривались межатомные взаимодействия, приводящие к соединению атомов в молекулы, образованные относительно небольшим числом атомов. Однако химическая связь ответственна не только за образование молекул, но и вещества, находя- щегося в различных агрегатных состояниях и состоящего из огромного числа атомов и молекул. В газах химическая связь преимущественно ковалентная, в жидкостях имеет место как ковалентная, так и ионная, а в твердых телах – ковалентная, ионная и металлическая. В металлах положительно заряженный ионный остов кристаллической решетки погружен в отрицательно заряженный, вырожденный электронный газ. Взаимодействие электронного газа с положительными ионами отвечает за связь атомов в металлах, которая называется металлической. Существование жидкостей и молекулярных кристаллов связано с электростатическим притяжением между нейтральными молекулами, вызванные так называемыми силами Ван-дер-Ваальса. Наиболее очевиден механизм ориентационного взаимодействия, которое существует между полярными молекулами, обладающими дипольными моментами. Последние ориентируются так, чтобы сблизиться разноименными полюсами, результатом чего появляется притяжение между молекулами (рисунок 112).
+ + - + -
Рисунок 112 1 Если молекула не имеет постоянного дипольного момента, то он может в ней возникнуть, индуцироваться под действием другой полярной молекулы. Возникающее при этом притяжение наведенных диполей обуславливает второй тип вандерваальсовых сил – индукционное взаимодействие. Между неполярными молекулами действует третий тип вандерваальсовых сил – дисперсионное взаимодействие. Его природа была выяснена только после создания квантовой механики. В среднем по времени дипольные моменты неполярных молекул оказываются равными нулю, но мгновенное значение дипольного момента может быть отлично от нуля. Мгновенный диполь создает электрическое поле, поляризующее соседние молекулы, и возникает взаимодействие мгновенных диполей. Вандерваальсовы силы очень быстро ослабевают с увеличением расстояния между молекулами, поскольку их величина обратно пропорциональна седьмой степени этого расстояния. С энергией межмолекулярного взаимодействия связана температура кипения веществ: чем больше энергия связи между молекулами, тем выше температура перехода их в газообразное состояние (кипение). Однако во многих случаях температура кипения жидкостей, кроме вандерваальсовых сил, определяется наличием сил притяжения иной природы. Например, аномально высокая температура кипения воды обусловлена существованием водородных связей между молекулами воды. Водородная связь осуществляется с участием атома водорода, расположенного либо между молекулами, либо между атомами внутри молекулы. Примером межмолекулярной водородной связи является связь между молекулами воды
О О
Н Н
Н Н
О О
где...... обозначает водородную связь. Внутри- и межмолекулярные водородные связи типа Водородная связь объясняется тем, что электрон атома водорода слабо связан с протоном и легко смещается к электроотрицательному атому, например, к ближайшему атому кислорода или азота. В результате протон почти «оголяется» и создаются условия для сближения атомов О... О или N... N.
Структурная химия
Благодаря развитию химической науки к середине XIX в. стало ясно, что свойства веществ и их качественное разнообразие обусловлены не только их составом, но и структурой молекул. Об этом наглядно свидетельствует открытое в 1823 г. немецким химиком Ю. Либихом явление изомерии, заключающееся в существовании одинаковых по составу и молекулярной массе, но различающихся по строению веществ. Он показал, что фульминат серебра Ag–O–N=C и изоционат серебра Ag–N=C=O имеют один и тот же состав, но разные свойства. В 1830 г. И.Я. Берцелиус установил, что виноградная и виннокаменная кислоты также имеют одинаковый качественный и количественный состав, но различаются по своим свойствам. Берцелиус предложил для обнаруженного явления термин «изомерия». Вскоре обнаружилось, что это явление широко распространено в органической химии. В состав органических веществ входит относительно небольшое число элементов – углерод, водород, кислород, азот, фосфор, сера (получивших название органогенов) – при огромном числе обнаруженных органических соединений (более 10 млн) и разнообразии их свойств. Именно поэтому на протяжении поч
|
|||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-05-12; просмотров: 295; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.116.60.124 (0.016 с.) |
||||||||||||||||||||||||||||||||||||||||||||||

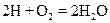 отношение объемов газов равно 2:1:2, а в реакции
отношение объемов газов равно 2:1:2, а в реакции 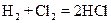 равно 1:1:2.
равно 1:1:2.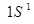 состоянии, описываемом волновой функцией
состоянии, описываемом волновой функцией 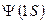 (
(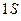 – атомная орбиталь). На этом энергетическом уровне могут находиться два электрона с противоположными спинами (согласно принципу Паули), т.е.
– атомная орбиталь). На этом энергетическом уровне могут находиться два электрона с противоположными спинами (согласно принципу Паули), т.е. 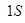 расщепляются на два состояния (снимается вырождение). В молекуле появляются два энергетических состояния с отличающимися энергиями, которые обозначим
расщепляются на два состояния (снимается вырождение). В молекуле появляются два энергетических состояния с отличающимися энергиями, которые обозначим 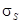 и
и  (рисунок 106).
(рисунок 106).


 Е
Е  1 S 1 S
1 S 1 S




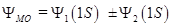 .
. .
. называется связующей орбиталью, которой соответствует наиболее низкое энергетическое состояние в молекуле Н2. Как известно из физики, минимуму энергии соответствует устойчивое состояние, поэтому состояние
называется связующей орбиталью, которой соответствует наиболее низкое энергетическое состояние в молекуле Н2. Как известно из физики, минимуму энергии соответствует устойчивое состояние, поэтому состояние  (притяжение); б)
(притяжение); б) 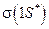 (отталкивание)
(отталкивание)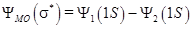 , соответствует более высокий уровень энергии
, соответствует более высокий уровень энергии 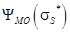 называется «разрыхляющей», или «антисвязующей». Распределение электронов по энергетическим состояниям в молекуле также как и в атоме подчиняется принципу Паули. Подобно тому, как в атоме квантован орбитальный момент импульса
называется «разрыхляющей», или «антисвязующей». Распределение электронов по энергетическим состояниям в молекуле также как и в атоме подчиняется принципу Паули. Подобно тому, как в атоме квантован орбитальный момент импульса 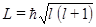 , в случае молекулы вводится квантовое число
, в случае молекулы вводится квантовое число 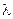 , которое определяет момент импульса электронов в молекуле
, которое определяет момент импульса электронов в молекуле  . Если в атоме состояния, соответствующие орбитальному квантовому числу
. Если в атоме состояния, соответствующие орбитальному квантовому числу 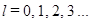 , символически обозначались
, символически обозначались  , для молекулы с
, для молекулы с 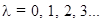 эти состояния обозначаются буквами
эти состояния обозначаются буквами 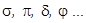 Электрон в молекуле, так же как в атоме, имеет спиновое квантовое число
Электрон в молекуле, так же как в атоме, имеет спиновое квантовое число  . Следовательно, два электрона в молекуле Н2 занимают наинизшее
. Следовательно, два электрона в молекуле Н2 занимают наинизшее 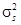 состояние с противоположно направленными спинами. Электронное облако, соответствующее молекулярной
состояние с противоположно направленными спинами. Электронное облако, соответствующее молекулярной 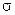 -орбитали, обладает симметрией относительно оси, проходящей через оба ядра. Такая ковалентная связь называется
-орбитали, обладает симметрией относительно оси, проходящей через оба ядра. Такая ковалентная связь называется 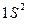 , К -оболочка полностью заполнена. Если перекрываются заполненные атомные орбитали, на каждой из которых находится по два электрона, то оказываются заполненными как связующие, так и разрыхляющие МО. Следовательно, выигрыша энергии при образовании молекулы не получается и связь (молекула) не образуется. При этом образовавшиеся МО мало отличаются от исходных АО (
, К -оболочка полностью заполнена. Если перекрываются заполненные атомные орбитали, на каждой из которых находится по два электрона, то оказываются заполненными как связующие, так и разрыхляющие МО. Следовательно, выигрыша энергии при образовании молекулы не получается и связь (молекула) не образуется. При этом образовавшиеся МО мало отличаются от исходных АО ( – от 1 S Не). Электронная конфигурация гипотетической молекулы
– от 1 S Не). Электронная конфигурация гипотетической молекулы  .
. -орбитали. Часто для наглядности орбитали изображают графически, как граничную поверхность, которая ограничивает область пространства вокруг ядра, где вероятность пребывания электрона достаточно велика (см. рисунок 75).
-орбитали. Часто для наглядности орбитали изображают графически, как граничную поверхность, которая ограничивает область пространства вокруг ядра, где вероятность пребывания электрона достаточно велика (см. рисунок 75).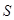 -орбиталей граничная поверхность сферически симметрична, т.е. не зависит от направления в пространстве. В отличие от
-орбиталей граничная поверхность сферически симметрична, т.е. не зависит от направления в пространстве. В отличие от 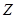 , проходящую через ядра.
, проходящую через ядра. и
и  -орбитали с осевой симметрией.
-орбитали с осевой симметрией.
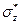
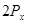 и
и 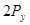 не обладают осевой симметрией относительно оси
не обладают осевой симметрией относительно оси 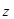 такая молекулярная орбиталь имеет знак «+», по другую сторону – знак «–». При повороте на 180о вокруг оси
такая молекулярная орбиталь имеет знак «+», по другую сторону – знак «–». При повороте на 180о вокруг оси 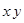 . Молекулярные орбитали такого типа носят название
. Молекулярные орбитали такого типа носят название 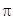 -орбиталей. Очевидно, что в результате перекрывания двух атомных
-орбиталей. Очевидно, что в результате перекрывания двух атомных 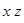 .
.
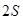 и
и 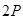 орбиталей, что оправдано при достаточно большой разности энергий атомных
орбиталей, что оправдано при достаточно большой разности энергий атомных 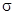 -связи, возникает
-связи, возникает 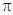 -связь. А для более сложных молекул возможно появление и других связей –
-связь. А для более сложных молекул возможно появление и других связей –  и
и  . Для характеристики прочности химической связи вводится понятие кратности связи. Под кратностью связи понимается число избыточных электронных пар на связующих орбиталях по сравнению с разрыхляющими.
. Для характеристики прочности химической связи вводится понятие кратности связи. Под кратностью связи понимается число избыточных электронных пар на связующих орбиталях по сравнению с разрыхляющими. ). Молекулы щелочных металлов существуют в газообразном состоянии (
). Молекулы щелочных металлов существуют в газообразном состоянии (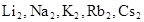 ). Атом
). Атом 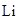 с электронной конфигурацией
с электронной конфигурацией 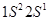 имеет всего один валентный
имеет всего один валентный 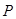 -характер. Основное состояние молекулы имеет электронную конфигурацию
-характер. Основное состояние молекулы имеет электронную конфигурацию 
 , так как оба валентных электрона находятся на
, так как оба валентных электрона находятся на 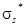 -МО не занята электрона-ми, в молекуле
-МО не занята электрона-ми, в молекуле  ). Электронная конфигурация атома
). Электронная конфигурация атома 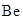
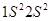 . Молекула
. Молекула  , которая соответствует отсутствию связей
, которая соответствует отсутствию связей 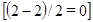 . Как и следует ожидать, молекула
. Как и следует ожидать, молекула  ). Как указывалось ранее, часто при образовании химической связи конфигурация основного состояния свободного атома изменяется. Наиболее наглядно это происходит при возбуждении, когда он переходит из замкнутой
). Как указывалось ранее, часто при образовании химической связи конфигурация основного состояния свободного атома изменяется. Наиболее наглядно это происходит при возбуждении, когда он переходит из замкнутой 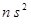 -оболочки в оболочку
-оболочки в оболочку 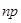 , если последняя заполнена менее, чем наполовину. Например, в основном состоянии атом углерода имеет два неспаренных
, если последняя заполнена менее, чем наполовину. Например, в основном состоянии атом углерода имеет два неспаренных 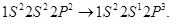 Электронная конфигурация молекулы
Электронная конфигурация молекулы 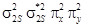 , число связей равно двум.
, число связей равно двум.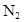 ). Валентная конфигурация атома азота
). Валентная конфигурация атома азота 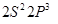 . Молекулярная электронная конфигурация имеет вид
. Молекулярная электронная конфигурация имеет вид  . Неспаренных электронов в молекуле
. Неспаренных электронов в молекуле  ).
). ). Валентная конфигурация основного состояния атома кислорода
). Валентная конфигурация основного состояния атома кислорода 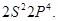 Электронная конфигурация молекулы
Электронная конфигурация молекулы 
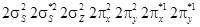 . В молекуле кислорода имеются две связи (одна
. В молекуле кислорода имеются две связи (одна 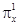 и
и 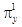 имеют в основном состоянии одинаковый спин. Таким образом, молекула
имеют в основном состоянии одинаковый спин. Таким образом, молекула 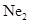 ). Неон обладает заполненной оболочкой с конфигурации-
). Неон обладает заполненной оболочкой с конфигурации-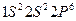 . Гипотетическая молекула
. Гипотетическая молекула 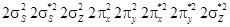 , соответствующую отсутствию связей. До настоящего времени нет никаких экспериментальных данных, которые указывали бы на возможность существования устойчивой молекулы неона. Неон – это инертный газ, как и все остальные инертные газы, находится в атомарном состоянии.
, соответствующую отсутствию связей. До настоящего времени нет никаких экспериментальных данных, которые указывали бы на возможность существования устойчивой молекулы неона. Неон – это инертный газ, как и все остальные инертные газы, находится в атомарном состоянии. (т.е.
(т.е.  м), для чисто ионной структуры дипольный момент должен быть равен 7,7 D. Таким образом, частичный заряд на ядрах будет приблизительно 0,77, т.е. связь в молекуле LiH на 77 % ионная. Это хорошо согласуется со значением, вычисленным теоретически (80 %).
м), для чисто ионной структуры дипольный момент должен быть равен 7,7 D. Таким образом, частичный заряд на ядрах будет приблизительно 0,77, т.е. связь в молекуле LiH на 77 % ионная. Это хорошо согласуется со значением, вычисленным теоретически (80 %).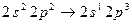 . По этой причине в природе существуют устойчивые соединения только четырехвалентного углерода, но не двухвалентного (СН4, но не СН2). Валентности свыше четырех могут осуществляться только при участии d -электронов.
. По этой причине в природе существуют устойчивые соединения только четырехвалентного углерода, но не двухвалентного (СН4, но не СН2). Валентности свыше четырех могут осуществляться только при участии d -электронов. . На рисунке показана простра-нственная структура метана. Атом углерода находится в центре правильного тетраэдра, а четыре атома водорода – по вершинам (рисунок 110).
. На рисунке показана простра-нственная структура метана. Атом углерода находится в центре правильного тетраэдра, а четыре атома водорода – по вершинам (рисунок 110).
 Н
Н  Н Н
Н Н

 F
F




 О
О 

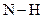 ...О часто встречаются в биополимерах – белках, нуклеиновых кислотах и в других макромолекулах.
...О часто встречаются в биополимерах – белках, нуклеиновых кислотах и в других макромолекулах.


