
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Генетическая рекомбинация ДНК
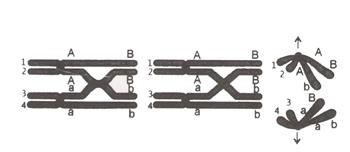
Двойная спираль ДНК обычно не взаимодействует с другими сегментами ДНК, и в человеческих клетках разные хромосомы пространственно разделены в ядре. Это расстояние между разными хромосомами важно для способности ДНК действовать в качестве стабильного носителя информации. В процессе рекомбинации с помощью ферментов две спирали ДНК разрываются, обмениваются участками, после чего непрерывность спиралей восстанавливается. Рекомбинация позволяет хромосомам обмениваться генетической информацией, в результате чего образуются новые комбинации генов, что увеличивает эффективность естественного отбора – движущей силы эволюции биологических систем. Самая распространенная форма кроссинговера – это гомологичная рекомбинация, когда принимающие участие в рекомбинации хромосомы имеют очень похожие последовательности. Негомологичная рекомбинация может привести к повреждению клетки, поскольку в результате такой рекомбинации возникает повреждение целостности генетического материала. Реакция рекомбинации катализируется ферментами, которые называются рекомбиназы. На первом этапе реакции рекомбиназа делает разрыв в одной из цепей ДНК, позволяя этой цепи отделиться от комплементарной цепи и присоединиться к одной из цепей второй хроматиды. Разрыв в цепи второй хроматиды позволяет ей также отделиться и присоединиться к оставшейся без пары цепи из первой хроматиды, формируя структуру Холлидея. Гомологичные хромосомы в результате кроссинговера перекрещиваются и обмениваются участками ДНК. При этом возникают качественно новые хромосомы (рисунок 132). Рассмотрим, какие типы гамет будет производить особь, если два гена находятся в одной хромосоме Аа Вb. Особь с таким генотипом производит два типа гамет: аb и АВ – в равных количествах, которые повторяют комбинацию генов в хромосоме родителя. Было установлено, что, кроме таких обычных гамет, возникают и другие, новые комбинации генов Аb и аВ, отличающимися от родительской гаметы. Причиной возникновения новых гамет заключается в кроссинговере гомологичных хромосом.
Рисунок 132
Рекомбинативная изменчивость является важнейшим источником большого наслед-ственного разнообразия, которое наблюдается в живых организмах.
Генные мутации – это изменение ДНК, не связанное с ее рекомбинацией. Они приводят к тому, что мутантный ген перестает работать, и тогда либо не образуются со- Генные мутации – это редкие, случайно возникшие события, обычно на 10–100 тыс. экземпляров какого-либо гена, например гена гемоглобина, возникает одна мутация. Несмотря на редкость мутаций, благодаря постоянству естественного мутационного процесса, происходит накапливание мутированных генов в генотипах различных организмов. Генные мутации следует рассматривать в процессе удвоения молекул ДНК под влиянием внешних мутагенов. Мутации, возникшие в половых клетках передаются следующим поколениям организмов, тогда как мутации в соматических клетках наследуются только дочерними клетками, образовавшимися путем митоза, и такие мутации называются соматическими. Хромосомные мутации – это перестройка хромосом. Они являются следствием отклонений в нормальном течении процессов клеточного деления. Основная причина возникновения различных хромосомных мутаций – разрывы хромосом и хромотид с последующим воссоединением в новых сочетаниях. Геномные мутации связаны с изменением числа хромосом. Например, у полиплоидных организмов гаплоидный набор (n) хромосом в клетке повторяется не два раза, как у диплоидов, а значительно больше – до 10–100 раз. Полиплоидная мутация часто встречается у растений, у животных полиплоидия довольно редка.
Обратная транскрипция. Ретровирусы. Ранее мы установили, что у всех многоклеточных организмов передача генетической информации осуществляется в последовательности: ДНК Важнейшим событием, положившим начало новому этапу развития молекулярной биологии, стало открытие в 1970 г. ревертазы – фермента, синтезирующего ДНК на мат-рице РНК. Такая передача информации называется обратной транскрипцией, и характерна она для особого класса ретровирусов (от лат. retro – обратно, назад). Дальнейшие иссле-дования показали, что обратный поток информации не идет, так как отсутствует обратная трансляция – информация, содержащаяся в белках, не используется для синтеза РНК и ДНК. Это не значит, что отсутствует всякая связь между белками и нуклеиновыми кисло-тами. Большинство белков является биокатализаторами, они оказывают регулирующее воздействие на биохимические реакции с участием генетического материала. Просто у некоторых вирусов генетическим материалом является не ДНК, а РНК. Ретровирусы содержат РНК и снабжены особым ферментом – ревертазой. После проникновения ретровируса в клетку под воздействием ревертазы начинается синтез вирусной ДНК – процесса, при котором РНК ретровируса играет роль матрицы. При этом структура синтезированного ДНК комплементарна вирусной РНК. Открытие ревертазы положило начало генной инженерии, раздела молекулярной биологии, связанного с целенаправленным конструированием новых, не существующих в природе сочетаний генов. С помощью фермента ревертазы можно получить ДНК на матрицах РНК, выделенных из клеток человека. Если эти ДНК перенести в бактериальную клетку, то ее можно заставить вырабатывать необходимые для медицины белки, например, интерферон, инсулин, гормон роста, окситоцин и др. В течение 70-х годов были обнаружены целые классы уникальных ферментов, с помощью которых стало возможным активное манипулирование нуклеотидной после-довательностью ДНК. Ферменты, с которыми связана новая революция в генетике – это рестриктазы, созданный самой природой молекулярный скальпель для генной инженерии. Если до 70-х годов молекулярная биология изучала молекулярно-генетические механизмы функционирования клетки в ее естественном проявлении, то с открытием рестриктазы экспериментальная биология поднялась на качественно более высокий уровень изучения генетического аппарата живых систем. В течение всей истории человечества постоянно осуществлялась селекционная работа по выведению и улучшению пород животных и растений. На пути селекционеров природа воздвигла естественные барьеры, ограничивающие межвидовое скрещивание. Так, невозможно скрестить кошку с собакой, лягушку с рыбой, а если в некоторых случаях межвидовое скрещивание возможно, то их потомство оказывается бесплодным, примером тому служит мул – помесь осла и лошади. Вековая мечта человечества по преодолению запрета на межвидовое скрещивание, отраженная в сказках и мифах случаями превращения человека в животное и обратно (образами кентавров, русалок, пегасов и т.д.), осуществилась благодаря революционным открытиям в молекулярной генетике. Одним из таких революционных открытий является обнаружение ферментов рестриктаз, позволивших непосредственно приступить к перетасовке генов.
Рестриктазы – это ферменты, которые вырабатываются бактериями для защиты от чужих ДНК. Рестриктазы, а их известно более 400, обладают способностью узнавать самые разные нуклеотидные последовательности ДНК длиной всего 4–7 нуклеотидных пар. Они разрезают молекулу ДНК на части точно в этом месте, причем сразу обе комплементарные нити, содержащие несколько тысяч пар нуклеотидов. Такая разрезанная на куски ДНК уже биологически неактивна и опасности для бактерии не представляет. Если две цепи ДНК разрезают не перпендикулярно им, а наискосок, то одна из нитей выступает вперед на несколько нуклеотидов и образует липкий конец (он называется липким, поскольку легко вступает во взаимодействие с другим концом, комплементарным ему). Генетики получили в свои руки молекулярный скальпель для разрезания ДНК с точностью до одного нуклеотида. Существующие в настоящее время физические и химические методы не применимы из-за их низкой точности (погрешность составляет несколько десятков нуклеотидов). Теперь стало возможным вырезать отдельные участки ДНК, а затем сшивать их так, как того требуют цели эксперимента. В результате получаются длинные рекомбинантные молекулы, состоящие из фрагментов ДНК, выделенных из разных организмов. Сшивают эти фрагменты неспецифическим ферментом ДНК – лигазой. Таким способом, можно создать любые комбинации генов, которые никогда не реализовывались в живой природе из-за запрета на межвидовое скрещивание. Но создание рекомбинантной ДНК – это только начальный этап технологической цепочки. Необходимо сделать так, чтобы она была биологически активной и могла размножаться в составе живой клетки, да еще перестроить молекулярно-генетический аппарат и механизм ее функционирования. Прорыв генной инженерии в этом направлении связан с открытием плазмидов. Плазмиды – внеядерные ДНК, способные к автономному размножению, которыми бактериальные клетки обмениваются друг с другом. Интерес к плазмидам возник в связи с обнаружением устойчивости бактерий к антибиотикам, делающей лечение ими пациентов неэффективным. Исследования показали, что в бактериях существует ген устойчивости к различным антибиотикам. Причем эти гены всегда располагаются в плазмидах. Способность плазмидов свободно переходить из одной бактерии в другую ведет к быстрому увеличению числа бактерий с генами устойчивости, что является причиной неэффективности применения антибиотиков.
Изучение плазмид показало, что они представляют собой самостоятельные организмы особого типа. До них считалось, что простейшими объектами живой природы являются вирусы, состоящие из нуклеиновой кислоты (ДНК или РНК), помещенной в белковую оболочку. Вне клетки вирус – это комплекс сложных молекул, объект неживой природы. Однако, попадая в клетку живого организма, он начинает интенсивно размножаться. Он, используя ферментативный аппарат клетки-хозяйки, переключает ресурсы клетки на синтез вирусных частиц – варионов. Плазмида вне клетки – это просто молекула ДНК. Внутри клетки она ведет себя вполне рационально; используя ресурсы клетки для своего размножения, плазмиды ограничивают свои потребности, чтобы не погубить клетку. В этом отношении она ведет себя совершенно иначе, чем вирус, способный привести клетку к гибели. Плазмида в благоприятных условиях существует и размножается вместе с бактерией-хозяйкой. Но если бактерия попадает в среду антибиотика, например, в среду пенициллина, то плазмида немедленно активизируется на борьбу с ним. Вырабатываемый ею фермент, пеницил-линаза, разрушает пенициллин, спасая бактерию от гибели. Поэтому совместное сосуществование плазмиды и бактериальной клетки – это взаимовыгодный союз (симбиоз). ДНК-плазмиды оказались теми простейшими организмами, которые легко переносят встройку в них чужеродных ДНК (генов). Более сложные организмы, даже вирусы, такую операцию переносят болезненно. Это уникальное свойство плазмиды делает ее незаменимой в генной инженерии, где она используется в качестве вектора. Вектор – это просто извлеченная из бактерии само-реплицирующаяся ДНК-плазмида, в которую встраивается чужеродный ген, выделенный из ДНК любого организма. В результате получается рекомбинантная ДНК, которую вводят в клетку организма-реципиента, наследственные свойства которого желают изменить. В качестве таковых могут служить те же бактериальные клетки. Рекомбинантные ДНК, введенные в бактерии, интенсивно размножаются вместе с бактерией-хозяйкой и получают необходимое число копий с участка чужеродного ДНК (гена). Эта процедура получила название клонирования. Встраивание гена в вектор происходит следующим образом (рисунок 133). Кольцевая молекула ДНК вектора разрезается так, чтобы концы ДНК были липкими и были комплементарны концам вводимого гена. Затем ген и ДНК вектора посредством ДНК лигазы сшивают в целостное образование – рекомбинантную ДНК. Рекомбинантные ДНК переносят в клетки организма-реципиента различными способами. Но прежде чем осуществить клонирование нужного гена, молекулярной биологии необходимо было решить проблему ДНК. Дело в том, что к началу 70-х годов в молекулярной генетике возникла парадоксальная ситуация. К этому времени уже были расшифрованы генетический код и многие аминокислотные белковые последоваельности. Но самая главная молекула – ДНК представляла собой «черный ящик»: не было расшифровано ни одной нуклеотидной последовательности ДНК.
Сложность проблемы расшифровки ДНК состояла в том, что она очень длинная и состоит из десятков тысяч нуклеотидов. На помощь генетикам пришла рестриктаза, с помощью которой длинные ДНК разрезались на короткие фрагменты. Оставалось решить еще две проблемы: разделять фрагменты и определять нуклеотидные последовательности в них. Разделение фрагментов ДНК по длинам удалось решить электрофорез-методом. Молекула ДНК несет на себе отрицательный заряд, причем величина заряда пропорциональ-на длине цепочки. Связано это с тем, что в каждом мономере происходит диссоциация водорода фосфатной группы, которая заряжается отрицательно. Если поместить смесь фрагментов разной длины в электрическое поле конденсатора, то она распадется на несколько скоплений фрагментов, в каждом из которых молекулы будут иметь строго одинаковую длину. В первое время такому способу разделения фрагментов мешало броуновское движение молекул. Использование геля большой вязкости как среды, в которой проводится электрофорез фрагментов ДНК, практически исключило влияние броуновского движения. В конце 70-х годов, наконец была решена проблема прочтения нуклеотидной после-довательности ДНК. Идентифицируемые молекулы гибридизируют радиоактивными или флуоресцентными метками. Были разработаны методы секвенирования – выделения нук-леотидных последовательностей. Суть метода заключается в следующем. Химическим способом расщепляют ДНК в первом случае по А, во втором – по Т, в третьем – по Г и в четвертом – по Ц (рису-
Полученные образцы подвергают электрофорезу на параллельных дорожках одного геля. При этом определяется, на какой из дорожек расположена полоса. Анализируя результаты электрофореза, можно установить последовательность нуклеотидов ДНК. В настоящее время процесс секвенирования автоматизирован и удается идентифицировать около 106 пар нуклеотидов в день. Получение рекомбинантной ДНК и внедрение ее в избранную клетку организма-реципиента с целью изменения его наследственного аппарата является основой генной инженерии – нового направления молекулярной биологии. Методы генной инженерии открывают новые пути решения проблем биотехнологии, медицины, сельского хозяйства и клонирования. Свойство гибридной ДНК синтезировать в клетке-хозяина кодируемый ею белок широко используется для получения ферментов, витаминов, аминокислот, антибиотиков и т.п. Например, человеческие белки инсулин и интерферон были получены микробиологическим синтезом в клетках бактерий, несущих рекомбинантную ДНК с соответствующим геном человека. Свойства самих бактерий могут быть изменены в сторону сверхсинтеза нужного микробного препарата. На этих основах перспективно промышленное получение других биологически активных веществ (гормональных препаратов, соединений, стимулирующих иммунитет и т.п.). Успешное развитие методов генной инженерии в недалеком будущем окажет заметное влияние на развитие медицины и сельского хозяйства. В области медицины, кроме синтеза лекарственных препаратов, разрабатывается проблема генотерапии. Генотерапия – это метод лечения людей с наследственными дефектами обмена веществ, путем введения в их клетки нормальных генов. Важнейшим направлением генной инженерии является изменение наследственных свойств живых организмов и растений путем введения в половую клетку рекомбинантных генов. В результате таких технологий получают трансгенные организмы, которые переда-ют приобретенные ими гены своему потомству. Технология получения трансгенных животных и растений открывает широкие возможности перед селекционерами. Другим направлением генетических технологий является клонирование животных и растений. Клоны – это организмы, происшедшие от общего предка путем бесполого размножения. Широко известным примером клонирования стало появление на свет овечки Долли в Шотландии в 1997 г. Ученые осуществили научный прорыв в генетике, воссоздав полноценный живой организм на основе одной тканевой клетки. Как известно из биологии, человек или животное рождается путем слияния двух половых клеток: отцовского сперматозоида и материнской яйцеклетки. При этом будущий организм (например, человек) получает от каждого родителя по 23 хромосомы, которые образуют его геном (совокупность генов). С момента слияния и до конца жизни гены станут управлять организмом, не только формируя во всех деталях и подробностях этот организм, но программируя способности, наклонности, таланты и т.п. Клонирование животных и растений неоднократно проводилось и до овечки Долли. Однако во всех этих случаях клонирование проводилось путем замены гаплоидного ядра яйцеклетки на диплоидное ядро, взятое из клеток эмбрионов. Клетки эмбрионов в силу своей недифференцированности способны выполнять функцию диплоидного ядра, только что оплодотворенной яйцеклетки. В случае с Долли ядро, выделенное из клеток вымени одной овцы, было пересажено в яйцеклетку второй овцы, предварительно удалив оттуда собственное ядро. Сенсационность этого открытия заключается в том, что в целях клонирования была использована неполовая клетка сформировавшегося организма с определенными фенотипическими признаками. Можно считать, что найдено глобальное решение проблемы бесплодия. Каждый мужчина и каждая женщина с любой неизлечимой патологией органов деторождения теперь способны стать родителями. Причем не приемными или суррогатными, а самыми настоящими: воспроизвести свои собственные генотип и фенотип в полном смысле слова. Появилась возможность клонирования растений, животных, обладающих ценными для человека признаками. Значит ли это, что можно по своему выбору клонировать человека, например, гения. Да, никаких преград теоретического характера на этом пути не существует. Практически же потребуются многие годы напряженной работы, чтобы клонирование человека стало реальностью. При постановке вопроса о клонировании следует учитывать возможные отрицательные последствия манипулирования генами, которые недостаточно изучены. Кроме того, это сопряжено с морально-этическими, религиозными нормами и соображениями. Человек, с одной стороны, явление биологическое, а с другой – социальное. Сейчас трудно сказать, как наше общество отнесется к появлению в его составе клонированных людей. Одно дело – селекционная работа по улучшению пород животных и растений и совсем другое – целенаправленное избирательное воздействие на человеческую популяцию. И совершенно непонятно, кто будет решать, кого надо клонировать, а кого – нет и в каком количестве. Не удается также воспроизвести двойников Пушкина, Эйнштейна и других гениев в виде их клональных копий. Гений – не только редкий и уникальный набор генов, но и среда, в которой задатки гениальности раскрылись, и потенциальная возможность стала действительностью.
|
|||||||||||
|
Последнее изменение этой страницы: 2021-05-12; просмотров: 43; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.22.242.141 (0.03 с.) |
 РНК
РНК  Рисунок 133
Рисунок 133
 Рисунок 134
Рисунок 134



