Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Молекулярная структура биологических систем
Основу жизни представляют биополимеры – длинные молекулы белков и нуклеиновых кислот, слагающиеся из мономеров – аминокислот и нуклеотидов. Основными компонентами живых систем являются белки, нуклеиновые кислоты, углеводы и жиры. Химический процесс, который ведет к связыванию мономеров и олигомеров с выделением воды (дегидратацией), называется конденсацией. Белки. Во всех живых организмах белки играют исключительно важную роль: они участвуют в построении клеток, тканей и органов; являются биокатализаторами (ферментами) многих тысяч биохимических реакций; выполняют транспортные функции (гемоглобины); являются гормонами и защитными веществами (иммуноглобулины) и др. Существуют тысячи белков и у каждого – своя, только ему свойственная функция. Важнейшей функцией белков является структурная. Волосы, ногти, наружный слой кожи, все они состоят из кератина. Около одной трети всего белка, который содержится в теле животного, приходится на другой белок – коллаген. Прочные волокна коллагена можно обнаружить в костях, хряще, сухожилиях и других соединительнотканных образованиях. К кератину и коллагену следует отнести и альбумин, обладающий большой растворимостью, определяющей вязкость его концентрированных растворов. Альбумин участвует в направлении потока жидкостей и отходов процесса обмена веществ из клеток к капиллярным венулам. Мышечные волокна построены из миофибрилл, которые почти полностью состоят из двух белков – миозина и актина. Почти весь строительный материал состоит из белков, даже хромосомы состоят наполовину из белков – гистонов. Клетка состоит из сложных химических соединений, которые ей приходится синтезировать из относительно простых веществ. Сахара, крахмал, жиры, витамины, гормоны, белки – это все конечные продукты многочисленных химических реакций. К этому следует добавить еще множество реакций, связанных с расщеплением сложных веществ с целью выведения их из организма или для использования заключенной в них энергии. Физические условия внутри клеток не способствуют быстрому протеканию реакций. Внутриклеточная среда обычно нейтральна, температура ее невысока – 37 оС у теплотворных животных, включая человека, и значительно ниже у холоднокровных животных и растений. В этих условиях большинство реакций идет очень медленно. И тем не менее химические реакции в живых клетках протекают чрезвычайно быстро, благодаря участию биокатализаторов – ферментов. При этом скорость этих реакций может увеличиваться в миллионы и даже в десятки миллионов раз. Клетки содержат многие тысячи ферментов. Фактически каждую химическую реакцию, осуществляемую в живом организме, катализирует свой специфический фермент. Все ферменты являются белками.
Гемоглобин выполняет транспортную функцию по переносу кислорода в крови, который необходим клеткам животных. Он нужен митохондриям, чтобы осуществлять окисление питательных веществ до углекислоты и воды. По системе сосудов кровь проникает во все участки тела, доставляя клеткам питательные вещества и кислород. Но если бы весь гемоглобин, необходимый для транспорта кислорода, был растворен непосредственно в плазме крови, то кровь сделалась бы очень вязкой и ее невозможно было бы проталкивать через сосуды. Поэтому гемоглобин «упакован» в красные кровяные тельца – эритроциты. Гемоглобин забирает кислород в легких, где его концентрация высока, и освобождается от него в тканях, где она ниже. Гемоглобин так чувствителен к изменениям концентрации кислорода, что отдает его больше тем тканям, которые в нем больше нуждаются, например, работающим мышцам. Другой очень сходный с гемоглобином белок, миоглобин, тоже красного цвета и тоже содержащий железо, находится в мышцах. Присоединяя кислород, миоглобин создает его резерв в мышечной ткани. Гормоны (от греч. – возбуждаю, привожу в движение) – это биологически активные вещества, вырабатываемые в организме специализированными клетками или органами (железами внутренней секреции). Они оказывают целенаправленное влияние на жизнедеятельность других органов и тканей. Позвоночные животные и человек имеют высокоразвитую систему желез (гипофиз, надпочечники, половые, щитовидная и другие). Они посредством гормонов, выделяемых в кровь, участвуют в регуляции всех жизненно важных процессов – роста, развития, размножения, обмена веществ. Каждый из гормонов влияет на организм в сложном взаимодействии с другими гормонами. В целом гормональная система совместно с нервной системой обеспечивает деятельность организма как единого
Важнейшую роль в борьбе организма с болезнью, особенно в явлениях иммунитета, играют циркулирующие в крови белки, называемые антителами. Антитела вырабатываются в ответ на проникновение в организм чужеродных веществ, называемых антигенами. Носителями антигенов могут быть вирусы, бактерии, а также эритроциты, попадающие в организм при переливании крови, если группа крови донора несовместима с группой крови больного. Антигеном может быть чужеродный белок, например, бактериальный токсин. Антитела вырабатываются в самом организме или вводятся в него в готовом виде с прививками. Специфичность – типичное свойство антител. Они реагируют только с теми антигенами, которые вызвали их синтез. Антитело, соединяясь с антигеном, образуют стойкий комплекс антиген–антитело. Чужеродные белки, токсины, соединившись с антителами, становятся безвредными. Белки представляют собой биополимеры, состоящие из аминокислот. Молекулы аминокислот включают группы атомов с противоположными свойствами. Одна – карбоксилфункциональная группа, с отчетливо выраженными свойствами кислоты (СООН). Другая – аминогруппа (NH2), напротив, придает соединению свойства основания. Общая структурная формулами аминокислот R | Н – С – СО2 – | NH3+
Отметим, что при комнатной температуре и нейтральном РН карбоксильная группа Перечень аминокислот, выделенных из природных белков, и их генетический код приведены в таблице 12. Соединение двух аминокислот осуществляется пептидной связью. При этом образу-ется молекула воды путем объединения атома кислорода карбоксильной группы одной аминокислоты и атомов водорода аминогруппы другой аминокислоты (Н+ + ОН- = Н2О). Продукт этой реакции – дипептид – содержит пептидную связь, ответственную за объединение аминокислот в белки:
R1 О R2 О R1 O R2 О | // | // | || | // Н3N+ – C – C + Н2 N+ – C – C | \ | | \ | | | \ H О- H H О- H H H О-
аминокислота I аминокислота II дипептид вода
O || – C – N – | H пептидная связь Пептидные связи между аминокислотами, образующими белки, возникают между карбоксильной и аминогруппами и не затрагивают R-группы. Простейшая аминокислота – глицин; в ней R-группа – это просто атом водорода (Н). Полипептиды, или белки, – это цепочки из многих аминокислот, соединенных пептидными связями:
| | || | || | || | || | || | || Н N+ – C – C – N – C – C – N – C – C – N – C – С – N – C – C – N – C – C – O- | | | | | | | | | | | | H H H H H H H H H H H H
При образовании полипептида из n -аминокислот освобождается n –1 молекул воды. Обратный процесс – расщепление полипептида на составляющие его аминокислоты и присоединение воды – называется гидролизом. В настоящее время известно бесчисленное множество белков, составленных всего из 22 аминокислот. Чем же отличаются белки друг от друга? Не только составом, и даже не столько составом, сколько взаимным чередованием аминокислот. В строении молекул белков различают четыре уровня организации. Первичная структура – под этим термином понимают аминокислотный состав белка и тот порядок, в котором аминокислоты в полипептидной цепи следуют друг за другом. На одном конце цепи находится аминокислота, в которой свободной является аминогруппа. Это N-конце-вая аминокислота. С другого конца цепи расположена аминокислота, в которой аминогруппа связана со всей молекулой, а карбоксильная группа свободна. Это С-концевая аминокислота
N – конец С – конец
Первичная структура белка записывается, как последовательность аминокислот, причем перечисление аминокислот начинают с N-конца и заканчивают С-концом (рисун-
Для обозначения аминокислот в формулах белков используют их сокращенные названия, которые приведены в таблице 12. В настоящее время расшифрованы первичные структуры многих сотен белков, большинство из которых являются ферментами. Знание структуры позволяет понять механизм их действия в процессе, происходящим в клетке. Кроме того, синтез белка невозможно осуществить, не зная его первичной структуры. В 1958 г. английский ученый Сэнгер был удостоен Нобелевской премии по химии за расшифровку первичных структур белков. Конфигурация белковой молекулы в пространстве во многом определяется сходством строения аминокислот. Во-первых, во всех аминокислотах аминогруппа находится по отношению к карбоксилу в так называемом Молекулы белков укладываются в спирали так, что атомы углерода с карбонильным кислородом, асимметрические атомы углерода и атомы азота образуют остов этой спирали, а все остальные группы отходят в стороны от этого цилиндра. Между кислородом карбонильной группы и водородом аминогруппы возникает водородная связь. Эта связь гораздо слабее ковалентной связи и одну водородную связь легко разорвать. Но вдоль белковой молекулы таких водородных связей сотни, поэтому спиральная структура белка довольно устойчива.
В результате отдельные участки спирали сближаются, молекула изгибается и свертывается в клубок. Формируется третичная структура белка. На рисунке 120б3 показана третичная структура миоглобина. У каждого белка своя последовательность аминокислот, а значит, и боковые группы расположены различным образом. Таким образом, первичная структура белка, в конечном счете, определяет его третичную структуру. Третичная структура – не самая высшая ступень организации белковой молекулы. Многие белки состоят из нескольких полипептидных цепей, которые сворачиваются в единый комплекс. Так, молекула гемоглобина состоит из четырех полипептидных цепей, свернутых в глобулу. Способ пространственной организации нескольких полипептидных субъединиц – это четвертичная структура белка.
Нарушение природной структуры белка называется денатурацией. Она может возник-нуть под действием высокой температуры, химических веществ и т.д. Белки могут служить источником энергии для клетки. При недостатке углеводов и жиров окисляются молекулы аминокислот. Освободившаяся при этом энергия используется на поддержание процессов жизнедеятельности организма. Углеводы. Другими строительными блоками живой материи являются сахара – 1. Энергетическая функция. Энергия, заключенная в химических связях продуктов питания, высвобождается в организме и используется для поддержания его жизнедеятельности. Во многих видах продуктов содержится значительное количество крахмала. 2. Структурная функция. Во всех без исключения тканях и органах обнаружены углеводы, их производные. Рибоза и дезоксирибоза играют важную роль в качестве составных частей нуклеиновых кислот (ДНК и РНК). Углеводы входят в состав оболочек клеток и субклеточных образований. Принимают участие в синтезе многих органических соединений. В растениях полисахариды выполняют и опорную функцию. 3. Защитная функция. Вязкие секреты (слизи), выделяемые различными железами, богаты углеводами и их производными, в частности, гликопротеидами. Они предохраняют стенки полых органов (пищевод, кишки, желудок, бронхи) от механических повреждений, проникновения вредных бактерий и вирусов. Состав подавляющего большинства сахаров можно выразить общей формулой С n (Н2О) m . Различия между сахарами едва уловимы. Глюкоза и галактоза, например, имеют почти одинаковую структуру. Обе содержат цепочку из шести углеродных атомов, к пяти из которых присоединены гидроксильные группы (ОН), а шестой соединен двойной связью с кислородом (О), образуя альдегидную группу >С = О. И все же глюкоза и галактоза различны, и это различие может определить судьбу ребенка с редкой наследственной болезнью галактоземией. Такие дети не усваивают галактозу, которая содержится в молоке. Если они получают пищу, в которой галактоза заменена другим сахаром (например, глюкозой), то они развиваются нормально, если же получают обычную пищу, становятся слабоумными. Различие между глюкозой и галактозой заключается в пространственной конфигурации асимметричного углеродного атома. В молекуле глюкозы четыре неравноценных асимметрических атома углерода. Значит, для такого соединения возможно 24 = 16 стереоизомеров, которые образуют 8 пар зеркально оптических антиподов. Каждое соединение из восьми представляет диастереомер, с присущими только ему физическими свойствами (растворимость, температура плавления, температура кипения и т.п.). Глюкоза, как и галактоза, являются диастереомерами обширного семейства гексоз, то есть углеводов с шестью углеродными атомами. Помимо глюкозы и галактозы в это семейство входят аллоза, альтроза, манноза, гулоза, идоза и талоза. Каждое из этих соединений существует в виде двух оптических антиподов, различающихся только знаком вращения плоскости поляризации света (влево или вправо). Интересно отметить, что в природе встречаются только D-сахара, L-антиподы были получены синтетически, и они организмами не усваиваются, а некоторые из них даже ядовиты. Сахара могут различаться и по другим особенностям структуры. Обычно в молекуле сахара гидроксильные группы имеются при всех углеродных атомах, кроме одного, соединенного двойной связью с атомом кислорода. В глюкозе и галактозе кислород, присоединенный двойной связью, находится у первого углеродного атома. В молекуле фруктозы такой кислород связан не с первым, а со вторым углеродным атомом. Не все сахара
Рисунок 121
Шестиугольники или пятиугольники лежат в плоскости, перпендикулярной к плоскости чертежа (ближайшую к читателю связь между углеродными атомами обозначают утолщенной линией. Семейство углеводов, содержащее в цепи более трех атомов углерода, может быть синтезировано из глицеринового альдегида (триозы) путем наращивания углеродной цепи на один, два или три атома. Глюкоза, фруктоза и ряд других углеводов – это своего рода фрагменты, мономеры, из которых построены длинные цепи полисахаридов – соединений, играющих важную роль в живой природе. Молекула обычного сахара, или сахарозы, составлена из двух более простых углеводов: Если соединить в цепочку большое число звеньев Если для построения такой гигантской молекулы использовать не Основания, нуклеозиды и нуклеотиды. В 1868 г. Ф. Мишер из клеточных ядер выделил нуклеиновые кислоты, а Коссель в 1879 г. определил их основные составные части: фосфорная кислота, пуриновые и пиримидиновые основания и сахара. В начале XX в. Левин устанавливает, что в клетках имеются два вида нуклеиновых кислот. В состав первой в ка-честве сахара входит D-рибоза, углеводный компонент второй кислоты D-дезоксирибоза. В конце 30-х годов была определена молекулярная масса нуклеиновых кислот. Для дезоксирибонуклеиновой кислоты (ДНК) она оказалась равной сотням тысяч и даже миллионам атомных единиц массы ( Открытие наследственной функции нуклеиновых кислот тесно связано с чисто медицинскими исследованиями. В 20-е годы интенсивно изучалась природа пневмонии – воспаления легких. Возбудителями этой болезни были пневмококки. Однако среди них Более убедительными оказались опыты с вирусами, поражающими бактерии, – бактериофагами. Вирус (фаг) состоит из молекулы ДНК, заключенной в белковую оболочку, и впрыскивает свой генетический материал при его внедрении в подходящую клетку. Для различения белка оболочки и ДНК у вирусов использовали радиоактивные изотопы серы и фосфора. Связано это с тем, что белки содержат серу, но не содержат фосфор, а ДНК, наоборот, содержит фосфор, но не серу. В 1952 г. А. Херши и М. Чейз изучали фагов, растущих в бактериях. При этом в белок оболочки входила радиоактивная сера, а в ДНК радиоактивный фосфор. Оказалось, что в бактериальные клетки проникал только радиоактивный фосфор, это означало, что генетический материал состоит из ДНК. Перед молекулярной биологией встал вопрос, в какой форме записана наследственная информация в ДНК и как она реализуется. Чтобы ответить на этот вопрос необходимо установить, как устроена ДНК и каковы ее структурные элементы. Макромолекулы ДНК и РНК состоят из мономеров, которые называются нуклеотидами. Нуклеотиды, составные элементы генетического материала всех живых организмов, содержат три мономера: азотистое основание (пурин или пиримидин), сахар и фосфат (
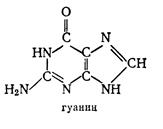
Гетероциклы входят в состав важнейших в биологическом отношении соединений, к ним относятся: аденозинтрифосфат (АТФ), никотинамиддиннуклеотид (НАД), аминокислоты и составленные части нуклеиновых кислот аденин, гуанин, тимин, цитозин и урацил. Ниже приводятся строительные блоки важнейших биологических молекул ДНК и РНК. Липиды – жиры и жироподобные вещества представляют собой биоорганические соединения с различной структурой, но общими свойствами. Они не растворимы в воде, но хорошо растворяются в неполярных органических растворителях: эфире, бензине, бензоле и др. По химической структуре жиры представляют собой сложные эфиры трехатомного спирта глицерина и высокомолекулярных жирных кислот (триглицеридов). Например, стеарин получается в реакции между глицерином и стеариновой кислотой
глицерин стеариновая стеарин вода кислота
Липиды могут быть как насыщенными, так и ненасыщенными. Стеариновая и пальмитиновая кислоты являются насыщенными (предельными), а олеиновая Биологически важными жироподобными веществами являются фосфолипиды, которые от остальных жиров отличаются тем, что содержат остаток фосфорной кислоты. Они основные компоненты мембран клеток. Гликолипиды состоят из углеводов и липидов. Они являются строительным материалом тканей мозга и нервных волокон. В живых организмах важную роль играют липопротеиды, представляющие собой комплексные соединения различных белков с жирами. Липиды выполняют различные функции, среди которых наиважнейшими являются структурная и энергетическая. Липиды принимают участие в построении мембран клеток всех органов и тканей. Ониобеспечивают 25–30 % всей энергии, необходимой организму. При полном распаде 1 г жира вырабатывается более 3 кДж энергии, что более чем в два раза превосходит энерговыделение глюкозы и белков. Жир, который накапливается в подкожной клетчатке животных организмов, является, с одной стороны, превосходным аккумулятором энергии, а, с другой, выполняет функцию теплоизоляции. Жиры выполняют еще множество функций. Они являются источником эндогенной воды: при окислении 100 г жира выделяется около 100 мл воды. Благодаря такой воде существуют многие пустынные животные. Многие биологически активные вещества (витамины А, D, Е, гормоны половых желез и коры надпочечников и др.). по своим физико-химическим свойствам представляют собой липидные соединения.
Энергетический метаболизм
Первичным источником энергии в живых организмах является Солнце. Солнечное излучение в виде потока фотонов поглощается пигментом хлорофиллом, содержащимся в хлоропластах зеленых растений, и аккумулируется в химических связях различных биологических веществ. Все клетки и организмы подразделяются на два основных класса в зависимости от того, каким источником они пользуются. У первых, называемых аутотрофными (зеленые растения), углекислый газ и вода превращаются в процессе фотосинтеза в органические молекулы глюкозы, из которых образуются затем более сложные молекулы. Клетки второго класса, называемые гетеротрофными (животные клетки), получают энергию из различных питательных веществ (углеводов, жиров и белков), синтезируемых аутотрофными организмами. Энергия, содержащаяся в этих органических молекулах, освобождается главным образом в результате их окисления в процессе аэробного дыхания. Большинство клеток используют в первую очередь углеводы. Полисахариды в процессе клеточного дыхания будут гидролизованы до глюкозы. Жиры начинают использоваться организмом лишь после того, как запас углеводов исчерпан. Поскольку белки выполняют множество других важных функций, они используются в качестве питания довольно редко, например, при длительном голодании. Таким образом, основным источником энергии в живых организмах является глюкоза. Повысилось содержание глюкозы – инсулин полимеризует глюкозу в животный крахмал – гликоген, который откладывается в печени. Понизилось содержание глюкозы – часть гликогена в печени гидролизуется в глюкозу, которая обратно поступает в кровь. Если поджелудочная железа не может вырабатывать в достаточном количестве инсулин, содержание глюкозы в крови повышается, что приводит к болезни – сахарному диабету. Поэтому больным диабетом вводят в кровь лекарство инсулин. Молекула глюкозы, попавшая в клетку организма, окисляется, «сгорает» с образованием, в конечном счете, диоксида углерода и воды. Сгорая, глюкоза выделяет энергию, необходимую организму, чтобы осуществлять различные биологические процессы. Но биологическое окисление похоже на обычное горение лишь по своим конечным результатам. На этом сходство кончается, и начинаются принципиальные отличия. Биологическое окисление – процесс медленный, многоступенчатый, и лишь небольшая часть энергии, высвобожденной при окислении, превращается на каждой стадии в тепло. Довольно значительная часть энергии, заключенной в химических связях глюкозы, расходуется на образование других веществ, из которых важнейшее в биоэнергетике – аденозинтрифосфатная кислота (АТФ). Это соединение состоит из трех частей – аденина, рибозы и трех остатков фосфорной кислоты. АТФ является универсальным аккумулятором энергии в живом организме. В химических связях между остатками фосфорной кислоты молекулы АТФ запасена энергия, которая освобождается при отщеплении органического фосфата,
где Ф – фосфат; W – энергия.
Ситуация до некоторой степени напоминает электрический аккумулятор: расщепляя АТФ, клетка использует высвобождаемую при этом энергию на биосинтез различных соединений – аккумулятор разряжается, а окисляя углеводы, клетка синтезирует АТФ – аккумулятор заряжается. Единый процесс энергетического обмена можно условно разделить на три последовательных этапа. На первом этапе биополимеры в цитоплазме под действием соответствующих ферментов расщепляются на мономеры. На этом этапе выделяется незначительное количество энергии, которая рассеивается в виде тепла. Второй этап бескислородный. На этом этапе образовавшиеся мономеры – глюкоза, аминокислоты, глицерин, жирные кислоты и нуклеотиды подвергаются дальнейшему ферментативному распаду без доступа кислорода. Примером может служить ферментативное окисление глюкозы (гликолиз), которое является одним из основных источников энергии для всех живых клеток. Гликолиз – многоступенчатый процесс расщепления глюкозы в анаэробных (бескислородных) условиях до пировиноградной кислоты (ПВК), а затем до молочной, уксусной, масляной кислот или этилового спирта, происходящий в цитоплазме клетки. Переносчиком электронов и протонов в этих окислительно-восстановительных реакциях служит никотинамидадениндинуклеотид (НАД) и его восстановительная форма НАД·Н. Суммарная реакция гликолиза имеет следующий вид:
|
||||||||||||||||||
|
Последнее изменение этой страницы: 2021-05-12; просмотров: 55; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.141.199.243 (0.067 с.) |
|||||||||||||||||||
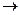 Н3N+ – C – С – N – C – C + Н2 O
Н3N+ – C – С – N – C – C + Н2 O










 H R О R O R O R O R O R O
H R О R O R O R O R O R O





 а)
а)
 б)
б)
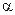 -положении (т.е. разделены они только одним атомом углерода, к которому присоединены все остальные группировки). И второе, у всех аминокислот группы вокруг асимметрического атома углерода расположены одинаковым образом (L-конфигурация). Оба эти свойства структуры аминокислот играют решающую роль в образовании, характерной для белков, упорядоченной структуры. Эта структура –
-положении (т.е. разделены они только одним атомом углерода, к которому присоединены все остальные группировки). И второе, у всех аминокислот группы вокруг асимметрического атома углерода расположены одинаковым образом (L-конфигурация). Оба эти свойства структуры аминокислот играют решающую роль в образовании, характерной для белков, упорядоченной структуры. Эта структура –  -структурой, она также открыта американским ученым Лайнусом Полингом. Способ пространственной упаковки аминокислотных остатков –
-структурой, она также открыта американским ученым Лайнусом Полингом. Способ пространственной упаковки аминокислотных остатков – 
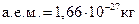 ). Вторая кислота, названная рибонуклеиновой (РНК) оказалась значительно легче – ее молекулярная масса от 20 до 20000
). Вторая кислота, названная рибонуклеиновой (РНК) оказалась значительно легче – ее молекулярная масса от 20 до 20000  Было установлено, что ДНК сосредоточена в ядре, в то время как РНК содержится в цитоплазме клетки. В сороковые годы показано, что в растениях и в животных содержатся одни и те же нуклеиновые кислоты двух видов – ДНК и РНК.
Было установлено, что ДНК сосредоточена в ядре, в то время как РНК содержится в цитоплазме клетки. В сороковые годы показано, что в растениях и в животных содержатся одни и те же нуклеиновые кислоты двух видов – ДНК и РНК. ). Азотистые основания (аденин и гуанин) – это производные пурина, а три других (тимин, цитозин и уралил) – производные пиримидина. Химические соединения пиримидин и пурин относятся к гетероциклическим. Это означает, что в цикл включены неуглеродные атомы (гетероатомы). Например, если в молекуле бензола заменить две группы СН на азот N, то получим три различных соединения (изомеры), одним из которых является пиримидин. Известны гетероциклы, содержащие не шесть членов в цикле, а пять. В качестве гетероатома в пятичленных гетероциклах может выступать не только азот, но и кислород (фуран), и сера (тиофен). Наибольший интерес для нас представляет продукт конденсации шестичленного гетероцикла пиримидина с пятичленным имидазолом – пурин. Структурные формулы пуринов (II) и пиримидинов (I) имеют вид
). Азотистые основания (аденин и гуанин) – это производные пурина, а три других (тимин, цитозин и уралил) – производные пиримидина. Химические соединения пиримидин и пурин относятся к гетероциклическим. Это означает, что в цикл включены неуглеродные атомы (гетероатомы). Например, если в молекуле бензола заменить две группы СН на азот N, то получим три различных соединения (изомеры), одним из которых является пиримидин. Известны гетероциклы, содержащие не шесть членов в цикле, а пять. В качестве гетероатома в пятичленных гетероциклах может выступать не только азот, но и кислород (фуран), и сера (тиофен). Наибольший интерес для нас представляет продукт конденсации шестичленного гетероцикла пиримидина с пятичленным имидазолом – пурин. Структурные формулы пуринов (II) и пиримидинов (I) имеют вид
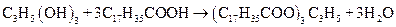


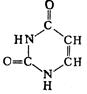 урацил
урацил
 и некоторые другие – непредельными. У насыщенных жирных кислот температура плавления выше, чем у непредельных, поэтому жиры, образованные этими кислотами, находятся в твердом состоянии в естественных условиях их существования. Такие жиры входят в состав живых клеток. Жидкие непредельные жиры называются маслами и содержатся в основном в растениях, хотя встречаются у животных (например, в составе молока).
и некоторые другие – непредельными. У насыщенных жирных кислот температура плавления выше, чем у непредельных, поэтому жиры, образованные этими кислотами, находятся в твердом состоянии в естественных условиях их существования. Такие жиры входят в состав живых клеток. Жидкие непредельные жиры называются маслами и содержатся в основном в растениях, хотя встречаются у животных (например, в составе молока).