
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Повышенный уровень сложности. 34. Изомерами вещества, молекулярная формула которого С8Н18Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
34. Изомерами вещества, молекулярная формула которого С8Н18, являются
35. Метан можно получить, используя
36. Этан можно получить, используя
37. Для алканов характерны
38. Для метана характерны
39. Для гептана характерны
40. И для этана, и для гексана характерны
41. Объем воздуха (н.у.), необходимый для полного сгорания 40 л (н.у.) этана, равен _________ л. (Запишите число с точностью до целых.)
42. Объем углекислого газа (н.у.), образующегося при сгорании 10 л пропана в 60 л (н.у.) кислорода, равен _________ л. (Запишите число с точностью до целых.)
43. Объем бутана, который можно сжечь в кислороде объемом 65 л (н.у.), равен _________ л. (Запишите число с точностью до целых.)
44. Объем кислорода (н.у.), необходимый для полного сгорания 200 л (н.у.) смеси этана и азота, содержащей 40% по объему этана, равен _________ л. (Запишите число с точностью до целых.)
45. Объем кислорода (н.у.), необходимый для полного сгорания 400 л (н.у.) смеси метана и бутана, содержащей 25% по объему метана, равен _________ л. (Запишите число с точностью до целых.)
46. Карбид алюминия массой 28,8 г полностью прореагировал с соляной кислотой. Объем (н.у.) газа, выделившегося в результате реакции, составил _________ л. (Запишите число с точностью до сотых.)
47. Ацетат натрия массой 41 сплавили с избытком гидроксида натрия. Масса газа, выделившегося в результате реакции, составила _________ г. (Запишите число с точностью до целых.)
48. В результате пиролиза 60 л (н.у.) метана с выходом 80% получили ацетилен, объем (н.у.) которого составил _________ л. (Запишите число с точностью до целых.)
49. Масса газа, полученного по реакции Вюрца между 4,75 г бромметана и 3,0 г натрия, равна _________ г. (Запишите число с точностью до сотых.)
Высокий уровень сложности
50. (С3) Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения: C → карбид алюминия Укажите условия протекания реакций.
51. (С3) Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения: СО → C2H6 Укажите условия протекания реакций.
52. (С3) Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения: CH4 Укажите условия протекания реакций.
53. (С3) Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения: C3H7COONa Укажите условия протекания реакций.
54. (С4) Углекислый газ, полученный в результате полного сгорания 3,36 л (н.у.) смеси метана и этана, в которой объемное соотношение газов равно 1:2, пропустили через раствор гидроксида натрия объемом 152,7 мл с массовой долей NaОН 12,0% (плотность 1,31 г/мл). Определите массовые доли веществ в полученном растворе.
55. (С4) Углекислый газ, полученный в результате полного сгорания 0,896 л (н.у.) смеси пропана и бутана, пропустили через избыток известковой воды. В результате выпал осадок массой 14,0 г. Определите объемные доли газов в исходной смеси. 50% пропана, 50% бутана. 56. (С4) Ацетат натрия массой2,46 г сплавили с гидроксидом натрия массой 2,0 г. Твердый остаток растворили в 50 г воды. Определите массовые доли веществ в полученном растворе.
57. (С4) Пропионат калия массой2,24 г сплавили с гидроксидом калия массой 1,68 г. Твердый остаток растворили в 40 мл воды, после чего прилили 39,2 мл 18%-ного раствора хлорида бария (плотность 1,18 г/мл). Определите массовые доли веществ в полученном растворе.
58. (С4) Раствор ацетата натрия массой 200 г подвергли электролизу с инертным анодом до полного разложения соли. Для нейтрализации образовавшейся щелочи потребовалось 32,0 мл 20%-ного раствора соляной кислоты (плотность 1,14 г/мл). Определите массовую долю ацетата натрия в исходном растворе.
59. (С4) Сколько граммов карбида алюминия надо добавить к 250 мл 24%-ного раствора серной кислоты (плотность 1,17 г/мл), чтобы массовая доля соли в полученном растворе стала равна массовой доле кислоты?
60. (С4) Сколько граммов карбида алюминия надо добавить к 200 мл 20%-ного раствора азотной кислоты (плотность 1,1 г/мл), чтобы массовая доля кислоты в полученном растворе стала равна 5%?
61. (С4) Сколько граммов карбида алюминия надо добавить к 300 мл 16%-ного раствора азотной кислоты (плотность 1,09 г/мл), чтобы массовая доля соли в полученном растворе стала равна 10%?
6 2. (С5) Относительная плотность паров алкана по воздуху равна 3,931. Установите молекулярную формулу алкана.
6 3. (С5) Массовая доля углерода в алкане равна 83,72%. Установите молекулярную формулу алкана.
64. (С5) Массовая доля хлора в монохлоралкане равна 38,38%. Установите молекулярную формулу монохлоралкана.
65. (С5) Массовая доля кислорода в нитроалкане равна 35,96%. Установите молекулярную формулу нитроалкана. 66. (С5) В результате бромирования алкана массой 6,0 г получили монобромалкан массой 21,8 г. Установите молекулярную формулу алкана.
67. (С5) В результате сгорания алкана получили 13,2 г углекислого газа и 7,2 г воды г. Установите молекулярную формулу алкана. 68. (С5) При сгорании органического вещества массой 9,0 г получили 26,4 г углекислого газа и 16,2 г воды. Плотность паров вещества по кислороду равна 0,9375. Установите молекулярную формулу вещества.
69. (С5) При полном сгорании органического вещества, не содержащего кислород, получили 4,48 л (н.у.) углекислого газа, 3,6 г воды и 2,24 л (н.у.) хлороводорода. Установите молекулярную формулу вещества.
Алкены
Базовый уровень сложности
1. Состав алкенов выражается общей формулой
2. Формулы только алкенов могут быть записаны в ряду
3. В молекуле этилена атомы углерода находятся в состоянии гибридизации
4. В молекуле 2-метилбутена-1 атомы углерода находятся в состоянии гибридизации
5. Последовательность типов гибридизации атомов углерода в молекуле пропена
6. Последовательность типов гибридизации атомов углерода
sp3 – sp2 – sp2 – sp3 имеется в молекуле
7. Изомером углеводорода, формула которого СН2=СН ─ СН ─ СН3, │ СН3 является
8. Пространственные цис-транс- изомеры имеет
9. Механизм реакции взаимодействия бромной воды с этиленом
10. Пропен не вступает в реакцию с
11. Как этен, так и этанвзаимодействуют с
12. Бутен-2 в отличие от бутена-1
13. Превращение С3Н6 → С3Н8 осуществляется с помощью реакции
14. Превращение С2Н4 → С2Н5OH осуществляется с помощью реакции
15. Превращение С2Н4 → СН2OH ─ СН2OH осуществляется с помощью реакции
16. Химическое равновесие в системе С3Н6(г) + Н2 (г) можно сместить в сторону образования пропана при одновременном
17. Продуктом реакции пропена с бромной водой является
18. При взаимодействии пропена с бромоводородом преимущественно образуется
19. В результате реакции гидратациибутена-1 преимущественно образуется
20. Приокислении алкенов водным раствором KMnO4 образуются
21. Мономером для получения полипропилена служит вещество, формула которого
22. « Против» правила Марковникова протекает реакция, схема которой
23. Поливинилхлорид получают в результате реакции
24. Для получения этилена в лаборатории используют реакцию
25. Реакцией дегидрирования этилен можно получить из
26. В результате реакции дегидрогалогенирования 2-бромбутана в спиртовом растворе щелочи образуется преимущественно
27. Какие из приведенных утверждений об алкенах и их свойствах верны? А. По физическим свойствам алкены похожи на алканы. Б. Для алкенов наиболее характерны реакции присоединения и окисления.
28. Какие из приведенных утверждений об алкенах и их свойствах верны? А. Реакции присоединения в молекулах алкенов обусловлены разрывом π-связи между атомами углерода. Б. В лаборатории этен получают путем дегидратации этанола в присутствии концентрированной серной кислоты при температуре 100 ◦С.
29. Какие из приведенных утверждений об алкенах и их свойствах верны? А. В молекулах алкенов все атомы углерода находятся в состоянии sp2-гибридизации. Б. Обесцвечивание бромной воды – качественная реакция на алкены.
30. Какие из приведенных утверждений об алкенах и их свойствах верны? А. Алкены практически нерастворимы в воде. Б. Обесцвечивание водного раствора перманганата калия – качественная реакция на алкены.
31. Какие из приведенных утверждений об этилене и его свойствах верны? А. Молекула этилена имеет линейное строение. Б. При окислении этилена водным раствором перманганата калия образуется этиленгликоль.
32. Какие из приведенных утверждений о пропене и его свойствах верны? А. Молекула пропена имеет плоское строение. Б. Присоединение бромоводорода к молекуле пропена протекает по правилу Марковникова.
33. Какие из приведенных утверждений о пропене и его свойствах верны? А. Пропен можно отличить от пропана с помощью водного раствора перманганата калия. Б. Пропен используется для получения полимеров.
34. Какие из приведенных утверждений о пропене и его свойствах верны?
А. В молекуле пропена имеется тетраэдрический фрагмент атомов. Б. При гидратации пропена преимущественно образуется пропанол-1.
35. Какие из приведенных утверждений о пропене и его свойствах верны? А. Между молекулами пропена существуют водородные связи. Б. Присоединение хлороводорода к пропену протекает по ионному механизму.
36. Какие из приведенных утверждений о бутене-1 и его свойствах верны? А. Бутен-1 способен к образованию цис-транс - изомеров. Б. Бутен-1 можно получить при нагревании 2-хлорбутана со спиртовым раствором щелочи.
37. Какие из приведенных утверждений о бутене-2 и его свойствах верны? А. При окислении бутена-2 водным раствором перманганата калия образуется бутанол-2. Б. Бутен-2 можно отличить от бутана с помощью бромной воды.
38. В схеме превращений C2H6 → X→ [─ CH2 ─ CH2 ─]n веществом Х является
39. В схеме превращений X1 веществами Х1 и Х2 соответственно являются
40. В схеме превращений X1 веществами Х1 и Х2 соответственно являются
41. В схеме превращений 1-хлорпропан веществами Х1 и Х2 соответственно являются
42. В схеме превращений пропанол-1 веществами Х1 и Х2 соответственно являются
43. В схеме превращений пропен веществами Х1 и Х2 соответственно являются
44. В схеме превращений пропан → Х1 веществами Х1 и Х2 соответственно являются
45. В соответствии с термохимическим уравнением реакции С2Н4(г) + 3О2(г) = 2СО2(г) + 2Н2О(ж) + 1410 кДж количество теплоты, выделяющееся при образовании 4,48 л (н.у.) углекислого газа, равно
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-05-12; просмотров: 1165; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.15.10.117 (0.013 с.) |

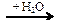 X1
X1 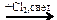 X2 → С2Н6
X2 → С2Н6 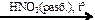 Х3
Х3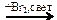 X2
X2 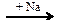 X3
X3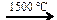 Х1 → С2Н6
Х1 → С2Н6  Х1 → СН3СН=СН2
Х1 → СН3СН=СН2 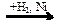 Х1
Х1 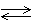 С3Н8 (г) + Q
С3Н8 (г) + Q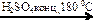 C2H4
C2H4 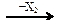 C2H5Cl
C2H5Cl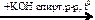 C2H4
C2H4 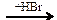 Х2
Х2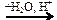 Х2
Х2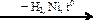 Х1
Х1 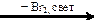 Х2
Х2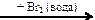 Х2
Х2


