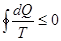Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Модель идеального газа. Связь между давлением и средней кинетической энергией молекул газа. Уравнение состояния идеального газа. ИзопроцессыСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Идеальный газ – модель любого реального газа, в которой пренебрегают размерами молекул и их взаимодействием. Пренебречь движением молекул нельзя: оно непрерывно, хаотично и имеет сложный характер. Потенциальная энергия взаимодействия молекул пренебрежимо мала по сравнению с кинетической энергией движения молекул. За идеальный газ можно принять, например, воздух при н.у. Двигаясь хаотично, молекулы (атомы) газа постоянно сталкиваются друг с другом и со стенками сосуда. Т.к. они имеют импульс, то при столкновении происходит передача импульса, т.е. молекулы действуют с силой и производят давление. Рудольф Клаузиус доказал, что давление газа зависит от массы молекулы, концентрации и скорости движения молекул. Эта зависимость выражается формулой
и называется основным уравнением МКТ. Объяснение этой зависимости с т.з. МКТ Т.к. Оно связывает макроскопический параметр давление (его можно измерить прибором) с микроскопическими параметрами. (Величины, характеризующие свойства отдельных молекул вещества, называют микроскопическими параметрами. Это, например, массы молекул, их скорости, концентрация (число молекул в единице объема). Т.к. Состояние газа можно охарактеризовать тремя макроскопическими параметрами: давление Р, Па; объём V, м3; температура Т,К. (макроскопические параметры – величины, характеризующие состояние макроскопических тел без учета их внутреннего строения) Уравнение, связывающее эти параметры, называется уравнением состояния идеального газа Р = nkT n
Если m, M, NA, k – const, то Если газ переходит из одного состояния с параметрами Р1 V1 T1 в другое с параметрами P2 V2 T2, то Т.к. NА·k = 6,02·1023моль-1·1,38·10-23Дж/К = 8,31Дж/мольК = R- универсальная газовая постоянная, то Уравнение состояния идеального газа надо знать для исследования тепловых процессов. Оно позволяет:
1. Определить одну из неизвестных величин, если известны две другие (это используют в термометрах) 2. Предсказать как поведёт себя газ при изменении одного из параметров 3. Определить как изменится состояние газа, если он совершит работу или получит теплоту Изопроцессы. Газовые законы Всякое изменение состояния газа называют термодинамическим процессом. Обычно изменение одного из параметров состояния приводит к изменению всех остальных. Однако часто при изменении состояния системы один из параметров остаётся неизменным. Процессы, протекающие при неизменном значении одного из параметров, называются изопроцессами. Количественные зависимости между двумя параметрами газа при неизменном значении третьего называют газовыми законами.
Термодинамика Термодинамикой называют науку о наиболее общих свойствах макроскопических физических систем, находящихся в состоянии термодинамического равновесия, и о процессах перехода между этими состояниями. Она позволяет найти общие закономерности при установлении равновесия в физических системах. Основные термодинамические понятия
Термодинамика в отличие от молекулярно-кинетической теории не вдаётся в рассмотрение микроскопической картины явлений (оперирует с макропараметрами). Термодинамика рассматривает явления, опираясь на основные законы (начала), которые являются обобщением огромного количества опытных данных. Внутренняя энергия – энергия физической системы, зависящая от её внутреннего состояния. Внутренняя энергия включает энергию хаотического (теплового) движения всех микрочастиц системы (молекул, атомов, ионов и т.д.) и энергию взаимодействия этих частиц. Кинетическая энергия движения системы как целого и её потенциальная энергия во внешних силовых полях во внутреннюю энергию не входит. В термодинамике и её приложениях представляет интерес не само значение внутренней энергии, а её изменение при изменении состояния системы. Внутренняя энергия – функция состояния системы. Работа термодинамической системы над внешними телами заключается в изменении состояния этих тел и определяется количеством энергии, передаваемой системой внешним телам при изменении объема. работа. Если мы хотим определить работу, совершаемую в конечном процессе, то надо вычислить интеграл Однако такое вычисление можно провести лишь в том случае, когда давление является определенной функцией объема. Между тем, как следует из уравнения состояния, давление в системе зависит не только от её объема, но и температуры. Поскольку величина работы Графически работа может быть представлена площадью под кривой, описывающей процесс в координатах
Вычислим работу, совершаемую молем идеального газа в трех различных процессах: 1. 2. 3.
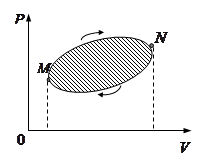
Если система в результате произведенных в ней изменений вернулась в исходное состояние, то говорят, что она совершила круговой процесс, или цикл. Если произведенный процесс квазистатический, то на диаграмме Количество теплоты. Математическая формулировка первого начала термодинамики. при соприкосновении внутренняя энергия горячего тела будет уменьшаться и, наоборот, холодное тело будет увеличивать свою внутреннюю энергию, хотя макроскопическая работа при этом не совершается.
Процесс обмена внутренними энергиями соприкасающихся тел, не сопровождающийся производством макроскопической работы, называется теплообменом. Энергия, переданная телу окружающей средой в результате теплообмена, называется количеством теплоты, или просто теплотой, полученной телом в таком процессе. 1-ый закон (начало) термодинамики: Если внутренняя энергия системы не изменяется ( Это означает, что невозможен процесс, единственным результатом которого являлось бы производство работы без каких бы то ни было изменений в других телах. Механизм для осуществления такого процесса получил название перпетуум мобиле (вечный двигатель). Т.о., из первого начала термодинамики следует невозможность построения вечного двигателя. Другими словами, согласно первому началу термодинамики (закону сохранения энергии при протекании тепловых процессов) термодинамическая система может совершать работу только за счет своей внутренней энергии или (и) каких-либо внешних источников энергии. Калориметрические опыты проводятся либо при постоянном объеме, либо при постоянном давлении. Запишем первое начало термодинамики применительно к таким процессам. Если объем Если же постоянно давление, то, представив работу системы как для первого начала получаем Теплоемкость. Теплоемкостью тела Задание приращения температуры
Действительно, используя выражения (1.14) и (38) можно записать теплоемкость Особое значение, в том числе и практически важное, имеют теплоемкости, определенные для процессов, происходящих в системе при постоянном объеме или постоянном давлении. Если система заключена в жесткую оболочку, то объем остается постоянным ( Если же в системе постоянным поддерживается давление, то в формуле (1.17) отношение Уравнение Роберта Майера. Из формул (1.19) и (1.18) следует Для идеального газа по закону Джоуля а из уравнения Менделеева-Клапейрона получаем Т.о., Это важное соотношение называется уравнением Роберта Майера.
Теплоемкость и степени свободы. Зависимость теплоемкости от температуры. Закон о равнораспределении энергии по степеням свободы мы обсудили, когда рассматривали средние значения энергии, приходящиеся на различные степени свободы молекул. Рассмотрим идеальный газ. Один моль газа содержит где Определим теплоемкости 1) Одноатомные молекулы - три поступательных степени свободы: Эти простые формулы хорошо описывают теплоемкости многих реальных газов (одноатомных и многих двухатомных) вблизи комнатной температуры. Для газов, образованных 3-х атомными молекулами чаще наблюдаются отклонения от полученных значений.
Адиабатический процесс. Уравнение Пуассона. Процесс, происходящий в системе без теплообмена с окружающей средой, называется адиабатическим. Величина Поскольку переменные Так как Политропические процессы. Процессы, идущие при постоянной теплоемкости получаем Решая дифференциальное уравнение (3.10), находим уравнение политропического процесса в переменных Обозначим Второе начало термодинамики
Первое начало термодинамики указывает на возможность совершать работу за счет тепла, получаемого системой от внешних тел. Например, при изотермическом расширении идеального газа между состояниями 1–2:
Однако, действие тепловых машин основано на круговых (циклических) процессах, в которых система (рабочее тело) после ряда изменений возвращается в исходное состояние. При этом некоторое количество теплоты В принципиальном отношении работа тепловой машины может быть сведена к следующему: рабочее тело получает от нагревателя теплоту Выражение (6.2) показывает, что КПД тепловых машин принципиально меньше единицы. Этот результат не является следствием первого начала термодинамики, а выражает содержание другого фундаментального закона – второго начала термодинамики. Другие формулировки этого закона: - невозможен циклический процесс, единственным результатом которого является производство работы и обмен энергией с одним тепловым резервуаром (У.Томсон); - невозможен вечный двигатель второго рода (В.Оствальд); - невозможен циклический процесс, единственным результатом которого была бы передача теплоты от менее нагретого тела к более нагретому (Р.Клаузиус). Эмпирические формулировки второго начала не выражаются в математической форме. Будучи внешне разнообразны, они имеют внутреннее единство, по существу, они эквивалентны друг другу. Цикл Карно. Теорема Карно и теорема Клаузиуса Среди всех циклических процессов особое место принадлежит циклу Карно, с изучением которого связано открытие второго начала термодинамики. Это единственный цикл, который при наличии одного нагревателя Теорема Карно: - КПД обратимого цикла Карно не зависит от природы рабочего тела и устройства системы, выполняющей этот цикл, а определяется только температурой нагревателя - КПД необратимых машин (работающих по необратимому циклу), меньше КПД обратимых машин, т.е.
Строго обратимые процессы в макросистемах невозможны, поэтому выражение носит асимптотический характер – к нему можно приближаться, но точного значения нельзя достичь. Теорема Карно является математическим выражением второго начала термодинамики, применительно к замкнутым процессам с одним нагревателем и одним холодильником. Обобщением теоремы Карно на случай произвольных циклов является неравенство Клаузиуса (теорема Клаузиуса):
|
|||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-05-12; просмотров: 859; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.220.147.78 (0.012 с.) |

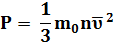
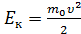 , то
, то 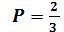 n E к - основное уравнение МКТ.
n E к - основное уравнение МКТ.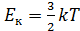 , то P = nkT
, то P = nkT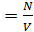 N =
N = 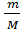 NA P =
NA P = 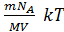 умножим на
умножим на 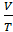
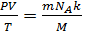
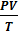 – const – уравнение состояния идеального газа (уравнение Клапейрона) (объединённый газовый закон: для данной массы газа произведение давления газа на его объём, делёное на абсолютную температуру остаётся неизменным)
– const – уравнение состояния идеального газа (уравнение Клапейрона) (объединённый газовый закон: для данной массы газа произведение давления газа на его объём, делёное на абсолютную температуру остаётся неизменным)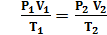
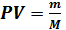 RT - уравнение состояния идеального газа (уравнение Менделеева- Клапейрона)
RT - уравнение состояния идеального газа (уравнение Менделеева- Клапейрона) V
V 
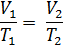
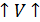 T
T 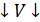
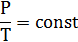
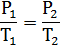
 T
T 
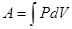 .
. 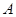 зависит от способа пути перехода между состояниями и не определена однозначно для конечного состояния, мы пишем для работы, совершаемой системой на бесконечно малом перемещении,
зависит от способа пути перехода между состояниями и не определена однозначно для конечного состояния, мы пишем для работы, совершаемой системой на бесконечно малом перемещении, 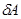 , а не
, а не 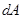 .
.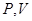 (или на плоскости
(или на плоскости 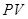 ).
). Пусть система квазистатически переходит из состояния
Пусть система квазистатически переходит из состояния  в состояние
в состояние  , причем переход может осуществляться по двум альтернативным путям 1 и 2. Обе кривые
, причем переход может осуществляться по двум альтернативным путям 1 и 2. Обе кривые 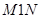 и
и 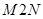 определяют давление
определяют давление 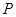 как функцию объема
как функцию объема 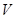 . Поэтому работа
. Поэтому работа 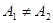 .
.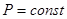
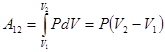 ;
;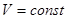
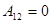 , т.к.
, т.к. 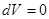 ;
;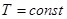
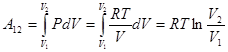 .
. Приведенный пример наглядно указывает на зависимость работы, совершаемой системой от пути перехода из начального состояния в конечное.
Приведенный пример наглядно указывает на зависимость работы, совершаемой системой от пути перехода из начального состояния в конечное.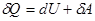 , или
, или 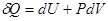 .
.  ) и к системе не подводится тепло (
) и к системе не подводится тепло (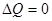 ), из первого начала неизбежно следует, что
), из первого начала неизбежно следует, что 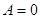 .
.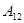 , произведенная системой над внешними телами, равна нулю, и первое начало может быть записано в виде:
, произведенная системой над внешними телами, равна нулю, и первое начало может быть записано в виде: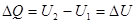
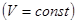 .
. 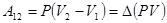 ,
, 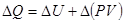 .
. 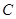 называется отношение бесконечно малого количества теплоты
называется отношение бесконечно малого количества теплоты 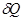 , полученного телом, к соответствующему приращению
, полученного телом, к соответствующему приращению 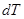 его температуры:
его температуры: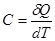 . Теплоемкость, определенная для единицы массы тела, называется удельной и обозначается буквой
. Теплоемкость, определенная для единицы массы тела, называется удельной и обозначается буквой 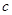 . Молярной теплоемкостью называют теплоемкость одного моля вещества.
. Молярной теплоемкостью называют теплоемкость одного моля вещества.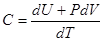 .
. 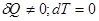 )
) 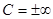 , а для адиабатического – (
, а для адиабатического – (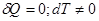 )
) 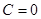 .
.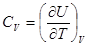 .
. 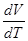 следует заменить на частную производную
следует заменить на частную производную 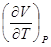 . Тогда для теплоемкости получим
. Тогда для теплоемкости получим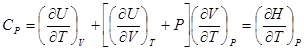 .
. 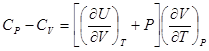 .
.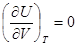 ,
,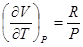 .
.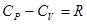 .
.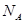 молекул, поэтому его внутренняя энергия может быть найдена как
молекул, поэтому его внутренняя энергия может быть найдена как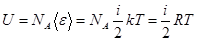 ,
,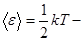 средняя энергия, приходящаяся на одну степень свободы.
средняя энергия, приходящаяся на одну степень свободы.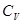 идеального газа в зависимости от строения его молекул.
идеального газа в зависимости от строения его молекул. 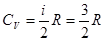 . Двухатомные молекулы с жесткой связью - 3 поступательных степени свободы + 2 вращательных степени = 5 степеней свободы. Тогда
. Двухатомные молекулы с жесткой связью - 3 поступательных степени свободы + 2 вращательных степени = 5 степеней свободы. Тогда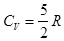 . Двухатомные молекулы с упругой связью - 3 поступательных степени свободы + 2 вращательных степени + 1 колебательная степень свободы. На колебательную степень свободы приходится две половинки
. Двухатомные молекулы с упругой связью - 3 поступательных степени свободы + 2 вращательных степени + 1 колебательная степень свободы. На колебательную степень свободы приходится две половинки 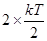 , т.е.
, т.е. 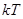 . Тогда
. Тогда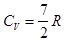 . Многоатомная молекула - тогда введем
. Многоатомная молекула - тогда введем 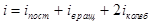 и теплоемкость:
и теплоемкость: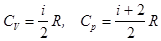
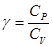 .
. 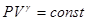 . Полученное соотношение называется уравнением Пуассона (1781 – 1840). Оно является уравнением адиабаты – кривой, изображающей квазистатический адиабатический процесс.
. Полученное соотношение называется уравнением Пуассона (1781 – 1840). Оно является уравнением адиабаты – кривой, изображающей квазистатический адиабатический процесс.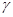 называется показателем адиабаты, или адиабатической постоянной.
называется показателем адиабаты, или адиабатической постоянной.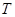 для идеального газа связаны уравнением
для идеального газа связаны уравнением 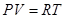 , то уравнение адиабаты можно записать как
, то уравнение адиабаты можно записать как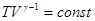 , или
, или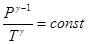 .
. 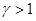 , то из уравнения (1.30) следует, что при адиабатическом сжатии газ будет нагреваться, а при адиабатическом расширении – охлаждаться. Нагревание газа при адиабатическом сжатии объясняется тем, что производимая внешними силами работа идет на увеличение внутренней энергии газа.
, то из уравнения (1.30) следует, что при адиабатическом сжатии газ будет нагреваться, а при адиабатическом расширении – охлаждаться. Нагревание газа при адиабатическом сжатии объясняется тем, что производимая внешними силами работа идет на увеличение внутренней энергии газа.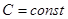 , называются политропическими процессами. Найдем уравнение политропического процесса. Из первого начала имеем для одного моля:
, называются политропическими процессами. Найдем уравнение политропического процесса. Из первого начала имеем для одного моля: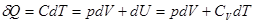 . Откуда, учитывая
. Откуда, учитывая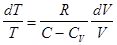
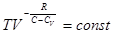
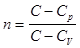 , тогда уравнение политропического процесса принимает вид:
, тогда уравнение политропического процесса принимает вид: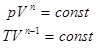 . В частности, все элементарные процессы (изобарический, изохорический и изотермический) являются политропическими и их уравнения получаются из (3.12).
. В частности, все элементарные процессы (изобарический, изохорический и изотермический) являются политропическими и их уравнения получаются из (3.12).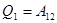 .
.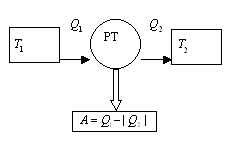
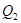 будет отдано среде.
будет отдано среде.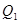 , отдает холодильнику
, отдает холодильнику 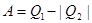 (рисунок 6.1).
(рисунок 6.1). 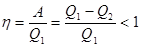 . (6.2)
. (6.2)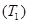 и одного холодильника
и одного холодильника 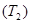 может быть выполнен обратимым образом. Цикл Карно состоит из двух изотерм и двух адиабат. Предположив, что рабочим телом является идеальный газ, получим КПД обратимого цикла Карно
может быть выполнен обратимым образом. Цикл Карно состоит из двух изотерм и двух адиабат. Предположив, что рабочим телом является идеальный газ, получим КПД обратимого цикла Карно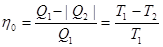 ,
,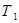 и холодильника
и холодильника 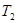 ;
;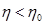 . Следовательно,
. Следовательно,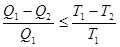 .
.