
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Термодинамические параметры состоянияСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Свойства каждой системы характеризуются рядом величин, которые принято называть термодинамическими параметрами. Рассмотрим некоторые из них, используя при этом известные из курса физики молекулярно-кинетические представления об идеальном газе как о совокупности молекул, которые имеют исчезающе малые размеры, находятся в беспорядочном тепловом движении и взаимодействуют друг с другом лишь при соударениях. Давление обусловлено взаимодействием молекул рабочего тела с поверхностью и численно равно силе, действующей на единицу площади поверхности тела по нормали к последней. В соответствии с молекулярно-кинетической теорией давление газа определяется соотношением
где n — число молекул в единице объема; т — масса молекулы; с2 — средняя квадратическая скорость поступательного движения молекул. В Международной системе единиц (СИ) давление выражается в паскалях (1 Па=1 Н/м2). Поскольку эта единица мала, удобнее использовать 1 кПа = 1000 Па и 1 МПа=106 Па. Давление измеряется при помощи манометров, барометров и вакуумметров.
Приборы для измерения давлений ниже атмосферного называются вакуумметрами; их показания дают значение разрежения (или вакуума):
Следует отметить, что параметром состояния является абсолютное давление. Именно оно входит в термодинамические уравнения. Температурой называется физическая величина, характеризующая степень нагретости тела. Понятие о температуре вытекает из следующего утверждения: если две системы находятся в тепловом контакте, то в случае неравенства их температур они будут обмениваться теплотой друг с другом, если же их температуры равны, то теплообмена не будет. С точки зрения молекулярно-кинетических представлений температура есть мера интенсивности теплового движения молекул. Ее численное значение связано с величиной средней кинетической энергии молекул вещества:
где k — постоянная Больцмана, равная 1,380662•10ˉ23 Дж/К. Температура T, определенная таким образом, называется абсолютной. В системе СИ единицей температуры является кельвин (К); на практике широко применяется градус Цельсия (°С). Соотношение между абсолютной Т и стоградусной I температурами имеет вид
В промышленных и лабораторных условиях температуру измеряют с помощью жидкостных термометров, пирометров, термопар и других приборов. Удельный объем v — это объем единицы массы вещества. Если однородное тело массой М занимает объем v, то по определению v = V/М. В системе СИ единица удельного объема 1 м3/кг. Между удельным объемом вещества и его плотность существует очевидное соотношение:
Для сравнения величин, характеризующих системы в одинаковых состояниях, вводится понятие «нормальные физические условия»: p =760 мм рт.ст.= 101,325 кПа; T =273,15 K. В разных отраслях техники и разных странах вводят свои, несколько отличные от приведенных «нормальные условия», например, «технические» (p = 735,6 мм рт.ст.= 98 кПа, t =15˚C) или нормальные условия для оценки производительности компрессоров (p =101,325 кПа, t =20˚С) и т. д. Если все термодинамические параметры постоянны во времени и одинаковы во всех точках системы, то такое состояние системы называется равновесным. Если между различными точками в системе существуют разности температур, давлений и других параметров, то она является неравновесной. В такой системе под действием градиентов параметров возникают потоки теплоты, вещества и другие, стремящиеся вернуть ее в состояние равновесия. Опыт показывает, что изолированная система с течением времени всегда приходит в состояние равновесия и никогда самопроизвольно выйти из него не может. В классической термодинамике рассматриваются только равновесные системы. Уравнение состояния Для равновесной термодинамической системы существует функциональная связь между параметрами состояния, которая называется уравнением состояния. Опыт показывает, что удельный объем, температура и давление простейших систем, которыми являются газы, пары или жидкости, связаны термическим уравнением состояния вида Уравнению состояния можно придать другую форму: Эти уравнения показывают, что из трех основных параметров, определяющих состояние системы, независимыми являются два любых. Для решения задач методами термодинамики совершенно необходимо знать уравнение состояния. Однако оно не может быть получено в рамках термодинамики и должно быть найдено либо экспериментально, либо методами статистической физики. Конкретный вид уравнения состояния зависит от индивидуальных свойств вещества. Уравнение состояния идеальных газов Из уравнений (1.1) и (1.2) следует, что Рассмотрим 1 кг газа. Учитывая, что в нем содержится N молекул и, следовательно, Постоянную величину Nk, отнесенную к 1 кг газа, обозначают буквой R и называют газовой постоянной. Поэтому
Полученное соотношение представляет собой уравнение Клапейрона. Умножив (1.3) на М, получим уравнение состояния для произвольной массы газа М:
Уравнению Клапейрона можно придать универсальную форму, если отнести газовую постоянную к 1 кмолю газа, т. е. к количеству газа, масса которого в килограммах численно равна молекулярной массе μ. Положив в (1.4) М= μ и V=V μ, получим для одного моля уравнение Клапейрона — Менделеева:
Здесь В соответствии с законом Авогадро (1811г.) объем 1 кмоля, одинаковый в одних и тех же условиях для всех идеальных газов, при нормальных физических условиях равен 22,4136 м3, поэтому
Газовая постоянная 1 кг газа составляет Уравнение состояния реальных газов В реальных газах в отличие от идеальных существенны силы межмолекулярных взаимодействий (силы притяжения, когда молекулы находятся на значительном расстоянии, и силы отталкивания при достаточном сближении их друг с другом) и нельзя пренебречь собственным объемом молекул. Наличие межмолекулярных сил отталкивания приводит к тому, что молекулы могут сближаться между собой только до некоторого минимального расстояния. Поэтому можно считать, что свободный для движения молекул объем будет равен
Силы притяжения действуют в том же направлении, что и внешнее давление, и приводят к возникновению молекулярного (или внутреннего) давления. Сила молекулярного притяжения каких-либо двух малых частей газа пропорциональна произведению числа молекул в каждой из этих частей, т. е. квадрату плотности, поэтому молекулярное давление обратно пропорционально квадрату удельного объема газа: рмол = а/ v 2, где а — коэффициент пропорциональности, зависящий от природы газа. Отсюда получаем уравнение Ван-дер-Ваальса (1873 г.):
При больших удельных объемах и сравнительно невысоких давлениях реального газа уравнение Ван-дер-Ваальса практически вырождается в уравнение состояния идеального газа Клапейрона, ибо величина a / v 2 (по сравнению с p) и b (по сравнению с v) становятся пренебрежимо малыми. Уравнение Ван-дер-Ваальса с качественной стороны достаточно хорошо описывает свойства реального газа, но результаты численных расчетов не всегда согласуются с экспериментальными данными. В ряде случаев эти отклонения объясняются склонностью молекул реального газа к ассоциации в отдельные группы, состоящие из двух, трех и более молекул. Ассоциация происходит вследствие несимметричности внешнего электрического поля молекул. Образовавшиеся комплексы ведут себя как самостоятельные нестабильные частицы. При столкновениях они распадаются, затем вновь объединяются уже с другими молекулами и т. д. По мере повышения температуры концентрация комплексов с большим числом молекул быстро уменьшается, а доля одиночных молекул растет. Большую склонность к ассоциации проявляют полярные молекулы водяного пара. Термодинамический процесс Изменение состояния термодинамической системы во времени называется термодинамическим процессом. Так, при перемещении поршня в цилиндре объём, а с ним давление и температура находящегося внутри газа будут изменяться, будет совершаться процесс расширения или сжатия газа. Как уже отмечалось, система, выведенная из состояния равновесия, и предоставленная при постоянных параметрах окружающей среды самой себе, через некоторое время вновь придет в равновесное состояние, соответствующее этим параметрам. Такое самопроизвольное (без внешнего воздействия) возвращение системы в состояние равновесия называется релаксацией, а промежуток времени, в течение которого система возвращается в состояние равновесия, называется временем релаксации. Для разных процессов он различно: если для установления равновесного давления в газе требуется всегда, то для выравнивания температуры в объеме того же газа нужны десяти; минут, а в объеме нагреваемого твердой тела — иногда несколько часов. Термодинамический процесс называется равновесным, если все параметры системы при его протекании меняются достаточно медленно по сравнению с соответствующим процессом релаксации. В этом случае система фактически все время находится в состоянии равновесия с окружающей средой, чем и определяется название процесса. Чтобы процесс был равновесным, скорость изменения параметров системы
где А — параметр, наиболее быстро изменяющийся в рассматриваемом процессе; с рел — скорость изменения этого параметра в релаксационном процессе; τ рел — время релаксации. Рассмотрим, например, процесс сжатия газа в цилиндре. Если время смещения поршня от одного положения до другого существенно превышает время релаксации, то в процессе перемещения поршня давление и температура успеют выровняться по всему объему цилиндра. Это выравнивание обеспечивается непрерывным столкновением молекул, в результате чего подводимая от поршня к газу энергия достаточно быстро и равномерно распределяется между ними. Если последующие смещения поршня будут происходить аналогичным образом, то состояние системы в каждый момент времени будет практически равновесным. Таким образом, равновесный процесс состоит из непрерывного ряда последовательных состояний равновесия, поэтому в каждой его точке состояние термодинамической системы можно описать уравнением состояния данного рабочего тела. Именно поэтому классическая термодинамика в своих исследованиях оперирует только равновесными процессами. Они являются удобной идеализацией реальных процессов, позволяющей во многих случаях существенно упростить решение задачи. Такая идеализация вполне обоснована, так как условие (1.8) выполняется на практике достаточно часто. Поскольку механические возмущения распространяются в газах со скоростью звука, процесс сжатия газа и цилиндре будет равновесным, если скорость перемещения поршня много меньше скорости звука. Процессы, не удовлетворяющие условию Теплоемкость газов Отношение количества теплоты
Обычно теплоемкость относят к единице количества вещества и в зависимости от выбранной единицы различают: удельную массовую теплоемкость c, отнесенную к 1 кг газа, Дж/(кг·К); удельную объемную теплоемкость c´, отнесенную к количеству газа, содержащегося в 1 м3 объема при нормальных физических условиях, Дж/(м3·К); удельную мольную теплоемкость Зависимость между удельными теплоемкостями устанавливается очевидными соотношениями: Здесь Изменение температуры тела при одном и том же количестве сообщаемой теплоты зависит от характера происходящего при этом процесса, поэтому теплоемкость является функцией процесса. Это означает, что одно и то же рабочее тело в зависимости от процесса требует для своего нагревания на 1 К различного количества теплоты. Численно величина с изменяется в пределах от +∞ до -∞. В термодинамических расчетах большое значение имеют: теплоемкость при постоянном давлении
равная отношению количества теплоты теплоемкость при постоянном объеме
равная отношению количества теплоты, подведенной к телу в процессе при постоянном объеме, к изменению температуры тела. В соответствии с первым законом термодинамики для закрытых систем, в которых протекают равновесные процессы
Для изохорного процесса (v =const) это уравнение принимает вид
т. е. теплоемкость тела при постоянном объеме равна частной производной от его внутренней энергии по температуре и характеризует темп роста внутренней энергии в изохорном процессе с увеличением температуры. Для идеального газа Для изобарного процесса () из уравнения (2.16) и (2.14) получаем
или
Это уравнение показывает связь между теплоемкостями ср и сv. Для идеального газа оно значительно упрощается. Действительно, внутренняя энергия идеального газа определяется только его температурой и не зависит от объема, поэтому
Это соотношение называется уравнением Майера и является одним из основных в технической термодинамике идеальных газов. В процессе v =const теплота, сообщаемая газу, идет лишь на изменение его внутренней энергии, тогда как в процессе р = const теплота расходуется и на увеличение внутренней энергии и на совершение работы против внешних сил. Поэтому ср больше сv на величину этой работы. Для реальных газов Обычно теплоемкости определяются экспериментально, но для многих веществ их можно рассчитать методами статистической физики. Числовое значение теплоемкости идеального газа позволяет найти классическая теория теплоемкости, основанная на теореме о равномерном распределении энергии по степеням свободы молекул. Согласно этой теореме внутренняя энергия идеального газа прямо пропорциональна числу степеней свободы молекул и энергии kТ/2, приходящейся на одну степень свободы. Для 1 моля газа
где Nо — число Авогадро; i — число степеней свободы (число независимых координат, которые нужно задать для того, чтобы полностью определить положение молекулы в пространстве). Молекула одноатомного газа имеет три степени свободы соответственно трем составляющим в направлении координатных осей, на которые может быть разложено поступательное движение. Молекула двухатомного газа имеет пять степеней свободы, так как помимо поступательного движения она может вращаться около двух осей, перпендикулярных линии, соединяющей атомы (энергия вращения вокруг оси, соединяющей атомы, равна нулю, если атомы считать точками). Молекула трехатомного и вообще многоатомного газа имеет шесть степеней свободы: три поступательных и три вращательных. Поскольку для идеального газа
Результаты классической теории теплоемкости достаточно хорошо согласуются с экспериментальными данными в области комнатных температур (табл. 2.1), однако основной вывод о независимости от температуры эксперимент не подтверждает. Расхождения, особенно существенные в области низких и достаточно высоких температур, связаны с квантовым поведением молекул и находят объяснения в рамках квантовой теории теплоемкости. Теплоемкость некоторых газов при t= 0°С в идеально-газовом состоянии
Эта теория устанавливает, прежде всего, несправедливость теоремы о равномерном распределении энергии по степени свободы в области низких и высоких температур. С уменьшением температуры газа происходит «вымораживание» числа степеней свободы молекулы. Так, для двухатомной молекулы происходит «вымораживание» вращательных степеней свободы и она вместо пяти имеет три степени свободы, а следовательно, и меньшую внутреннюю энергию и теплоемкость. С увеличением температуры у многоатомных молекул происходит возбуждение внутренних степеней свободы за счет возникновения колебательного движения атомов молекулы (молекула становится осциллятором). Это приводит к увеличению внутренней энергии, а следовательно, и теплоемкости с ростом температуры. Теплоемкость реального газа зависит от давления, правда, очень слабо. Поскольку теплоемкость реального газа зависит от температуры, в термодинамике различают истинную и среднюю теплоемкости. Средней теплоемкостью с ср данного процесса в интервале температур от t1 до t2 называется отношение количества теплоты, сообщаемой газу, к разности конечной и начальной температур:
Выражение
определяет теплоемкость при данной температуре или так называемую истинную теплоемкость. Из * следует, что
поэтому
Для практических расчетов теплоемкости всех веществ сводят в таблицы, причем с целью сокращения объема таблиц средние теплоемкости приводят в них для интервала температур от 0 до t. ЛЕКЦИЯ 2
|
||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-04-08; просмотров: 838; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.147.75.217 (0.013 с.) |

 , (1.1)
, (1.1)

 Жидкостные и пружинные манометры измеряют избыточное давление, представляющее собой разность между полным или абсолютным давлением р измеряемой среды и атмосферным давлением p атм, т.е.
Жидкостные и пружинные манометры измеряют избыточное давление, представляющее собой разность между полным или абсолютным давлением р измеряемой среды и атмосферным давлением p атм, т.е. 
 , т. е. избыток атмосферного давления над абсолютным.
, т. е. избыток атмосферного давления над абсолютным. , (1.2)
, (1.2) .
.
 .
.


 .
. , получим:
, получим:  .
. , или
, или  . (1.3)
. (1.3)
 . (1.4)
. (1.4) .
. — объем киломоля газа, а
— объем киломоля газа, а  — универсальная газовая постоянная.
— универсальная газовая постоянная.
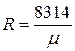 .
. , где b — тот наименьший объем, до которого можно сжать газ. В соответствии с этим длина свободного пробега молекул уменьшается и число ударов о стенку в единицу времени, а следовательно, и давление увеличивается по сравнению с идеальным газом в отношении
, где b — тот наименьший объем, до которого можно сжать газ. В соответствии с этим длина свободного пробега молекул уменьшается и число ударов о стенку в единицу времени, а следовательно, и давление увеличивается по сравнению с идеальным газом в отношении  , т. е.
, т. е.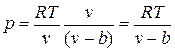 .
. ,
,
 или
или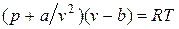 .
. должна удовлетворять соотношению
должна удовлетворять соотношению
 , полученного телом при бесконечно малом изменении его состояния, к связанному с этим изменению температуры тела
, полученного телом при бесконечно малом изменении его состояния, к связанному с этим изменению температуры тела  , называется теплоемкостью тела в данном процессе:
, называется теплоемкостью тела в данном процессе: .
. , отнесенную к одному киломолю, Дж/(кмоль·К).
, отнесенную к одному киломолю, Дж/(кмоль·К). ;
; 
 — плотность газа при нормальных условиях.
— плотность газа при нормальных условиях. ,
,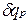 , сообщенной телу в процессе при постоянном давлении, к изменению температуры тела dT
, сообщенной телу в процессе при постоянном давлении, к изменению температуры тела dT , (1.5)
, (1.5) , и
, и .
. , и, учитывая (1.5), получаем, что
, и, учитывая (1.5), получаем, что ,
,


 и, кроме того, из уравнения состояния следует
и, кроме того, из уравнения состояния следует  , откуда
, откуда .
. , поскольку при их расширении (при p =const) совершается работа не только против внешних сил, но и против сил притяжения, действующих между молекулами, что вызывает дополнительный расход теплоты.
, поскольку при их расширении (при p =const) совершается работа не только против внешних сил, но и против сил притяжения, действующих между молекулами, что вызывает дополнительный расход теплоты. ,
, , то мольные теплоемкости одно-, двух- и многоатомных газов равны соответственно:
, то мольные теплоемкости одно-, двух- и многоатомных газов равны соответственно: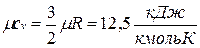 ;
;  ;
;  .
.
 *
*
 .
.


