
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Параметры состояния рабочего телаСодержание книги
Поиск на нашем сайте
Изменение состояния газа обычно происходит в результате сообщения ему или отнятия от него теплоты или от внешних механических воздействий. Множество физических величин, определяющих состояние системы в данный момент времени, называются параметрами состояния. В технической термодинамике состояние газа принято оценивать следующими тремя основными термодинамическими параметрами: Р – абсолютное давление (Па), ν – удельный объем (м3/кг) и абсолютная температура Т (K). Эти параметры называются термическими. Дополнительными параметрами состояния являются: u – внутренняя энергия (Дж/кг), h – энтальпия (Дж/кг) и S – энтропия (Дж/кг·К) – эти параметры называют калорическими. Различают следующие виды параметров: экстенсивные и интенсивные. Экстенсивные параметры пропорциональны количеству вещества в системе, а интенсивные не зависят от количества вещества и массы системы. К интенсивным параметрам относят давление, температуру, удельный объем и др., а к экстенсивным – теплоемкость, объем, энергию, энтропию, свободную энергию. Абсолютное давление. В молекулярно-кинетической теории газов давление представляется результатом ударов хаотически движущихся молекул о стенки сосуда и определяется по формуле
где n – число молекул в объеме; m – масса молекулы; В технических измерениях давление газа определяют отношением нормально направленной к поверхности силы
Это давление принято называть абсолютным. Оно отсчитывается от 0. По формуле (1.2) Р = 0 при Паскаль – это давление, которое оказывает сила в 1 Ньютон на единицу поверхности 1 м2. Эта единица очень мала, поэтому на практике используют более крупные единицы давления: кПа = 103 Па и МПа = 106 Па. Для измерения давления существует большое количество приборов, основанных на различных принципах работы. Эти приборы называются манометрами, барометрами и вакуумметрами. Жидкостные и пружинные манометры измеряют избыточное давление ризб, представляющее собой разность между абсолютным давлением рабс измеряемой среды и барометрическим давлением B0, т.е. рабс = ризб + В0. Приборы для измерения давлений ниже атмосферного называются вакуумметрами; их показания дают значение разрежения (или вакуума): рабс = В0 – ризб (избыток атмосферного давления над абсолютным). Абсолютная температура. Согласно молекулярно-кинетической теории газов абсолютная температура является мерой средней кинетической энергии молекул и ее можно определить по формуле
где k– постоянная Больцмана, k = 1,380662 × 10–23 Дж/К;m – масса молекулы; Из формулы (1.3) следует, что абсолютная температура Т принимает значение, равное нулю при По ГОСТ 8550–61 для измерения температуры вводятся две температурные шкалы. По одной шкале температуру измеряют в градусах Кельвина, а по другой в градусах Цельсия. Первая шкала имеет две точки: одна – абсолютный нуль температур, не воспроизводимый в опыте, и вторая – воспроизводимая опытным путем постоянная точка – тройная точка воды, т.е. такое состояние воды, при котором лед, жидкость и пар находятся в равновесии. Эта точка соответствует 273,16 К и 0,01ºС. В шкале Цельсия температура тройной точки воды принимается за нуль, а температура насыщения воды при давлении 0,1 МПа принимается за 100º. Связь между температурами по шкале Кельвина и Цельсия выражается уравнением Т = t + 273,15 К. Удельный объем. Удельный объем – объем единицы массы вещества:
Величина, обратная удельному объему, называется плотностью:
Для сравнения величин, характеризующих системы в одинаковых состояниях, вводится понятие «нормальные физические условия»: p = = 760 мм рт. ст. = 101325 Па; T = 273,15 K. В разных отраслях техники и разных странах вводят свои, несколько отличные от приведенных «нормальные условия». Например, «технические»: p = 735,6 мм рт. ст. = 98 кПа, t = 15ºC и т.д. Если все термодинамические параметры постоянны во времени и одинаковы во всех точках системы, то такое состояние системы называется равновесным, а система называется равновесной. Если между различными точками в системе существуют разности температур, давлений и других параметров, то она является неравновесной. В такой системе под действием градиентов параметров возникают потоки теплоты, вещества и другие, стремящиеся вернуть ее в состояние равновесия. Опыт показывает, что изолированная система с течением времени всегда приходит в состояние равновесия и никогда самопроизвольно выйти из него не может. В классической термодинамике рассматриваются только равновесные системы.
|
||||
|
Последнее изменение этой страницы: 2016-07-16; просмотров: 366; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.221.147.141 (0.007 с.) |

 , (1.1)
, (1.1) – среднеквадратическая скорость движения молекул.
– среднеквадратическая скорость движения молекул. к площади поверхности dS, т.е.
к площади поверхности dS, т.е.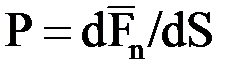 . (1.2)
. (1.2) = 0. И только абсолютное давление является параметром состояния, входящим в термодинамические уравнения.
= 0. И только абсолютное давление является параметром состояния, входящим в термодинамические уравнения.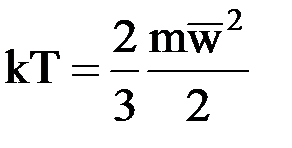 , (1.3)
, (1.3) – среднеквадратичная скорость движения молекул.
– среднеквадратичная скорость движения молекул.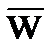 = 0.
= 0. м3/кг. (1.4)
м3/кг. (1.4)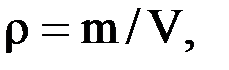 кг/м3. (1.5)
кг/м3. (1.5)


