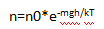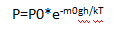Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Вопрос 1. Статистический и термодинамический методы исследования.Содержание книги
Поиск на нашем сайте
Вопрос 1. Статистический и термодинамический методы исследования. Для изучения тепловых процессов в естествознании сформировался Термодинамический метод исследования. Он заключается в том, что состояние термодинамической системы задается Термодинамическими параметрами (параметрами системы), характеризующими ее свойства. В качестве таковых обычно выбирают Абсолютную Температуру (температуру по шкале Кельвина – Т), Давление (Р), Молярный объем (объем одного моля вещества – VМ). Параметры связаны друг с другом, поэтому состояние системы можно представить в виде уравнения. Например, для идеального газа массой в один моль эту связь выражает уравнение Менделеева-Клапейрона: PVМ = RT Где R = 8,314 Дж/моль * К – универсальная газовая постоянная. Поведение громадного числа молекул, составляющих макротела, изучается также Статистическим Методом, который основан на том, что свойства макротел определяются свойствами молекул, особенностями их движения (скоростью, энергией, импульсом и т. д.) и взаимодействия. Например, температура может быть выражена через среднее значение кинетической энергии движения молекул. Статистический метод дает представление о механизме тепловых процессов, рассматривая их как бы изнутри макротел, он существенно дополняет термодинамический метод. Основные законы термодинамики также имеют статистический смысл. Поэтому оба метода составляют основу термодинамики. Вопрос 2. Основные положения молекулярно-кинетической теории. - Все вещества состоят из молекул, а молекулы из атомов, что не является пределом делимости. - Между молекулами действуют силы взаимного притяжения и отталкивания. - Молекулы, составляющие тело, находятся в состоянии непрерывного и беспорядочного движения.
Вопрос 3. Уравнение состояния идеального газа. Молекулы газа ударяются между собой и о стенки сосуда, т.е. действуют с некоторой силой на стенки (давление газа). Сила удара зависит от скорости, следовательно, давление является функцией кинетической энергии. Идеальный газ – воображаемый газ, молекулы которого представлены упругими шариками не связанными межмолекулярными связями. P=nkT (k – постоянная Бойля k=1.38*1023 Дж/К)
Вопрос 4. Экспериментальные газовые законы. Состояние любой массы газа характеризуется параметрами состояния: давление температура, объем. Процесс их изменения называется газовым процессом. Закон Бойля – Мариотта: Закон Гей – Люссака: P=const, v0/v=T0/T где Т0 начальная температура газа, Т – температура газа, V0 – объем газа при T0, V – объем газа при Т. V=V0(1+αT) α – температурный коэффициент объемного расширения. Закон Шарля: V=const, P/P0=T/T0 P= P0(1+ϒ) ϒ- термический коэффициент давления газа. Закон Дальтона: Порциальное давление газа, входящего в газовую смесь – давление, которое имел бы этот газ, если бы он один занимал весь объем. Давление газовой смеси равно сумме порциальных давлений, входящих в нее газов. P=P1+P2+P3…. Закон Авогадро: При одинаковой температуре и давлении массы любых газов занимают одинаковые объемы. Закон Клайперона: PV/T=const, PVT=const. Закон Мейделеева-Клайперона: PV=(m/M)*RT. M – молярная масса, m – масса, R – универсальная газовая постоянная.
Вопрос 6. Распределение Больцмана. Барометрическая формула. Распределение Больцмана – это распределение молекул идеального газа по потенциальным энергиям во внешнем потенциальном поле.
n – плотность молекул в окрестности точки поля. Если принять что внешним потенциальным полем является гравитационное поле, то Wp=mgh.
Барометрическая формула:
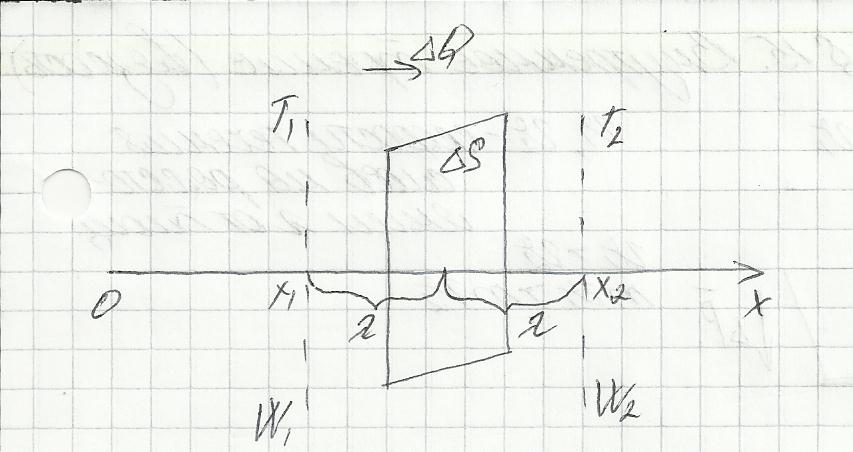
Вопрос 9. Теплопроводность. Закон Фурье. Пусть в некотором объеме убывает температура:
Из термодинамики известно, что кинетическая энергия одной молекулы равна:
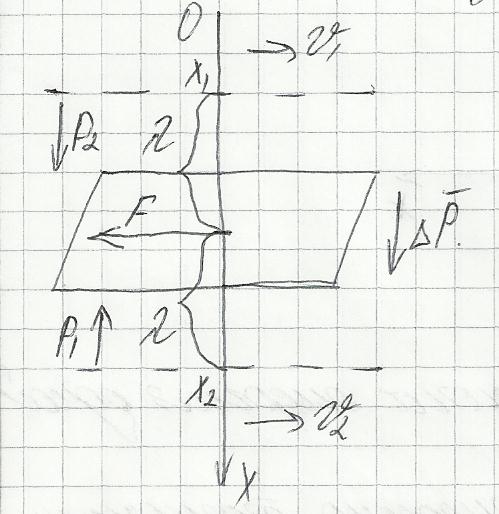
Вопрос 11. Внутреннее трение. Закон Ньютона.
Теплопроводность и вязкость не зависят от давления, однако, у сильно разреженных газов теплопроводность и вязкость пропорциональны давлению если средняя длина свободного пробега превышает размеры сосуда.
Теплоемкость газа. Теплоемкость – количество теплоты, которое нужно сообщить телу для нагрева на 10. Удельная теплоемкость – количество теплоты, необходимое для нагрева 1кг тела на 10. Молярная теплоемкость – количество теплоты, необходимое для нагрева 1 моль вещества на
Вопрос 22. Закон Кулона. Точечным называется заряд, сосредоточенный на теле, линейные размеры которого пренебрежительно малы по сравнению с расстоянием до других заряженных тел, с которыми он взаимодействует.
Вопрос 38. Ток смещения. Пусть к обкладкам плоского конденсатора приложена переменная ЭДС.
Тогда в проводах пойдет переменный ток проводимости, обусловленный движением электронов. Между обкладками, разделенными вакуумом заряды отсутствуют и токопроводимости быть не может. Масвелл предположил, что ток проводимости, индукций во внешней цепи замыкается внутри конденсатора особым током смещения, пропорциональным скорости изменения напряженности электрического поля и равным току проводимости во внешней цепи. Ответственность за него Максвелл приписал магнитному полю напряженностью Н. ток смещения в вакууме не представляет перемещения зарядов и не выделяет тепла. Если пространство между пластинами заполнено диэлектриком, то изменение напряженности электрического поля сопровождается поворачиванием диполей, полярных молекул или атомов, составляющих диэлектрик. Смещение зарядов при поворотах диполей образует дополнительный ток смещения или поляризационный ток. Вопрос 53. Эффект Комптона. Корпускулярно-волновой дуализм – дано положение говорит о двойственной природе света. С одной стороны свет является электромагнитной волной и обладает всеми свойствами, волн, а с другой стороны свет представляет собой поток фотонов, несущих энергию (фотоэффект, давление света). Ярчайшим подтверждением двойственной природы света является эффект Комптона, показывающий экспериментально, что при рассеивании рентгеновских лучей, свет ведет себя двояко. Одна часть лучей проходит без изменений, а другая часть рассеивается в соответствии со значениями упругого столкновения двух частиц фотона и электрона. Результат опыта состоит в том, что часть рентгеновского излучения проходит через вещество без изменений, а часть рассеивается с изменением длины волны. Это изменение зависит от длины волны падающего излучения и от природы рассеивающего вещества. ∆λ=λ’-λ ∆λ=λc(1-cosα), где λc=h/m0c=2.43*10-12м – комптоновская длина волны электрона. Объяснить этот эффект можно с точки зрения дуализма света, с одной стороны свет проявляет свойства волны и дифрагирует внутри вещества, выходя из него без изменений, с другой стороны, свет проявляет свойства частиц, которые при упругом столкновении с электронами отдают им часть своей энергии и отклоняются ри этом на определенный угол.
Вопрос 55. Планетарная модель атома Резерфорда. Модель Резерфорда предложена 1911г. Суть состоит в следующем: вся масса и весь положительный заряд сосредоточены в атомном ядре очень малого размера, вокруг ядра движутся отрицательные электроны, заряд ядра равен заряду электронов, т.е. атом электронейтрален. Однако, электрон двигаясь вокруг ядра, теряет некоторую часть своей энергии и со временем, израсходовав ее всю, должен упасть на ядро, по мере приближения электрона к ядру, его скорость должна возрастать, при этом увеличивается частота его вращения и соответственно спектр излучения атома должен быть сплошным. Оказалось, что атомы имеют ленейчатый спектр, который можно распределить по сериям, и линии одной серии связаны между собой закономерностью: γ=R*Z2(1/n2-1/m2), где Z –зарядовое число ядра атома, R-const (Постоянная Ридберга), m и n – целочисленные значения.
Вопрос 56. Постулаты Бора. Линейчатый характер спектра говорит о том, что атом видимо излучает или поглощает энергию не непрерывно, а определенными порциями – квантами. В 1913г Бор, исходя из представлений о дискретности, изучил и усовершенствовал модель Резерфорда создав квантовую модель атомов, которая базируется на двух постулатах Бора: 1) Атом устойчив только в состояниях, соответствующих дискретным значениям энергии, при этом должно выполняться условие квантования орбит: mvr= nh/2π 2) Переход атома из одного состояния в другое сопровождается поглощением или излучением квантом энергии, определяемого условием частот h γ= W1-W2 γ=(W1-W2)/h – правило частот Бора.
Вопрос 1. Статистический и термодинамический методы исследования. Для изучения тепловых процессов в естествознании сформировался Термодинамический метод исследования. Он заключается в том, что состояние термодинамической системы задается Термодинамическими параметрами (параметрами системы), характеризующими ее свойства. В качестве таковых обычно выбирают Абсолютную Температуру (температуру по шкале Кельвина – Т), Давление (Р), Молярный объем (объем одного моля вещества – VМ). Параметры связаны друг с другом, поэтому состояние системы можно представить в виде уравнения. Например, для идеального газа массой в один моль эту связь выражает уравнение Менделеева-Клапейрона: PVМ = RT Где R = 8,314 Дж/моль * К – универсальная газовая постоянная. Поведение громадного числа молекул, составляющих макротела, изучается также Статистическим Методом, который основан на том, что свойства макротел определяются свойствами молекул, особенностями их движения (скоростью, энергией, импульсом и т. д.) и взаимодействия. Например, температура может быть выражена через среднее значение кинетической энергии движения молекул. Статистический метод дает представление о механизме тепловых процессов, рассматривая их как бы изнутри макротел, он существенно дополняет термодинамический метод. Основные законы термодинамики также имеют статистический смысл. Поэтому оба метода составляют основу термодинамики.
|
||||
|
Последнее изменение этой страницы: 2016-08-01; просмотров: 280; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.147.57.239 (0.009 с.) |