
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
I. 1. 3 термодинамический процесс. ИзопроцессыСодержание книги
Поиск на нашем сайте
Если какой-либо из внешних параметров системы изменяется, то происходит изменение состояния термодинамической системы, называемое термодинамическим процессом. Термодинамический процесс называется равновесным (равновесный, квазистатический процесс), если система бесконечно медленно проходит непрерывный ряд бесконечно близких термодинамических равновесных состояний. Все процессы, которые не удовлетворяют перечисленным условиям, называются неравновесными. Реальные процессы неравновесны, т.к. происходят с конечной скоростью. Однако они тем ближе к равновесным, чем медленнее происходят. Изопроцессы – термодинамические процессы, происходящие в системе с постоянной массой при каком–либо одном постоянном параметре состояния. Изотермический (изотермный) процесс происходит при постоянной температуре Изохорический (изохорный) процесс происходит при постоянном объёме Изобарический (изобарный) процесс протекает при постоянном давлении Адиабатический (адиабатный) процесс – термодинамический процесс, который происходит в системе без теплообмена с внешними телами.
I.1.4 ИДЕАЛЬНЫЙ ГАЗ. ГАЗОВЫЕ ЗАКОНЫ. УРАВНЕНИЕ СОСТОЯНИЯ ИДЕАЛЬНОГО ГАЗА
В молекулярно – кинетической теории рассматривается идеализированная модель реальных газов – идеальный газ. Идеальный газ – газ, молекулы которого не взаимодействуют друг с другом на расстоянии и имеют исчезающе малые собственные размеры. У реальных газов молекулы испытывают силы межмолекулярного взаимодействия. При взаимных столкновениях и соударениях со стенками сосуда молекулы идеального газа ведут себя как абсолютно упругие шары с диаметром Существующие в действительности газы при не слишком низких температурах и достаточно малых давлениях – разреженные газы – по своим свойствам близки к идеальному газу. Например, гелий при комнатной температуре и атмосферном давлении с хорошим приближением подчиняется законам идеальных газов. Опытным путем был установлен целый ряд законов, описывающих поведение идеальных газов. Закон Бойля-Мариотта: для данной массы газа при постоянной температуре произведение давления газа на его объем есть величина постоянная
При Для 2-х состояний
Изотерма – кривая, изображающая зависимость между величинами
Закон Гей-Люссака: объем данной массы газа при постоянном давлении изменяется линейно с температурой
При
Или другая форма записи закона
Для 2-х состояний
.
На диаграмме в координатах
Закон Шарля: давление данной массы газа при постоянном объеме изменяется линейно с температурой
При
Или другая форма записи закона
Для двух состояний
На диаграмме в координатах

Из формул (I.4) и (I.8) следует, что изобары и изохоры пересекают ось температур в точке Французский физик и инженер Б. Клапейрон вывел уравнение состояния идеального газа, объединив законы Бойля-Мариотта и Гей-Люссака. Уравнение Клапейрона, для данной массы газа
Для 2-х состояний
Русский учёный Д.И. Менделеев усовершенствовал уравнение Клапейрона, введя универсальную газовую постоянную Уравнение Клапейрона-Менделеева (уравнение состояния идеального газа), для любой массы газа имеет вид
или
где где
|
||||||||||
|
Последнее изменение этой страницы: 2016-09-20; просмотров: 117; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.145.79.214 (0.006 с.) |

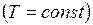 .
.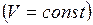 .
. .
. м (эффективный диаметр молекулы), зависящим от химической природы газа. Наличие эффективного диаметра означает, что между молекулами действуют силы взаимного отталкивания. Межмолекулярные силы притяжения быстро убывают с увеличением расстояния
м (эффективный диаметр молекулы), зависящим от химической природы газа. Наличие эффективного диаметра означает, что между молекулами действуют силы взаимного отталкивания. Межмолекулярные силы притяжения быстро убывают с увеличением расстояния  между молекулами и не проявляются практически при
между молекулами и не проявляются практически при  м.
м.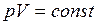 . (I.3)
. (I.3)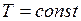 ;
;  .
.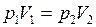 . (I.4)
. (I.4) и
и 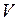 , характеризующими свойства вещества при постоянной температуре. Изотермы представляют собой равнобочные гиперболы, расположенные на графике тем выше, чем выше температура, при которой происходит процесс (рис.1).
, характеризующими свойства вещества при постоянной температуре. Изотермы представляют собой равнобочные гиперболы, расположенные на графике тем выше, чем выше температура, при которой происходит процесс (рис.1).
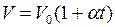 . (I.5)
. (I.5) ;
; 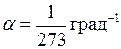 (в СИ:
(в СИ: 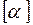 = K–1).
= K–1).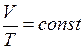 . (I.6)
. (I.6) . (I.7)
. (I.7)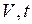 (рис.2) этот процесс изображается прямой, называемой изобарой.
(рис.2) этот процесс изображается прямой, называемой изобарой.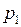

 . ( I.8 )
. ( I.8 ) ;
;  . (I.9)
. (I.9) . (I.10)
. (I.10) (рис.3) этот процесс изображается прямой, называемой изохорой.
(рис.3) этот процесс изображается прямой, называемой изохорой.
 , определяемой из условия
, определяемой из условия  . Если сместить начало отсчёта в эту точку, то происходит переход к шкале Кельвина
. Если сместить начало отсчёта в эту точку, то происходит переход к шкале Кельвина  .
. . (I.11)
. (I.11) . (I.12)
. (I.12)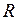 и постоянную Больцмана
и постоянную Больцмана 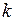 .
.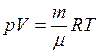 , (I.13)
, (I.13)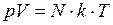 , (I.14)
, (I.14) – число молекул;
– число молекул;  .
.  ,
,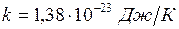 – постоянная Больцмана.
– постоянная Больцмана.


