
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
I. 2. 1 полная и внутренняя энергия системы. Теплота и работаСодержание книги
Поиск на нашем сайте Произвольная термодинамическая система, находящаяся в любом термодинамическом состоянии, обладает полной энергией – кинетической энергии – потенциальной энергии – внутренней энергии
Термодинамика изучает общие свойства тел и различные процессы в них, сопровождающиеся превращениями различных видов энергии в тепловую и, наоборот. В ее основу положено небольшое число наиболее общих законов природы. Сформулированный на основе обобщения всех известных в настоящее время в физике опытных данных закон сохранения и превращения энергии является одним из основных постулатов термодинамики. Закон сохранения энергии приобретает в термодинамике специальный вид. При его применении необходимо учитывать так называемую внутреннюю энергию тела. Внутренней энергией тела или термодинамической системы называется энергия, зависящая только от термодинамического состояния тела (системы). Для неподвижной системы, не находящейся во внешних силовых полях, внутренняя энергия совпадает с полной энергией. Внутренняя энергия совпадает также с энергией покоя тела (системы) и включает в себя энергию всех видов внутренних движений в теле (системе) и энергию взаимодействия всех частиц (атомов, молекул, ионов и т.д.), входящих в тело (систему). Например, внутренняя энергия газа многоатомных молекул состоит из а) кинетической энергии теплового поступательного и вращательного движения молекул; б) кинетической и потенциальной энергии колебаний атомов в молекулах; в) потенциальной энергии, обусловленной межмолекулярными взаимодействиями; г) энергии электронных оболочек атомов и ионов; д) кинетической энергии и потенциальной энергии взаимодействия нуклонов в ядрах атомов. В процессах, происходящих при не очень высоких температурах, когда ионизация и возбуждение не играют существенной роли, пункты г) и д) обычно не изменяются. В этих условиях они не учитываются в балансе внутренней энергии, и внутренняя энергия системы будет складываться из кинетической энергии теплового движения частиц вещества и их потенциальной энергии. Для идеального газа не учитывается слагаемое в). Внутренняя энергия является однозначной функцией термодинамического состояния системы. Значение внутренней энергии в любом состоянии не зависит от того, с помощью какого процесса система пришла в данное состояние. Изменение внутренней энергии при переходе системы из состояния 1 в состояние 2 равно Внутренняя энергия для произвольной массы идеального газа
где Внутренняя энергия изолированной системы может изменяться двумя способами – совершением механической работы · Если работа совершается над системой, то система приобретает соответствующее количество теплоты, и значения Работа. О работе можно говорить только тогда, когда происходит изменение состояния тела (или системы) при изменении внешних параметров. Различаются работа Работой расширения идеального газа называется работа, которую совершает газ против внешнего давления, изменяя свой внешний параметр объем. Элементарная работа
где Полную работу
Результат интегрирования определяется характером зависимости между давлением и объёмом газа. Данное выражение справедливо при любых изменениях объёма твёрдых, жидких и газообразных тел. При изобарическом процессе работа расширения изображается на диаграмме
 
На диаграмме Работа расширения, совершаемая телом (системой тел), зависит от характера процесса изменения его состояния. Это видно из рис.8, где площади под кривыми процессов (1 I 2) и (1 II 2) различны. Работа, совершенная системой в том или ином процессе, является мерой изменения её энергии в этом процессе. При совершении работы энергия упорядоченного движения одного тела переходит в энергию упорядоченного движения другого тела (или его частей). Например, газ, расширяющийся в цилиндре двигателя внутреннего сгорания, перемещает поршень и передаёт ему энергию.
Теплота. Это такая форма передачи энергии, при которой осуществляется непосредственный обмен энергией между хаотически движущимися частицами взаимодействующих тел. При этом за счёт переданной телу энергии усиливается неупорядоченное движение его частиц, т.е. увеличивается внутренняя энергия тела. Процесс передачи внутренней энергии без совершения работы называется теплообменом. Мерой энергии, переданной в форме теплоты в процессе теплообмена, служит величина, называемая количеством теплоты. Теплота, и работа, обладают тем общим свойством, что они существуют лишь в процессе передачи энергии. Но являются качественно неравноценными формами передачи энергии. В форме работы передаётся энергия упорядоченного движения. Если над телом совершается работа, то это может привести к увеличению любого вида энергии данного тела или других тел. Если телу передаётся энергия в форме теплоты, то это увеличивает энергию хаотического теплового движения его частиц и непосредственно приводит только к увеличению внутренней энергии тела.
I.2.2 ТЕПЛОЁМКОСТЬ ВЕЩЕСТВА Теплоёмкостью
Значение теплоёмкости тела зависит от массы тела, его химического состава, термодинамического состояния и процесса, в котором сообщается теплота Из определения теплоёмкости следует, что при адиабатном процессе, когда При изотермическом процессе Удельной теплоёмкостью вещества с называется физическая величина, равная количеству теплоты, необходимому для нагревания 1 кг вещества на 1 К
Или другое определение удельной теплоёмкости. Удельной теплоёмкостью вещества называется теплоёмкость единицы массы вещества. Для однородного тела
где
Молярной теплоёмкостью вещества
где Или молярной (мольной) теплоёмкостью называется теплоёмкость одного моля вещества
где Различают теплоёмкости при постоянном объёме и постоянном давлении, если в процессе нагревания вещества его объём или давление поддерживаются постоянным. Молярная теплоёмкость газа при постоянном объёме
где
Молярная теплоёмкость газа при постоянном давлении
Молярные теплоёмкости газа
Уравнение (I.61), показывает, что При рассмотрении термодинамических процессов важно знать характерное для каждого газа отношение
где Из формул (I.59) и (I.60) следует, что молярные теплоёмкости определяются лишь числом степеней свободы и не зависят от температуры.
|
||||
|
Последнее изменение этой страницы: 2016-09-20; просмотров: 215; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.156 (0.007 с.) |

 , складывающейся из:
, складывающейся из:
 механического движения системы как целого (или её макроскопических частей);
механического движения системы как целого (или её макроскопических частей);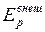 системы во внешних силовых полях (например, электромагнитном, гравитационном);
системы во внешних силовых полях (например, электромагнитном, гравитационном);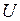
 . (I.50)
. (I.50) и не зависит от вида процесса перехода
и не зависит от вида процесса перехода  . Если система совершает круговой процесс, то полное изменение её внутренней энергии равно нулю:
. Если система совершает круговой процесс, то полное изменение её внутренней энергии равно нулю:  .
.
 , (I.51)
, (I.51) – масса газа;
– масса газа; 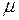 – молярная масса.
– молярная масса. и путем теплопередачи (в этом случае изменение внутренней энергии измеряется особой физической величиной, называемой количеством теплоты –
и путем теплопередачи (в этом случае изменение внутренней энергии измеряется особой физической величиной, называемой количеством теплоты –  ).
).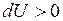 , при уменьшении
, при уменьшении 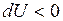 .
. , которая совершается системой над внешними телами, и работа
, которая совершается системой над внешними телами, и работа 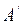 , которая совершается внешними телами над системой. Эти работы численно равны и противоположны по знаку:
, которая совершается внешними телами над системой. Эти работы численно равны и противоположны по знаку:  . Работа
. Работа  определяется формулой
определяется формулой , (I.52)
, (I.52) – внешнее давление;
– внешнее давление;  – изменение объёма системы.
– изменение объёма системы.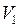 до
до 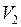 , найдём интегрированием формулы (I.52)
, найдём интегрированием формулы (I.52) . (I.53)
. (I.53) площадью заштрихованного прямоугольника (рис.7).
площадью заштрихованного прямоугольника (рис.7). и
и  .
.

 тела называется физическая величина, численно равная отношению количества теплоты
тела называется физическая величина, численно равная отношению количества теплоты  , сообщаемого телу, к изменению
, сообщаемого телу, к изменению  температуры тела в рассматриваемом термодинамическом процессе:
температуры тела в рассматриваемом термодинамическом процессе: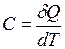 . (I.54)
. (I.54) , теплоёмкость равна нулю.
, теплоёмкость равна нулю. понятие теплоёмкости не имеет смысла (
понятие теплоёмкости не имеет смысла ( ).
).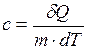 . (I.55)
. (I.55) , (I.56)
, (I.56) называется физическая величина, равная количеству теплоты, необходимому для нагревания 1 моля вещества на 1 К
называется физическая величина, равная количеству теплоты, необходимому для нагревания 1 моля вещества на 1 К , (I.57)
, (I.57) – количество вещества, выражающее число молей.
– количество вещества, выражающее число молей.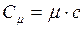 , (I.58)
, (I.58)
 , (I.59)
, (I.59) – число степеней свободы молекулы;
– число степеней свободы молекулы;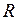 – универсальная (молярная) газовая постоянная.
– универсальная (молярная) газовая постоянная.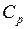
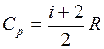 . (I.60)
. (I.60) . (I.61)
. (I.61) , (I.62)
, (I.62) – безразмерная величина, называемая коэффициентом Пуассона (показатель адиабаты).
– безразмерная величина, называемая коэффициентом Пуассона (показатель адиабаты).


