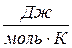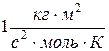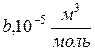Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Единицы измерения важнейших физических величинСодержание книги
Поиск на нашем сайте
Таблица Б.2. Универсальные физические постоянные
Таблица Б.3. Плотности Газы при нормальных условиях
Жидкости
Твердые тела
Таблица Б.4. Эффективные диаметры молекул и атомов
Таблица Б.5. Постоянные Ван –дер –Ваальса
Таблица Б.6.
Критические значения температуры и давления
Таблица Б.7. Коэффициенты теплового расширения Линейное расширение
Таблица Б.8. Коэффициенты теплопроводности
Таблица Б.9. Коэффициенты внутреннего трения (вязкости) Жидкостей, газови паров
Таблица Б.10. Коэффициенты поверхностного натяжения жидкостей (при 200 С)
ПЕРЕЧЕНЬ КЛЮЧЕВЫХ СЛОВ 1. Газ (идеальный, реальный). 2. Газовые законы (Бойля–Мариотта, Дальтона, Гей–Люссака, Шарля, Ван– дер–Ваальса, Фика, Фурье, Ньютона). 3. Изопроцессы в газах (адиабатический, изотермический, изобарический, изохорический, политропный). 4. Метод (термодинамический, молекулярно–кинетический, статистический). 5. Начала в термодинамике (Первое, Второе, теорема Нернста). 6. Постоянная (универсальная газовая, Авогадро, Больцмана, Пуассона). 7. Работа (термодинамической системы, расширения газа, сил поверхностного натяжения в жидкостях). 8. Распределение газовых молекул (Максвелла, Больцмана). 9. Температура. 10.Температурная шкала (Кельвина, Цельсия). 11.Теплоемкость (общая, удельная, молярная, при постоянном объеме, при постоянном давлении, при постоянной температуре, при адиабатическом
процессе). 12.Термодинамический процесс (обратимый, необратимый, равновесный, неравновесный, круговой). 13.Термодинамическая система. 14.Термодинамические параметры (давление, объем, температура и т.п.) 15.Уравнение состояния (термодинамической системы, Клапейрона– Менделеева, Ван –дер–Ваальса). 16.Фаза (газообразная, жидкая, твердая). 17.Цикл и его КПД (общий, Карно). 18.Энергия (внутренняя, теплового движения, идеального газа, реального газа). 19.Энтропия. 20.Явления переноса (диффузия, внутреннее трение (вязкость), теплопроводность).
БИБЛИОГРАФИЧЕСКИЙ СПИСОК Основная литература 1. Савельев, И.В. Курс общей физики: в 5 кн. Кн. 1 / И.В. Савельев. – М.: Наука; Физматлит, 1989. – 350 с. 2. Трофимова, Т.И. Курс физики: Учебное пособие для инженерно-технических специальностей вузов / Т.И. Трофимова. – 9–е изд., перераб. и доп. – М,: Academia, 2004. – 558 с. 3. Трофимова, Т.И. Курс физики. / Т.И. Трофимова. – М.: Высшая школа, 2003. – 543 с. 4. Детлаф, А.А. Курс физики / А.А. Детлаф, Б.М. Яворский. – М.: Высшая школа, 2001. – 718 с. 5. Волькенштейн, В.С. Сборник задач по общему курсу физики / В.С. Волькенштейн. – М.: Наука, 1999. – 327 с. 6. Чертов, А.Г. Задачник по физике / Чертов А.Г., Воробьев А.А. – М.: Интеграл-пресс, 1997. – 544 с. 7. Трофимова, Т.И. Сборник задач по курсу физики / Т.И.Трофимова. – М.: Высшая школа, 1996. – 303 с. 8. Трофимова, Т.И. Сборник задач по курсу физики с решениями / Т.И. Трофимова, З.Г. Павлова. – М.: Высшая школа, 2004. – 591 с. Дополнительная литература
1. Матвеев, А.Н. Молекулярная физика / А.Н. Матвеев. – М.: Высшая школа, 1987. – 360 с. 2. Грибов, Л.А. Основы физики / Грибов Л.А., Прокофьева Н.И. – М.: Гардарика, 1998. – 564 с. 3. Джанколи, Д.Д. Физика в 2 т. Т1 / Д.Д. Джанколи. – М.: Мир, 1989. – 653 с. 4. Сивухин, Д.В., Общий курс физики. Термодинамика и молекулярная физика. / Сивухин Д.В. – М.: Наука, 1975. – 550 с. 5. Трофимова, Т.И. Физика в таблицах и формулах. / Т.И. Трофимова. – М.: Дрофа, 2002. – 423 с. 6. Рубан И.И., Физика: Задания к практическим занятиям./ Рубан И.И., Жаврид С.М., Великевич Н.Е., Лагутина Ж.П. – М.: Высшая школа, 1989. – 235 с. 7. Кухлинг, Х. Справочник по физике: перевод с немецкого. / Х. Кухлинг. – М.: Мир, 1985. – 520 с. 8. Детлаф, А.А Справочник по физике / А.А. Детлаф, Б.М. Яворский. – М.: Наука, 1990. – 507 с. 9. Кибец, И.Н. Физика: Справочник. / Кибец И.Н. и Кибец В.И. – Харьков: Фолио; Ростов н/Д, Феникс, 1997. – 479 с. 10. Савельев, И.В. Сборник вопросов и задач по общей физике / И.В. Савельев. – М.: Наука, Физматлит, 1989. – 288 с. 11. Молекулярная физика и физические основы термодинамики. Методические указания к практическим занятиям для индивидуальной и самостоятельной работы студентов 1– го курса всех специальностей. / Т.С. Розанова, И.В. Ригина. – Красноярск: КГТА, 1995. – 32 с. 12. Молекулярная физика и термодинамика. Учебное пособие по изучению курса для студентов инженерных специальностей всех форм обучения. / А.В. Черных. – Красноярск: СибГТУ, 2003. – 72 с.
ОГЛАВЛЕНИЕ Введение………………………………………………………………………… 3
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-09-20; просмотров: 170; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.226.34.241 (0.01 с.) |