Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Гипотезы о естественном происхождении озоновой дырыСодержание книги
Поиск на нашем сайте
А вот российские ученые опубликовали подтверждение гипотезы о естественном происхождении антарктической озоновой дыры. В 1999 году в МГУ НПО «Тайфун» опубликовал научную работу, в которой, согласно расчетам геофизиков А.П. Капицы и А.А. Гаврилова, Антарктическая озоновая дыра существовала до того, как ее обнаружили прямыми экспериментальными методами в 1982 году, что, по мнению русских ученых, подтверждает гипотезу естественного происхождения озоновой дыры над Антарктидой. Авторами этой научной работы являлись А.П.Капица (член-корреспондент РАН) b А.А.Гаврилов (МГУ). Этим двум ученым удалось установить, что количество фактов, противоречащих антропогенной гипотезе происхождения Антарктической озоновой дыры, постоянно растет, а после доказательства, что данные аномально низких значений общего содержания озона в Антарктиде в 1957-1959 годах верны, стала очевидно, что причина озоновых дыр отлична от антропогенной. Результаты исследований А.П. Капицы и А.А. Гаврилова были опубликованы в Докладах Академии наук, 1999, том 366, № 4, с. 543-546
Концентрация стратосферного озона стала предметом серьезного изучения лишь в 70–80-х годах прошлого столетия. Вред, который наносит озоновому слою утечка в атмосферу таких веществ, как хлорфторуглероды (ХФУ) и гидрохлорфторуглероды (ГХФУ), был обнаружен почти случайно. В 1974 году химики из Калифорнийского университета Марио Молина (Mario Molina) и Фрэнк Шервуд Роланд (Frank Sherwood Rowland) предположили, что долгоживущие галогеносодержащие соединения, такие, как повсеместно использовавшиеся в то время хлорфторуглероды (ХФУ), попадая в атмосферу, могут разрушать стратосферный озон. Незадолго до этого с похожей гипотезой, касающейся, правда, другого вещества – закиси азота – выступил голландский физик Пол Крутцен (Paul Crutzen). К тому времени были накоплены данные, согласно которым количество поступающего на Землю ультрафиолетового излучения значительно возросло по сравнению с 1925 годом. Опасность ультрафиолета для живых организмов уже была хорошо изучена. Было достоверно установлено, что повышение интенсивности УФ-излучения затрудняет процесс фотосинтеза у растений и ведет к снижению урожайности сельскохозяйственных культур; от ультрафиолета гибнет фитопланктон – кормовая база обитателей Мирового океана; негативно влияет интенсивное УФ-излучение и на человека – растет восприимчивость к болезням, изменяется структура и пигментация кожи, повышается вероятность возникновения болезней глаз, раковых заболеваний, повреждения молекул ДНК (см. рис. 7).
Однако связь этих воздействий с разрушением озона вследствие человеческой деятельности казалась неочевидной. Более того, производители хладагентов и часть ученых выступили с жесткой критикой гипотезы, предполагавшей такую связь, отрицая само существование проблемы озоновых дыр. Доказательства правоты Крутцена, Роланда и Молины были получены в 1985 году. Анализ данных, собранных в рамках программы Антарктического управления Великобритании, показал, что значение наименьшей концентрации озона, обычно наблюдаемой в стратосфере над Антарктидой в середине октября, за период с 1975 по 1984 годы снизилось на 40%. Постепенно были установлены некоторые закономерности этого явления. В Южном полушарии сентябрь и октябрь – первые весенние месяцы, в это время солнце после долгой полярной зимы появляется над горизонтом и инициирует множество фотохимических реакций между молекулами озона и атомами хлора и брома, выделившихся из попавших в стратосферу органических соединений природного и антропогенного происхождения. Так гипотеза, высказанная десятью годами ранее, получила практическое подтверждение. То, что проблема озоновых дыр в атмосфере Земли действительно существует, было доказано полевыми исследованиями. «Я думаю, что во многом мы обязаны простой удаче, как и в случае многих других научных открытий. Нашу группу убедил график минимальных значений 11 дневных средних измерений, на котором было четко видно, что весеннее снижение концентрации носит систематический характер», – сказал Джонатан Шанклин (Jonatan Shanklin), который вместе со своими коллегами из Антарктического управления Великобритании, Джо Фарманом (Joe Farman) и Брайаном Гардинером (Brian Gardiner), собрал основные полевые данные. Фарман разработал в общих чертах химическую теорию, объяснявшую результаты наблюдений, и связал спады содержания озона с увеличением концентрации ХФУ, а Гардинер провел необходимый контроль качества данных.
Результаты исследований, говорящие о существовании озоновой дыры в атмосфере, оказались пугающими и в некоторой степени невероятными для ученых США, проводивших мониторинг озонового слоя при помощи сложных спутниковых систем. Первоначально проведенный ими анализ не показал никаких изменений в озоновом слое, но после повторного изучения данных со спутников его истощение было подтверждено. Уже тогда ученым было понятно: чтобы из атмосферы исчезли озоноразрушающие вещества и проблема озоновых дыр на Земле была бы решена, потребуются десятилетия, поскольку процессы разложения ОРВ идут медленно: так, срок жизни в атмосфере хладагента R12, одного из самых распространенных ХФУ, – около 100 лет. Ждать окончательного подтверждения этой теории было слишком опасно, и осознание этого побудило международное сообщество к принятию незамедлительных мер.
Убедительное подтверждение уменьшение концентрации стратосферного озона заставил мировое сообщество задуматься над тем, как сохранить озоновый слой Земли. В 1985 году в Вене была созвана конференция, участники которой согласились с необходимостью принятия мер по защите озонового слоя. Рамочный характер Венской конвенции 1985 года не предусматривал каких-либо конкретных действий со стороны присоединившихся к ней стран. Год спустя охрана озонового слоя вновь стала предметом многосторонних переговоров. Канада, США, Норвегия, Финляндия, Австралия и Судан считали, что выход – в замораживании их производства и в значительном ограничении потребления. Большинство европейских стран было согласно только на ограничение производства. Развивающиеся страны выступали против принятия каких-либо административных мер, так как опасались, что они могут стать препятствием для развития промышленности. СССР и Япония придерживались сходной позиции, а практически все крупнейшие производители ОРВ были категорически против принятия любых ограничений. С 1985 года охрана озонового слоя стала одним из важных направлений деятельности для многих стран мира. Поиски консенсуса в ходе продолжительных и трудных переговоров и консультаций завершились 16 сентября 1987 года, когда тридцать шесть стран подписали документ, получивший название "Монреальский протокол по веществам, разрушающим озоновый слой". В последующие годы были приняты четыре поправки к Монреальскому протоколу, скорректировавшие (в сторону ужесточения) обязательства, вытекающие из этого международного документа. По состоянию на сегодняшний день сторонами Венской конвенции и Монреальского протокола являются 197 стран, Лондонской поправки (1990 г.) – 196 стран, Копенгагенской поправки (1992 г.) – 195 страны, Монреальской поправки (1997 г.) – 188 страна, Пекинской поправки (1999 г. – 175 стран. Монреальский протокол учитывает технологический и экономический уровни различных стран. Поскольку принятие мер по защите озонового слоя (прежде всего – отказ от ОРВ), требовало много времени и средств, развивающимся странам была предоставлена отсрочка. Тем не менее, вещества с наибольшим озоноразрушающим потенциалом (ОРП) – хлорфторуглероды (ХФУ) и галлоны (бромхладоны) – практически полностью выведены из обращения. Все это время не прекращались наблюдения за стратосферным озоном, позволившие сделать вывод о действенности предпринятых мер по охране озонового слоя. Минимум концентрации был достигнут в 1997 году, что вполне объяснимо — газы из нижних слоев атмосферы попадают в верхние ее слои с задержкой в несколько лет. После 1997 года начал наблюдаться постепенный рост концентрации озона. При этом, максимум концентрации хлора в атмосфере был отмечен в 1993 году, и за последние годы его содержание снизилось на 15%. Конечно, об отсутствии ХФУ в атмосфере и полном восстановлении озонового слоя говорить еще рано – например, время жизни в атмосфере R12, производство которого прекратилось только к 1 января 2010 года, а заправленное им оборудование продолжает работать, составляет около ста лет. Тем не менее, наблюдения дают понять, что сохранение озонового слоя – задача выполнимая при условии участия в ее решении всех государств планеты.
В 2007 году Сторонами Монреальского протокола было принято решение об ускорении вывода из обращения ГХФУ. Изначально предполагавшийся график поэтапного вывода из оборота ГХФУ был «ускорен», в результате чего все развитые страны (включая Российскую Федерацию) должны к 2015 году сократить объем производства и потребления ГХФУ на 90% от базового уровня, что составит для нашей страны предельный уровень в 399,6 т ОРП. Подписав Монреальский протокол, Россия взяла на себя определенные обязательства по решению проблемы истощения озонового слоя. Производство в Российской Федерации озоноразрушающих веществ (ОРВ), перечисленных в приложениях А, В и Е к Монреальскому протоколу по веществам, разрушающим озоновый слой, было прекращено в конце 2000 года. К этим веществам относятся: хлорфторуглероды (ХФУ), четыреххлористый углерод (ЧХУ), метилхлороформ (МХФ), галоны и бромистый метил. Именно эти вещества являются основной причиной истощения озонового слоя. В настоящее время перед нашей страной стоит задача выполнения второго этапа Монреальского протокола – обеспечение поэтапного вывода из обращения ОРВ, перечисленных в приложении C к Монреальскому протоколу, т.е. – гидрохлорфторуглеродов (ГХФУ). В конце октября 2009 года в Министерстве природных ресурсов и экологии Российской Федерации прошла конференция, посвященная ограничению оборота веществ, способствующих разрушению озонового слоя Земли. В ее рамках были разработаны предложения к Плану поэтапного сокращения производства и потребления ГХФУ, предусматривавшие внедрение системы квотирования производства и ввоза этих веществ, а также поэтапного сокращения их потребления в ряде секторов российской экономики. Задержки с утверждением квот на импорт ОРВ и отсутствие собственного производства самого популярного ГХФУ – R22 привели к дефициту этого и других хладонов уже к концу февраля 2010 года.
Отсутствие понимания серьезности проблемы истощения озонового экрана и недостаток доступной информации о перспективах ГХФУ в качестве приемлемого технического решения для многих видов применения привел к тому, что на протяжении последних лет возросли объемы потребления этих хладонов, являющихся, хотя и в меньшей степени, чем ХФУ, причиной разрушения озонового экрана, а кроме того, обладающих большим потенциалом глобального потепления (ПГП). В частности, на территории страны был осуществлен перевод значительной части стратегических хранилищ продовольствия на R22 в многочисленных супер- и гипермаркетах, на продуктовых складах и терминалах было установлено новое холодильное оборудование, заправленное этим хладагентом. То же касается и кондиционеров, особенно бытовых: недорогое в эксплуатации и обслуживании, надежное оборудование на R22 различных производителей (преимущественно – азиатских) ввозилось (и, заметим, ввозится вплоть до настоящего времени) в нашу страну в объеме миллионов единиц. И чем большими запретами такое оборудование обрастало в развитых странах, тем доступнее оно становилось для нашего рынка. В сезон 2010 года, когда лето преподнесло жаркий сюрприз почти на всей Европейской части России, наблюдался рост продаж кондиционирующего оборудования, работающего на R22. Эти же тенденции наблюдались в 2011 году и, по всей видимости, продолжатся в 2012 году. Необходимость дальнейшего ремонта и сервисного обслуживания холодильного и климатического оборудования, а также обеспечения функционирования мощностей по производству теплоизоляционных изделий и материалов создало предпосылки для нелегального ввоза ГХФУ, чему способствовали отсутствие специальной аппаратуры для обнаружения и идентификации хладонов на таможенных постах и недостаточный уровень подготовки таможенных сотрудников. К сожалению, универсальной альтернативы самому массовому ГХФУ – R22, способной его заменить во всех видах климатической и холодильной индустрии, нет. Такие хладагенты, как R410А и R134a способны его заменить лишь для ряда видов применения и рассматриваются в качестве временного решения, т.к. гидрофторуглероды (ГФУ) являются мощными парниковыми газами и подпадают под действующие и будущие ограничения в сфере предотвращения глобальных климатических изменений. Приемлемой с экологической точки зрения (то есть, не способствующей ни деградации озонового слоя, ни возникновению парникового эффекта) альтернативой ГХФУ остаются природные хладагенты, такие, как диоксид углерода, аммиак и углеводороды (пропан, изобутан). Однако у каждого из них есть свои недостатки: углекислотная система требует рабочего давления не ниже 80 бар, аммиак ядовит и горюч, углеводороды взрывоопасны.
В сфере производства вспененных материалов опробованы технологии с использованием альтернативных вспенивающих агентов, практически не уступающих ГХФУ по потребительским свойствам: такие, как диоксид углерода в жидком виде или в смеси с этанолом или водой, пентан и циклопентан, и технологии работы с ними давно отработаны. Проблемы могут возникнуть лишь при техническом перевооружении предприятий, т.к. для его осуществления потребуется замена технологического оборудования и оснастки. В рамках Проекта ЮНИДО/ГЭФ – Минприроды России предполагается оказать содействие ряду промышленных предприятий по выводу ГХФУ из оборота и переходу на безопасные для озонового слоя и климата планеты природные вещества. Для осуществления этой стратегии потребуется реализация целого комплекса мер: конверсия предприятий, обучение и сертификация монтажников и специалистов, создание предприятий для сбора, регенерации и утилизации ГХФУ и других видов ОРВ, составление реестра существующих банков ОРВ и обеспечение функционирования ряда секторов российской экономики в переходный период. АНАЛИТИКА КИСЛОТНЫХ ДОЖДЕЙ http://kisldoj.narod.ru/ с дополнениями Кислотность водного раствора определяется присутствием в нем положительных водородных ионов Н+ и характеризуется концентрацией этих ионов в одном литре раствора C (H+) (моль/л или г/л). Щелочность водного раствора определяется присутствием гидроксильных ионов ОН– и характеризуется их концентрацией C (ОН–). Как показывают расчеты, для водных растворов произведение молярных концентраций водородных и гидроксильных ионов – величина постоянная, равная C (H+) C (ОН–) = 10–14, другими словами, кислотность и щелочность взаимосвязанны: увеличение кислотности приводит к снижению щелочности, и наоборот. Раствор является нейтральным, если концентрации водородных и гидроксильных ионов одинаковы и равны (каждая) 10–7 моль/л. Такое состояние характерно для химически чистой воды. Из сказанного следует, что для кислых сред выполняется условие: 10–7 < C (H+) Ј 100, для щелочных сред: 10–14 Ј C (H+) < 10–7. На практике степень кислотности (или щелочности) раствора выражается более удобным водородным показателем рН, представляющим собой отрицательный десятичный логарифм молярной концентрации водородных ионов: рН = –lg C (H+). Например, если в растворе концентрация водородных ионов равна 10–5 моль/л, то показатель кислотности этого раствора рН = 5. При этом изменению показателя кислотности рН на единицу соответствует десятикратное изменение концентрации водородных ионов в растворе. Так, концентрация водородных ионов в среде с рН = 2 в 10, 100 и 1000 раз выше, чем в среде с рН = 3, 4 и 5 соответственно. В кислых растворах рН < 7, и чем меньше, тем кислее раствор. В щелочных растворах рН > 7, и чем больше, тем выше щелочность раствора. Шкала кислотности идет от рН = 0 (крайне высокая кислотность) через рН = 7 (нейтральная среда) до рН = 14 (крайне высокая щелочность). Показатель кислотности рН различных веществ, встречающихся в повседневной жизни, приведен на рис. 1.
Чистая природная, в частности дождевая, вода в отсутствие загрязнителей тем не менее имеет слабокислую реакцию (рН = 5,6), поскольку в ней легко растворяется углекислый газ с образованием слабой угольной кислоты: СО2 + Н2О
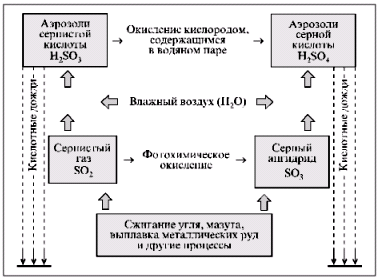
Для определения показателя кислотности используют различные рН-метры, в частности дорогостоящие электронные приборы. Простым способом определения характера среды является применение индикаторов – химических веществ, окраска которых изменяется в зависимости от рН среды. Наиболее распространенные индикаторы – фенолфталеин, метилоранж, лакмус, а также естественные красители из красной капусты и черной смородины. Достаточно точно показатель кислотности рН измеряется с помощью индикаторной бумаги, содержащей кислотореагирующие пигменты. Главные кислотообразующие выбросы в атмосферу – диоксид серы SO2 (cернистый ангидрид, или сернистый газ) и оксиды азота NО х (монооксид, или оксид азота NО, диоксид азота NO2 и др.). Природными источниками поступления диоксида серы в атмосферу являются главным образом вулканы и лесные пожары. Естественная фоновая концентрация SО2 в атмосфере достаточно стабильна, включена в биохимический круговорот и для экологически благополучных территорий России равна 0,39 мкг/м3 (Арктика) – 1,28 мкг/м3 (средние широты). Эти концентрации значительно ниже принятого в мировой практике предельно допустимого значения (ПДК) по SО2, равного 15 мкг/м3. Общее количество диоксида серы антропогенного происхождения в атмосфере сейчас значительно превышает ее естественное поступление и составляет в год около 100 млн т (для сравнения: природные выбросы SO2 в год равны примерно 20 млн т). Из них на долю США приходится 20%, на долю России – менее 10%. Диоксид серы образуется при сжигании богатого серой горючего, такого, как уголь и мазут (содержание серы в них колеблется от 0,5 до 5–6%), на электростанциях (~40% антропогенного поступления в атмосферу), в металлургических производствах, при переработке содержащих серу руд, при различных химических технологических процессах и работе ряда предприятий машиностроительной отрасли промышленности (~50%). При сжигании каждого миллиона тонн угля выделяется около 25 тыс. т серы в виде главным образом ее диоксида (до триоксида окисляется менее 3% серы); в 4–5 раз меньше окисленной серы дает сжигание мазута. Как показывают данные, приведенные в таблице, в России выбросы диоксида серы составляют более 30% всех вредных промышленных выбросов. На предприятиях энергетической отрасли промышленности, черной и цветной металлургии доля выбросов диоксида серы составляет примерно 40 и 50% соответственно. Меньше доля выбросов SO2 предприятиями нефтедобывающей, нефтеперерабатывающей, угольной и газовой отраслей промышленности – около 8% собственных выбросов загрязняющих веществ и около 5% суммарных выбросов и оксида серы предприятиями России, хотя предприятия этих отраслей дают примерно пятую часть всех техногенных выбросов загрязняющих веществ. Анализ техногенных источников выбросов сернистого газа в атмосферу показывает, что выбросы производят высокоразвитые промышленные страны, и это становится проблемой в первую очередь для них и их ближайших соседей. Данные мониторинга воздушной атмосферы свидетельствуют об увеличении в последние годы доли выбросов азотных соединений в закисление атмосферных осадков. Содержанию оксидов азота в атмосфере стали уделять внимание лишь после обнаружения озоновых дыр в связи с открытием азотного цикла разрушения озона. Природные поступления в атмосферу оксидов азота связаны главным образом с электрическими разрядами, при которых образуется NО, впоследcтвии – NО2. Значительная часть оксидов азота природного происхождения перерабатывается в почве микроорганизмами, т. е. включена в биохимический круговорот. Для экологически благополучных районов России естественная фоновая концентрация оксидов азота равна 0,08 мкг/м3 (Арктика) – 1,23 мкг/м3 (средние широты), что существенно ниже ПДК, равного 40 мкг/м3. Оксиды азота техногенного происхождения образуются при сгорании топлива, особенно если температура превышает 1000 °С. При высоких температурах часть молекулярного азота окисляется до оксида азота NО, который в воздухе немедленно вступает в реакцию с кислородом, образуя диоксид NO2 и тетраоксид диазота N2O4. Первоначально образующийся диоксид азота составляет лишь 10% выбросов всех оксидов азота в атмосферу, однако в воздухе значительная часть оксида азота превращается в диоксид – гораздо более опасное соединение. При высокотемпературном сгорании органического природного топлива происходят реакции двух типов: между кислородом воздуха и азотом, содержащимся в топливе (в угле содержание азота составляет в среднем около 1%, нефти и газе – 0,2–0,3%), и между кислородом воздуха и азотом, также содержащимся в воздухе. Техногенные мировые выбросы оксидов азота в атмосферу составляют в год около 70 млн т (природные выбросы оксидов азота, по некоторым оценкам, равны в год 700 млн т), примерно 30% их приходится на долю США, 25% – на долю стран Западной Европы и лишь несколько процентов – на долю России (см. табл.). Суммарные антропогенные выбросы оксидов азота в атмосферу больше. Дополнительный источник таких выбросов – сельское хозяйство, интенсивно использующее химические удобрения, в первую очередь содержащие соединения азота. Вклад этой отрасли мирового хозяйства в загрязнение атмосферы оксидами азота учесть трудно, по некоторым данным, поступление оксидов азота в атмосферу с сельскохозяйственных полей сопоставимо с промышленными выбросами. В России около 25% выбросов оксидов азота дает сжигание топлива на предприятиях электро- и теплоэнергетики, столько же – на предприятиях металлургической, машиностроительной и не связанной с процессами горения топлива химической отраслей промышленности (например, получение азотной кислоты и взрывчатых веществ). Главный источник техногенных оксидов азота в атмосфере – автотранспорт и другие виды моторного транспорта (около 40%). Распределение выбросов оксидов азота по основным отраслям промышленного производства приведены в таблице. Следует отметить, что при наметившейся в 1990-е гг. в России тенденции снижения выбросов загрязняющих веществ промышленными предприятиями (см. табл.) доля диоксида серы и оксидов азота в этих выбросах увеличивается. Суммарные выбросы всех загрязнителей в воздушную среду в 1997 г. по сравнению с 1993 г. сократились примерно на 30%, диоксида серы – примерно на 20%, оксидов азота – на 30%. Однако лишь 20% этих сокращений обусловлены природоохранными мероприятиями и усилением экологического контроля. Основная причина – спад производства, который за эти годы составил более 50%. Расхождение между относительными показателями спада производства и сокращения выбросов свидетельствует о росте отрицательного техногенного воздействия на окружающую среду в расчете на единицу произведенного продукта. Как показывает анализ, спад производства был неравномерен в различных отраслях хозяйства – наименьшим он оказался в самых экологически напряженных секторах (энергетика, металлургия и др.) и наибольшим – в отраслях, оказывающих относительно слабое воздействие на окружающую среду (машиностроение, оборонная отрасль промышленности и др.), при этом выбросы автотранспорта возросли, причем в крупных городах – очень значительно. Отметим еще два – экономических – аспекта рассматриваемой проблемы, оказывающих большое влияние на общую экологическую ситуацию в России, в том числе и связанную с кислотными осадками. К началу спада производства в России (1991) на предприятиях срок эксплуатации наличного промышленного оборудования был запредельным, в базовых отраслях промышленности (среди них те, что дают наибольшие кислотообразующие выбросы) средний возраст оборудования приближался к 30 годам. Изношенное оборудование требует больше ресурсов для эксплуатации, производит больше отходов, отличается повышенной аварийностью. Помимо отсутствия средств на капитальные затраты предприятия не имеют средств и на текущие затраты. В этих критических условиях для снижения удельных затрат на производимую продукцию предприятие экономит на всем и в первую очередь на охране окружающей среды, строительстве или модернизации очистных сооружений и других мероприятиях. Как следует из ежегодных государственных докладов Госкомэкологии «О состоянии окружающей природной среды в Российской Федерации», данных мониторинга Росгидромета, во многих регионах даже сократившийся поток загрязнений превосходит ассимиляционный потенциал соответствующих экосистем, т. е. является для них заведомо чрезмерным. Механизм образования кислотных осадков Диоксид серы, попавший в атмосферу, претерпевает ряд химических превращений, ведущих к образованию кислот (см. рис. 8).
Частично диоксид серы в результате фотохимического окисления превращается в триоксид серы (серный ангидрид) SО3: 2SO2 + O2 ® 2SO3, который реагирует с водяным паром атмосферы, образуя аэрозоли серной кислоты: SO3 + Н2O ® Н2SO4. Основная часть выбрасываемого диоксида серы во влажном воздухе образует кислотный полигидрат SО2• n H2O, который часто называют сернистой кислотой и изображают условной формулой Н2SО3: SO2 + H2O ® H2SO3. Сернистая кислота во влажном воздухе постепенно окисляется до серной: 2Н2SО3 + О2 ® 2Н2SO4. Аэрозоли серной и сернистой кислот приводят к конденсации водяного пара атмосферы и становятся причиной кислотных осадков (дожди, туманы, снег). При сжигании топлива образуются твердые микрочастицы сульфатов металлов (в основном при сжигании угля), легко растворимые в воде, которые осаждаются на почву и растения, делая кислотными росы. Аэрозоли серной и сернистой кислот составляют около 2/3 кислотных осадков, остальное приходится на долю аэрозолей азотной и азотистой кислот, образующихся при взаимодействии диоксида азота с водяным паром атмосферы: 2NО2 + Н2О ® НNО3 + НNО2. Существуют еще два вида кислотных дождей, которые пока не отслеживаются мониторингом атмосферы. Находящийся в атмосфере хлор (выбросы химических предприятий; сжигание отходов; фотохимическое разложение фреонов, приводящее к образованию радикалов хлора) при соединении с метаном (источники поступления метана в атмосферу: антропогенный – рисовые поля, а также результат таяния гидрата метана в вечной мерзлоте вследствие потепления климата) образует хлороводород, хорошо растворяющийся в воде с образованием аэрозолей соляной кислоты: Сl – + СН4 ® CН – 3 + НСl, СН – 3 + Сl2 ® CН3Cl + Сl –. Очень опасны выбросы фтороводорода (производство алюминия, стекольное), который хорошо растворяется в воде, что приводит к появлению в атмосфере аэрозолей плавиковой кислоты. Выпадение кислотных дождей Впервые кислотные дожди были отмечены в Западной Европе, в частности Скандинавии, и Северной Америке в 1950-х гг. Сейчас эта проблема существует во всем индустриальном мире и приобрела особое значение в связи с возросшими техногенными выбросами оксидов серы и азота. За несколько десятилетий размах этого бедствия стал настолько широк, а отрицательные последствия столь велики, что в 1982 г. в Стокгольме состоялась специальная международная конференция по кислотным дождям, в которой приняли участие представители 20 стран и ряда международных организаций. До сих пор острота этой проблемы сохраняется, она постоянно в центре внимания национальных правительств и международных природоохранных организаций. В среднем кислотность осадков, выпадающих в основном в виде дождей в Западной Европе и Северной Америке на площади почти 10 млн км2, составляет 5–4,5, а туманы здесь нередко имеют рН, равный 3-2,5. В последние годы кислотные дожди стали наблюдаться в промышленных районах Азии, Латинской Америки и Африки. Например, в Восточном Трансваале (ЮАР), где вырабатывается 4/5 электроэнергии страны, на 1 км2 выпадает около 60 т серы в год в виде кислотных осадков. В тропических районах, где промышленность практически неразвита, кислотные осадки вызваны поступлением в атмосферу оксидов азота за счет сжигания биомассы.
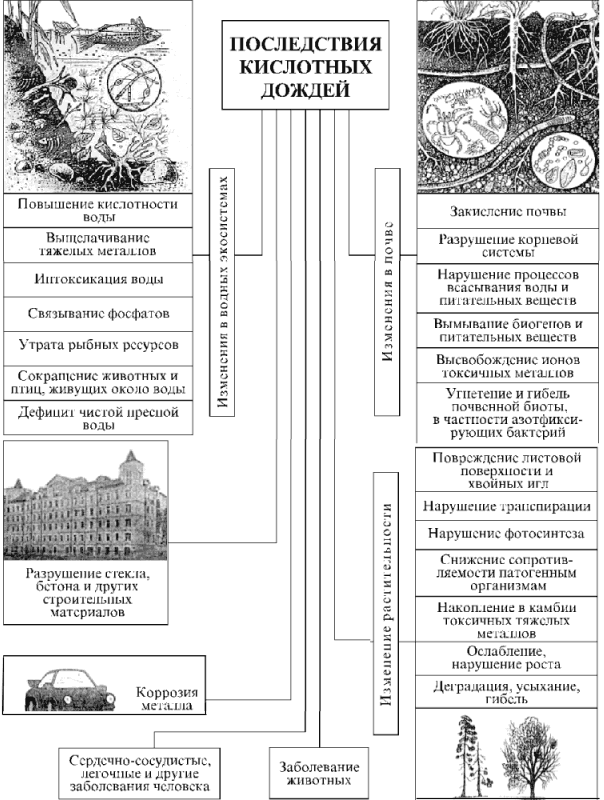
В России наиболее высокие уровни выпадений окисленной серы и оксидов азота (до 750 кг/км2 в год) на значительных по площади ареалах (несколько тыс. км2) наблюдаются в густонаселенных и промышленных регионах страны – в Северо-Западном, Центральном, Центрально-Черноземном, Уральском и других районах; на локальных ареалах (площадью до 1 тыс. км2) – в ближнем следе металлургических предприятий, крупных ГРЭС, а также больших городов и промышленных центров (Москва, Санкт-Петербург, Омск, Норильск, Красноярск, Иркутск и др.), насыщенных энергетическими установками и автотранспортом. Превышение уровня критических нагрузок по выпадению окисленной серы отмечается в ряде областей (Ленинградская, Московская, Рязанская), на европейской территории России и по выпадениям оксидов азота – на половине этой территории. За последние пять лет, согласно результатам измерений Росгидромета, наблюдается неизменное повышение кислотности дождей (минимальные значения рН = 3,1–3,4) на Урале и в Предуралье, на северо-западе и юге европейской территории России. Специфическая особенность кислотных дождей – их трансграничный характер, обусловленный переносом кислотообразующих выбросов воздушными течениями на большие расстояния – сотни и даже тысячи километров. Этому в немалой степени способствует принятая некогда «политика высоких труб» как эффективное средство против загрязнения приземного воздуха. Почти все страны одновременно являются «экспортерами» своих и «импортерами» чужих выбросов. Наибольший вклад в трансграничное подкисление природной среды России соединениями серы вносят Украина, Польша, Германия. В свою очередь, из России больше всего окисленной серы направляется в страны Скандинавии. Соотношения здесь такие: с Украиной – 1:17, с Польшей – 1:32, с Норвегией – 7:1. Экспортируется «мокрая» часть выбросов (аэрозоли), сухая часть загрязнений выпадает в непосредственной близости от источника выброса или на незначительном удалении от него. Обмен кислотообразующими и другими загрязняющими атмосферу выбросами характерен для всех стран Западной Европы и Северной Америки. Великобритания, Германия, Франция больше направляют окисленной серы к соседям, чем получают от них. Норвегия, Швеция, Финляндия больше получают окисленной серы от своих соседей, чем выпускают через собственные границы (до 70% кислотных дождей в этих странах – результат «экспорта» из Великобритании и Германии). Трансграничный перенос кислотных осадков – одна из причин конфликтных взаимоотношений США и Канады. Кислотные дожди оказывают многоплановое влияние на окружающую среду (рис. 9).
Рис. 9 – Воздействия кислотных дождей на окружающую среду
В первую очередь отрицательному воздействию подвергаются водные экосистемы, почва и растительность. Природные поверхностные воды обладают буферными способностями по отношению к посторонним водородным и гидроксильным ионам, т. е. способностью поддерживать постоянную величину рН вблизи нейтральной точки; за пределами интервала значений рН = 4-13 буферная способность полностью утрачивается. Главным буферным соединением в воде является гидрокарбонат-ион HCO3–, образующийся при диссоциации угольной кислоты и способный нейтрализовать кислоты и основания:
НСО3– + Н+ НСО3– + ОН–
Таким образом, гидрокарбонат-ион принимает на себя более или менее значительную часть добавляемых водородных или гидроксильных ионов, благодаря чему рН раствора меняется незначительно. Особенно высокими буферными способностями обладает морская вода, рН которой составляет в общем от 7 до 8,5, что соответствует слабощелочной реакции. Снеговые воды, а также большинство пресных водоемов, особенно в северных областях земного шара, обладают слабыми буферными свойствами и имеют кислую реакцию: 7 > рН > 4. Самый богатый животный мир присущ водам, рН которых лежит в нейтральной или слабощелочной области. Он во много раз богаче, чем животный мир кислых или щелочных вод. Водоемы с очень кислыми водами необитаемы, жизни в них нет, как нет жизни и в водоемах со значениями рН больше 11. Первыми жертвами кислотных дождей стали озера и реки. Сотни озер в Скандинавии, на северо-востоке США и на юго-востоке Канады, в Шотландии превратились в кислотные водоемы. Кислотные дожди привели к резкому снижению продуктивности 2500 озер Швеции. В Норвегии примерно половина поверхностных вод имеет повышенную кислотность, из 5000 озер в 1750 исчезла рыба. В провинции Онтарио (Канада) пострадало 20% озер, а в провинции Квебек – до 60% озер. При повышении кислотности воды (еще до критического порога выживания водной биоты, например для моллюсков таким порогом является рН = 6, для окуней – рН = 4,5) в ней быстро нарастает содержание алюминия за счет взаимодействия гидроксида алюминия придонных пород с кислотой: Аl(ОН)3 + 3H+ ® Al3+ + 3Н2О.
Даже небольшая концентрация ионов алюминия (0,2 мг/л) смертельна для рыб. В то же время фосфаты, обеспечивающие развитие фитопланктона и другой водной растительности, соединяясь с алюминием, становятся малодоступными этим организмам. Повышение кислотности приводит к появлению в воде высокотоксичных ионов тяжелых металлов – кадмия, свинца и других, которые прежде входили в состав нерастворимых в воде соединений и не представляли угрозы живым организмам. Дефицит питательных веществ и интоксикация воды приводят к своеобразной «стерилизации» водоемов. Закисленная и токсичная вода разрушает скелеты рыб и раковины моллюсков, а главное – снижает репродуктивные процессы. В свою очередь, это приводит к сокращению популяций наземных животных и птиц, связанных с водной биотой трофическими цепями (цепи питания). «Мертвая вода» усиливает дефицит пресной воды, обусловленный возрастающими масштабами хозяйственного и бытового использования и ее загрязнением. Что касается состояния рек и озер России, то качество воды большинства водных объектов в течение всех последних лет наблюдений и контроля со стороны Госкомэкологии не отвечает нормативным требованиям из-за сильного загрязнения промышленными сточными водами. Все основные реки России и их крупные притоки оцениваются как «загрязненные» или «сильно загрязненные». При таком положении кислотные осадки мало изменяют качественные характеристики воды. Почвенные о
|
|||||||||
|
Последнее изменение этой страницы: 2021-05-27; просмотров: 465; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.227.46.202 (0.022 с.) |

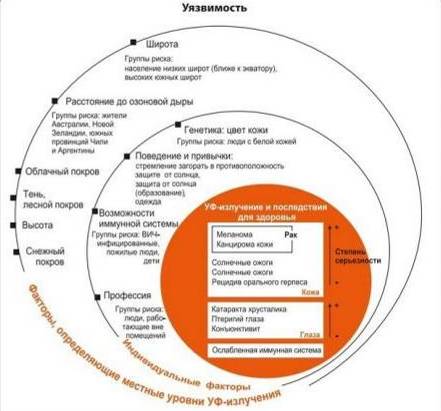 Рис. 7 – Опасность озоновых дыр. Уязвимость человека для солнечного ультрафиолета
Рис. 7 – Опасность озоновых дыр. Уязвимость человека для солнечного ультрафиолета Н2СО3.
Н2СО3.