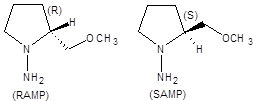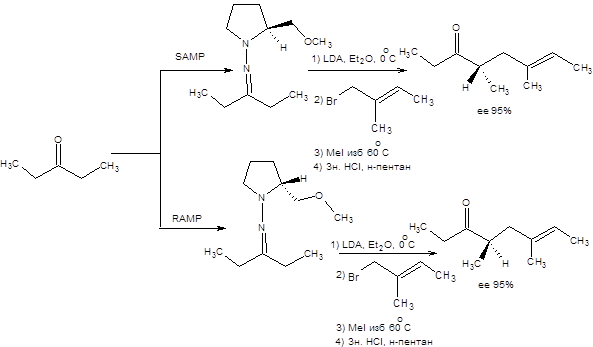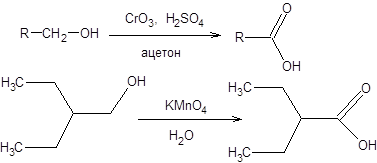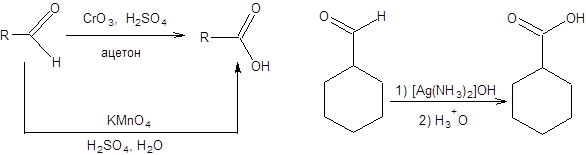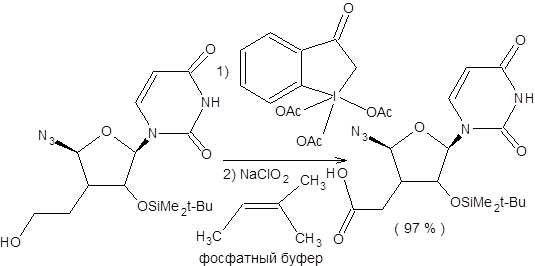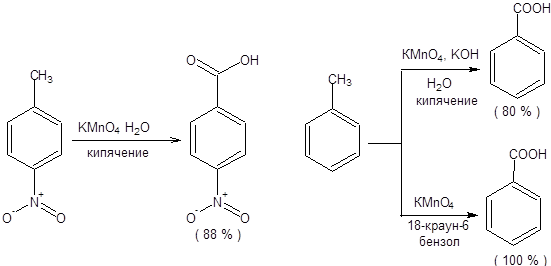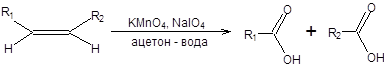Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Хиральные гидразины в асимметрическом алкилировании кетоновСодержание книги
Поиск на нашем сайте Громадные синтетические возможности, предоставляемые сборкой углерод-углеродной связи по схеме алкилирования кетонов, в настоящее время широко используются в синтезе природных соединений. Алкилирование кетонов в общем случае приводит к созданию нового асимметрического центра, поэтому очевидна ценность метода, позволяющего проводить это превращение стереоконтролируемо. Асимметрическое алкилирование кетонов удалось осуществить с высокой энантиоселективностью с использованием хиральных гидразинов, например (R)-1-амино-2-метоксиметилпирролидина, известного под аббревиатурой RАМР и его энантиомера SАМР (схема 8.19).
Схема 8.19
Для проведения асимметрического алкилирования кетон предварительно превращают в соответствующий хиральный гидразон, далее следует депртонирование гидразона под действием LDА и последующее алкилирование эквивалента енолят-аниона. Метод используется для асимметрического алкилирования как кетонов, так и альдегидов. В качестве алкилирующих агентов применяют алкилгалогениды. Удаление хирального вспомогательного фрагмента осуществляется путем предварительной кватернизации метилйодидом с последующим кислотным гидролизом в двухфазной системе образующейся соли (схема 8.20). Например, с использованием хиральных гидразинов удалось осуществить синтез двух энантиомеров (Е)-4,6-диметил-6-октен-3-она, который является защитным веществом долгоножек Leiobunumvittatum и L. Calcar (схема 8.20).
Схема 8.20
Алкилирование карбонильных соединений с использованием хиральных гидразинов допускает широкие вариации строения как карбонильного соединения, так и алкилирующего агента. Так, ациклические кетоны и альдегиды аликилируются галогенопроизводными с энантиоселективностью более 90 %, а циклические кетоны с размером цикла от пяти до восьми атомов углерода с энантиоселективностью от 60 до 90 %. Алкилирование эпоксидами приводит к продуктам меньшей оптической чистоты, около 30 %.
Список литературы
1. Michael A. // J. Prakt. Chem. 1887. V. 35. P. 349. 2. Bergmann E. D., Ginsburg D., Pappo R. // Org. React. 1959. V. 10. P. 179. 3. Hughes D. L. // Org. Prep. Proc. Int. 1996. V. 28. P. 127. 4. Ostrowski P. C., Kane V. V. // Tetrahedron Lett. 1977. P. 3549. 5. Horiguchi Y., Nakamura E., Kuwajima I. // J. Org. Chem. 1986. V. 51. P. 4323. 6. Clark R. D., Heathcook C. H. // Tetrahedron Lett. 1974. P. 1713. 7. NoyoriR., SuzukiM. // Angew. Chem. Int. Ed. 1984. V. 23. P. 847. 8. Johnson C. R., Penning T. D. // J. Am. Chem. Soc. 1988. V.110. P. 4726. 9. Feringa B. R. // Acc. Chem. Res. 2000. V. 33. P. 346. 10. Нодзаки Х. Современные направления в органическом синтезе. М.: Мир, 1986. С. 251 - 255. 11. Posner G. H., Mallamo J. P., Hulce M., Frye L. L. // J. Am. Chem. Soc. 1982. V. 104. P. 4180. 12. Stork G., Terrell R., Szmuszkovicz J. // J. Am. Chem. Soc. 1954. V. 76. P. 2029.
Лекция 9. Получение карбоновых кислот Окисление первичных спиртов Первичные спирты легко окисляются в соответствующие карбоновые кислоты под действием таких сильных окислителей, как перманганат калия, бихромат калия или реактив Джонса, последний, как правило, обеспечивает большие выходы продуктов в более мягких условиях (схема 9.1).
Схема 9.1
Окисление альдегидов
Для окисления альдегидов до карбоновых кислот используются те же реагенты, что и для окисления спиртов до карбоновых кислот, а также реагент Толленса, который получают растворением оксида серебра в водном аммиачном растворе (схема 9.2).
Схема 9.2 Эффективным окислителем является хлорит натрия в присутствии 2-метилбутена-2, который связывает образующийся гипохлорит натрия. Использование хлорита натрия в качестве окислителя позволяет селективно трансформировать альдегиды в карбоновые кислоты в присутствии многих других функциональных групп. Также заслуживает внимания последовательность стадий окисления спиртов по Десс – Мартину и последующего окисления образующихся альдегидов с использованием хлорита натрия как метод мягкого окисления спиртов до карбоновых кислот, допускающий присутствие многих функциональных групп (схема 9.3).
Схема 9.3
Окисление алкилбензолов
Окисление алкилбензолов представляет один из общих методов синтеза ароматических карбоновых кислот. Первичные и вторичные группы, присоединенные к бензойному кольцу, легко окисляются до карбоновых кислот. В качестве окислителей используют кислые или нейтральные водные растворы перманганата калия и бихромата калия. Выходы карбоновых кислот изменяются в широких пределах. Большинство ароматических соединений не растворимы в воде, и окисление происходит в гетерофазе, что снижает выход карбоновых кислот. Для устранения этого затруднения в систему вводят 18-краун-6, эффективно сольватирующий ион калия, а в качестве растворителя используют бензол (схема 9.4). В присутствии 18-краун-6 растворимость перманганата калия в бензоле составляет 0.06 М, а раствор получил называние «пурпурный бензол».
Схема 9.4 Окисление алкенов
Окисление алкенов открывает путь к синтезу карбоновых кислот, причем в качестве окислителей возможно использование широкого спектра окислителей. Наиболее удобна методика окисления алкенов смесью перманганата калия и перйодата натрия. В этом случае можно ограничиться каталитическими количествами перманганата калия, так как перйодат натрия будет окислять образующийся пиролюзит до пермангоната калия (схема 9.5).
Схема 9.5
|
||
|
Последнее изменение этой страницы: 2021-05-27; просмотров: 154; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.214 (0.009 с.) |