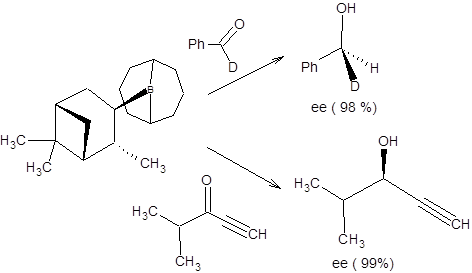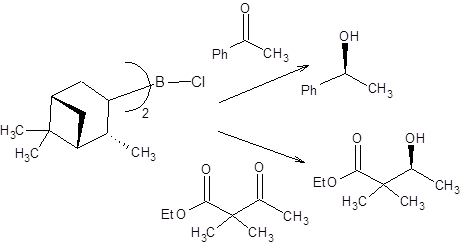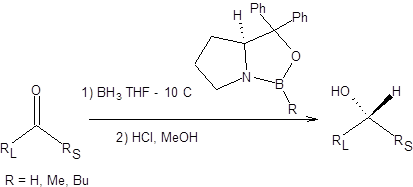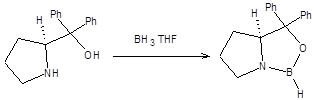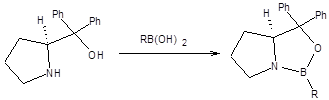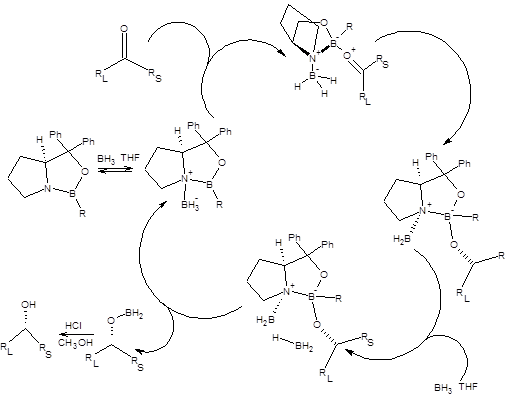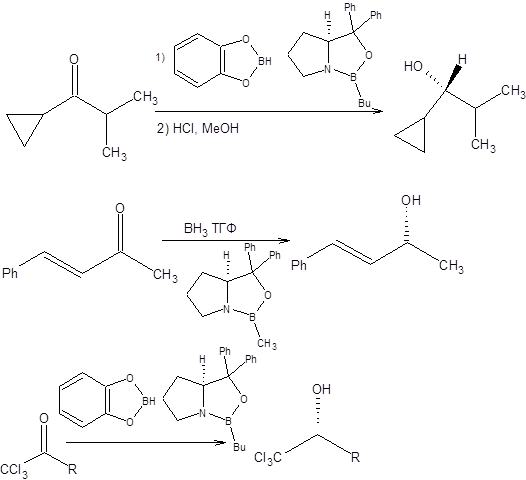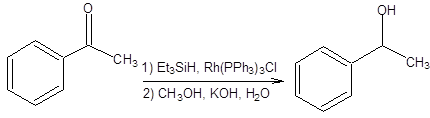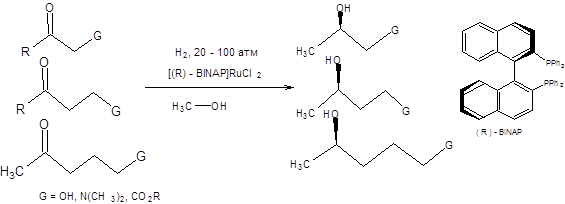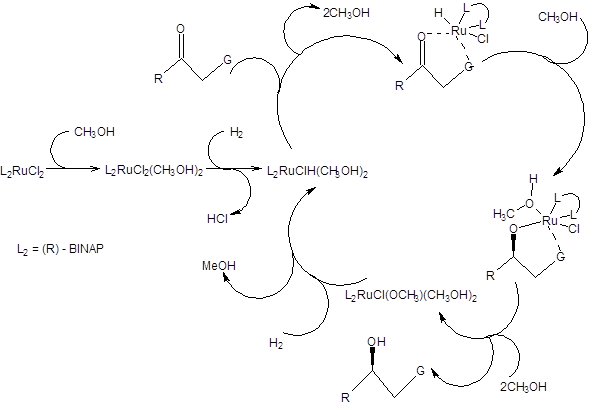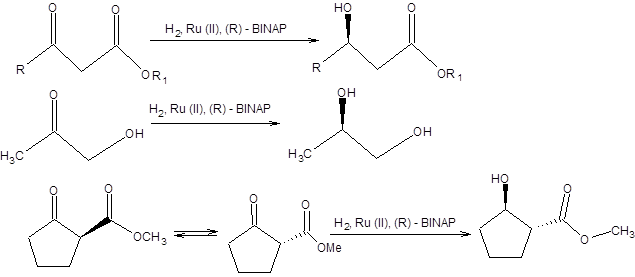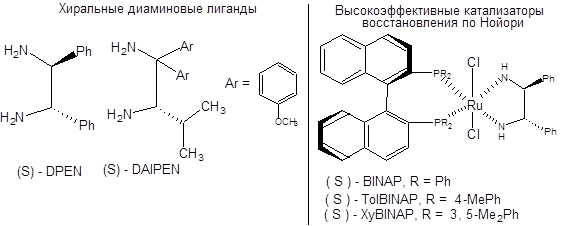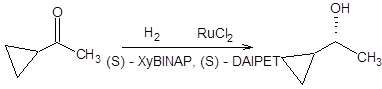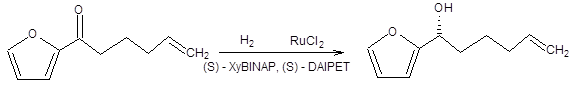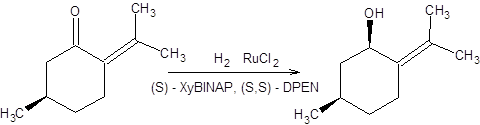Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Асимметрическое присоединение эквивалентов карбанионов и гидрид-иона к карбонильным соединениямСодержание книги
Поиск на нашем сайте
Асимметрическое присоединение эквивалентов карбанионов по карбонильной группе открывает путь к синтезу хиральных спиртов высокой энантиомерной чистоты. Особое значение для асимметрического синтеза спиртов приобрели методы, основанные на использовании конформационно жестких комплексов литийалкилов. Высокой энантиоселективности реакции Гриньяра можно добиться при использовании производного пролина, обработанного двумя моль бутиллития, в качестве конформационно жесткого эквивалента алкильного карбаниона, как показано на схеме 4.8 [5].
Схема 4.8
Высокая энантиоселективность рассмотренной реакции связана с невыгодностью одной из двух возможных ориентаций карбонильного соединения относительно комплекса, а именно той, где наибольшая по объему группа у карбонильного атома углерода находится в непосредственной близости от метильной группы конформационно жесткого комплекса (схема 4.8). Другой пример применения конформационно жестких комплексов в асимметрическом синтезе спиртов связан с использованием производных 2,2’- дигидрокси-1,1’-динафтила (схема 4.9) [5].
Схема 4.9
Альтернативный подход к синтезу спиртов связан с восстановлением карбонильной функции. Восстановление карбонильных соединений может быть осуществлено действием самых разнообразных реагентов. Особого внимания заслуживает восстановление карбонильной функции комплексными гидридами, среди которых наибольшее распространение получили гидриды бора и алюминия. Боргидрид натрия находит широкое применение для восстановления карбонильной группы альдегидов, кетонов и галогенангидридов в присутствии сложноэфирной, амидной, нитрильной и нитрогрупп, а также двойной углерод-углеродной связи. Боргидрид натрия нашел применение для селективного восстановления несопряженной карбонильной группы в присутствии сопряженного енонового фрагмента, как показано на схеме 4.10.
Схема 4.10
Другой широко используемый комплексный гидрид – триацетатборгидрид натрия – получают обработкой боргидрида натрия тремя эквивалентами уксусной кислоты. Триацетатборгидрид натрия нашел применение для восстановления альдегидной группы в присутствии кетогруппы (схема 4.11).
Схема 4.11
Литийалюминийгидрид отличается значительно большей восстановительной активностью, чем боргидрид натрия, восстанавливая все известные функциональные группы, кроме двойной углерод – углеродной связи. Большая активность обеспечивает универсальность литийалюминийгидрида как восстановителя, вместе с тем обуславливая его низкую селективность. Литийалюминийгидрид может быть превращен в ряд селективных реагентов, путем его модификации реагентами кислотной природы. Например, обработка литийалюминийгидрида тремя эквивалентами трет-бутилового спирта позволяет получить другой ценный комплексный гидрид – трис-(трет-бутокси)алюмогидрид лития. Трис-(трет-бутокси)алюмогидрид лития селективно восстанавливает карбонильную группу сопряженной еноновой системы, не затрагивая двойной углерод – углеродной связи, а также позволяет восстановить альдегидную группу в присутствии кетогруппы (схема 4.12).
Схема 4.12
Для селективного восстановления карбонильной группы сопряженной еноновой системы также нашел применение метод Луше – восстановления боргидридом натрия в присутствии трихлорида церия (схема 4.13) [6].
Схема 4.13
Методы гидридного восстановления карбонильной группы широко применяются для синтеза хиральных спиртов. Один из распространенных подходов к энантиоселективному синтезу спиртов основан на применении хиральных комплексных гидридов. Наибольшее значение в синтетической практике получили хиральные гидриды (R)-BINAL-H и (S)-BINAL-H, образующиеся при последовательной обработке алюмогидрида лития одним эквивалентом 2,2’- дигидрокси-1,1’-динафтилом и алифатическим спиртом, согласно схеме, приведенной ниже [5]:
Реагент (R)-BINAL-H применяется для асимметрического восстановления алкенилкетонов, алкинилкетонов и арилкетонов. Следует подчеркнуть, что как (R) –BINAL-H, так и (S)-BINAL-H являются коммерчески доступными реагентами. Конфигурацию образующегося продукта можно предсказать на основании следующего правила: при восстановлении кетонов под действием (R)- BINAL - H образуется (R)-спирт, а при восстановлении под действием (S)- BINAL - H, образуется (S)-спирт (схема 4.15).
Схема 4.15
Гидридное восстановление также с успехом применяется в диастереоселективных синтезах спиртов. Диастереоселективный синтез спиртов возможен, когда исходное карбонильное соединение уже содержит один или более асимметрических центров. Если асимметрический центр в исходном карбонильном соединении находится при a- углеродном атоме, то справедливо правило Крама. В соответствии с правилом Крама карбонильное соединение имеет наиболее устойчивую конформацию, в которой наибольший заместитель при a-углеродном атоме расположен как можно дальше от карбонильной группы, т.е. находится в заслоненном положении с заместителем при карбонильной группе. Нуклеофильная атака осуществляется между малым и большим заместителями, т.е. с наименее затрудненной пространственно стороны (схема 4.16) [7,8].
Схема 4.16
Правило Крама основано на широкой экспериментальной базе, но вместе с тем теоретически недостаточно обоснованно, так: 1) неправомерно отождествлять конформации исходных соединений и переходных состояний; 2) представления Крама о геометрии наиболее устойчивой конформации кетонов, оказались ошибочными; 3) правило Крама противоречит принципу Кертина – Гаммета, так как энергия активации химического превращения в данном случае превышает энергию активации взаимопревращения конформаций и направление реакции не может контролироваться конформационным равновесием. Таким образом, рассмотрение одной конформации для предсказания стереохимического направления реакции неправомерно. Несмотря на ряд неточностей теоретического характера, присущих правилу Крама, оно удовлетворительно предсказывает конфигурацию образующихся продуктов. Более строгий подход к предсказанию конфигурации образующихся продуктов основан на применении правила Фелкина – Она. Правило Фелкина – Она рассматривает переходное состояние, а не исходное состояние реагентов и опирается на более адекватную модель устойчивой конформации исходного карбонильного соединения. Наиболее устойчивой конформацией карбонильного соединения является та, в которой наибольший заместитель при a-углеродном атоме будет перпендикулярен карбонильной группе. Далее предполагается, что нуклеофильная атака осуществляется не под прямым углом, а под углом 109,50 (траектория Бюрги – Дуница). Если бы нуклеофильная атака осуществлялась бы под прямым углом, то диастереомерного избытка в реакции не наблюдалось, так как два рассматриваемых переходных состояния были бы тождественны. Правила Крама и Фелкина – Она применимы не только при предсказании конфигурации продуктов гидридного восстановления хиральных карбонильных соединений, но они не теряют своей предсказательной способности и при рассмотрении любой реакции, связанной с дифференциацией двух возможных направлений подхода нуклеофила к карбонильной группе. В первую очередь это относится к реакциям карбонильных соединений с эквивалентами карбанионов. Применение правила Фелкина – Она для предсказания конфигурации продуктов присоединения к карбонильной группе представлено на схеме 4.17 [8,9].
Схема 4.17
Преимущественное образование одного диастереомера объясняется различной устойчивостью двух альтернативных переходных состояний. Очевидно, что переходное состояние (1) (Схема 4.17) менее пространственно затруднено, так что продукта, отвечающего ему, будет образовываться больше. Величина диастереомерного избытка, достигаемого в реакции, определяется разницей энергий альтернативных переходных состояний. Чем больше разница в объеме малого и среднего заместителей, тем больше будет диастереомерный избыток и напротив, если малый и средний заместители близки по объему, то следует ожидать малого диастереомерного избытка. Результаты применения правила Крама находятся в согласии с результатами, получаемыми исходя из правила Фелкина – Она, однако применение последнего предпочтительно. Правило Фелкина – Она с успехом используется для предсказания конфигурации продуктов присоединения реактивов Гриньяра в присутствии трихлорида церия к α-галогензамещенным кетонам. При использовании правила Фелкина – Она в данном случае необходимо предположить перпендикулярность связей С=О и C–Hal в наиболее устойчивой конформации (схема 4.18) [8].
Схема 4.18 Примечательно, что в данном случае основной продукт реакции образуется с высоким диастереомерным избытком, что позволило разработать метод стереоконтролируемого синтеза тризамещенных эпоксидов (схема 4.19).
Схема 4.19
В синтетической практике часто используется присоединение эквивалентов карбанионов к α-замещенным карбонильным соединениям. В качестве заместителей, как правило, выступают гидрокси-, алкокси- и диалкиламиногруппы, в этом случае конфигурация продуктов реакции определяется эффектом хелатирования. Для предсказания конфигурации продуктов таких превращений используется модель хелатирования Крама, которая находится в хорошем согласии с экспериментом, а также внутренне непротиворечива. Согласно модели хелатирования Крама реакция протекает через циклическое переходное состояние, в котором две возможных стороны подхода эквивалента карбаниона к тригональному атому углерода дифференцированы заместителями при хиральном α-углеродном атоме. Подход реагента осуществляется с наименее затрудненной пространственно стороны, т.е. со стороны менее объемного заместителя при хиральном центре. Например, бензилоксизамещенные кетоны с высокой диастереоселективностью образуют продукты присоединения согласно модели хелатирования Крама (схема 4.20) [7,8].
Схема 4.20
В настоящее время в асимметрическом синтезе спиртов широкое распространение нашли хиральные бораны, причем как стехиометрические реагенты, так и катализаторы. Среди боранов, применяемых в асимметрическом синтезе в качестве стехиометрических реагентов, особую популярность завоевали альпин-боран и диизопинокамфеилхлорборан (DIP-хлорид), получаемые гидроборированием α-пинена (схема 4.21) [10].
Схема 4.21
Реакции альпин-борана и DIP-хлорида с карбонильными соединениями протекают через шестичленное циклическое переходное состояние, которое способствует высокой степени стереоконтроля. Механизм асимметрического восстановления кетонов хиральными боранами приведен на схеме 4.22.
Энантиоселектривность данной реакции определяется разными пространственными требованиями, предъявляемыми метильной группой и атомом водорода α-пинена. Очевидно, что из двух возможных ориентаций карбонильного соединения относительно остатка α-пинена в переходном состоянии, выгодна та, в которой метильная группа сближена с малым заместителем при карбонильной группе. Альпин-боран применим для восстановления пространственно незатрудненных кетонов, таких как α,β-ацетиленкетонов и 1-дейтероальдегидов (схема 4.23).
Схема 4.23
Для асимметрического восстановления подавляющего большинства кетонов альпин-боран неэффективен, так как дает продукты восстановления малой оптической чистоты, что обусловлено собственной диссоциацией альпин-борана в условиях реакций с его участием [10,11]. В противоположность альпин-борану, DIP-хлорид применим для восстановления пространственно затрудненных субстратов, содержащих два заместителя у α-углеродного атома, а также для восстановления ароматических кетонов (схема 4.24).
Схема 4.24
За последние двадцать лет в синтетическую практику вошла реакция Кори – Бакши – Шибата, заключающаяся в асимметрическом восстановлении карбонильных соединений бораном в присутствии хиральных оксазаборолидинов в качестве катализаторов. Реакция Кори – Бакши – Шибата позволяет получать спирты высокой энантиомерной чистоты [10 – 14]. Общая схема реакции Кори – Бакши – Шибата приведена ниже:
Схема 4.25
Хиральные оксазаборолидины получают действием комплекса борана с ТГФ на хиральные аминоспирты на основе пролина (схема 4.26).
Схема 4.26 Механизм реакции Кори – Бакши – Шибата приведен на схеме 4.27:
Схема 4.27
Энантиоселективность реакции Кори – Бакши – Шибатасвязана с дифференциацией энантиотопных поверхностей карбонильного соединения, за счет неравенства энергий пространственного взаимодействия R1 и R2 радикалов с радикалом R хирального катализатора в предреакционном комплексе. Ввиду меньшего объема радикала R2 его пребывание в непосредственной близости от радикала R более выгодно, чем большего по объему R1 радикала, таким образомдостигается предпочтительная ориентация в предреакционнном комплексе, определяющая энантиоселективность процесса в целом (схема 4.27). Реакция Кори – Бакши – Шибата применима к широкому кругу субстратов, таких как арилалкилкетоны, циклоалканоны и α,β-непредельные кетоны. Наличие кратных углерод-углеродных связей в кетоне осложняет реакцию ввиду возможности их параллельного гидроборирования. Однако это затруднение легко устраняется использованием менее активного в качестве гидроборирующего агента пирокатехолборана. Примеры применения реакции Кори – Бакши – Шибата в синтезе хиральных спиртов приведены на схеме 4.28.
Схема 4.28 Несмотря на то, что методы гидридного восстановления карбонильной группы являются наиболее универсальными и селективными, также важное место занимают методы гомогенного гидрирования карбонильной группы. В присутствии металлокомплексных катализаторов карбонильная группа восстанавливается с трудом, однако в настоящее время разработаны условия, позволяющие проводить восстановление с высокой селективностью. Так возможно провести косвенное гидрирование карбонильной группы, гидросилилированием в присутствие катализатора Уилкинсона с последующим щелочным гидролизом (схема 4.29).
Схема 4.29 Широкое распространение получил метод асимметрического гидрирования карбонильной группы по Нойори. По методу Нойори асимметрическое гидрирование осуществляется под действием водорода на рутениевом катализаторе в присутствии хиральных фосфиновых лигандов. Среди хиральных фосфиновых лигандов наибольшую популярность завоевал BINAP (схема 4.30). Реакция Нойори требует наличия в субстрате функциональных групп способных координироваться с катализатором. Бесспорным достоинством реакции Нойори является необходимость использовать лишь очень малое количество катализатора для достижения высокой оптической чистоты продукта. Брутто-схема восстановления по Нойори приведена ниже [10,15, 16]:
Схема 4.30 Каталитический цикл асимметрического гидрирования по Нойори приведен на схеме 4.31.
Схема 4.31 Реакция Нойори широко используется в современном органическом синтезе хиральных соединений, некоторые примеры ее использования приведены на схеме 4.32.
Схема 4.32 Последняя реакция (схема 4.32) представляет особый интерес, так как исходный β-кетоэфир легко самопроизвольно рацемизуется ввиду его повышенной склонности к енолизации, т.е. между его энантиомерными формами существует равновесие. Так как (R)-изомер восстанавливается в условиях реакции гидрирования по Нойори значительно быстрее своего оптического антипода, то с высокой селективностью образуется один из четырех возможных продуктов. Реакция асимметрического гидрирования по Нойори ограничена восстановлением кетонов, содержащих группу, способную к хелатированию. Область применения реакции Нойори расширилась, благодаря вовлечению в синтетическую практику рутениевых катализаторов [10], содержащих помимо хиральных дифосфиновых лигандов хиральные диаминовые лиганды, такие как (S,S)-DPEN или (S)-DAIPEN (схема 4.33). Эти каталитические системы столь активны, что в ряде случаев достаточно миллионных долей катализатора на единицу количества вещества субстрата. Использование этих катализаторов позволяет вовлекать в реакцию асимметрического гидрирования по Нойори широкий круг кетонов, в том числе ароматические, гетероароматические и циклопропилкетоны (схема 4.33).
Схема 4.33
|
||||
|
Последнее изменение этой страницы: 2021-05-27; просмотров: 200; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.21.105.222 (0.013 с.) |

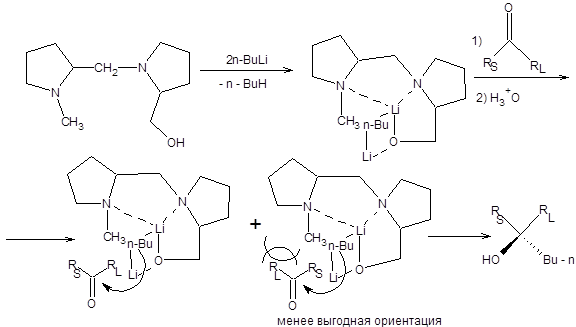
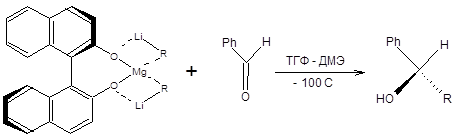
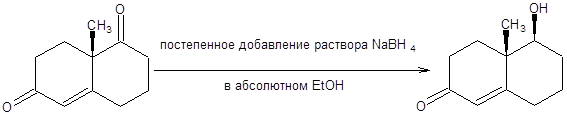
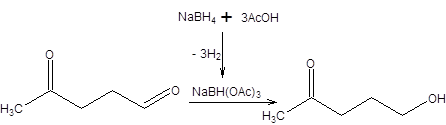
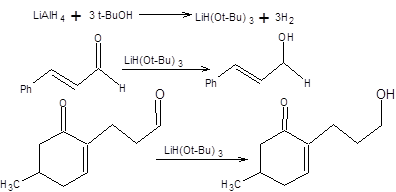
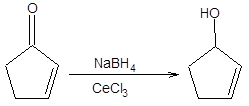
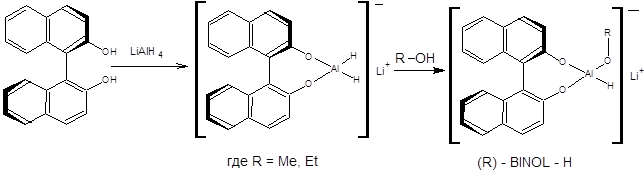 Схема 4.14
Схема 4.14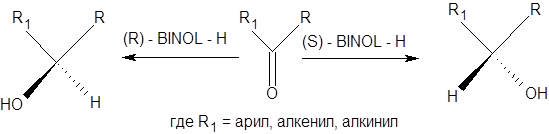
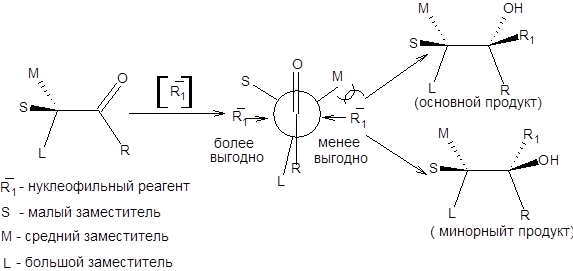
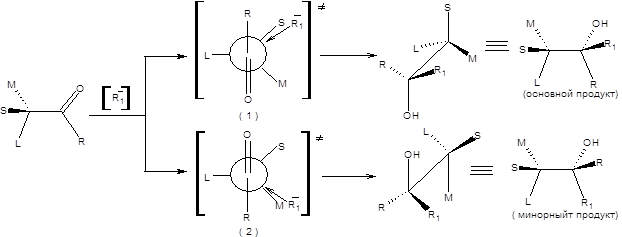
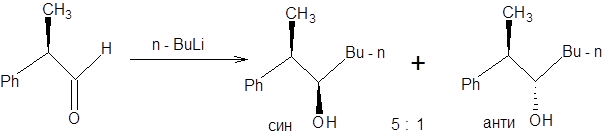
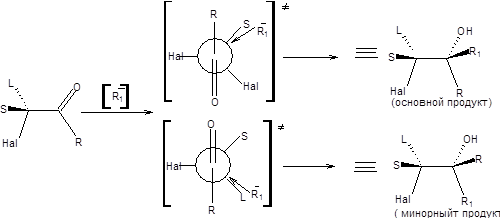
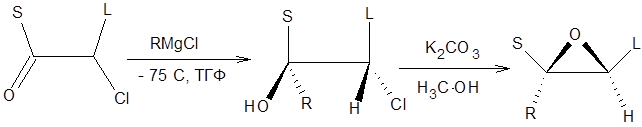
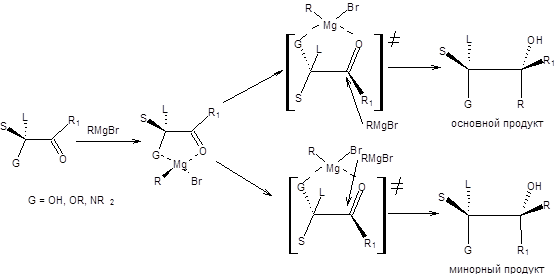
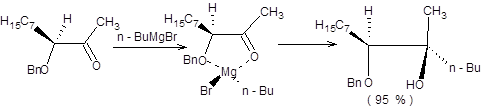
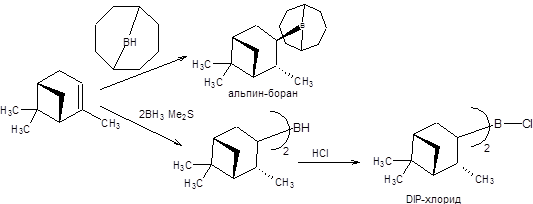
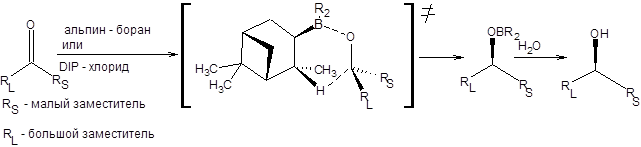 Схема 4.22
Схема 4.22