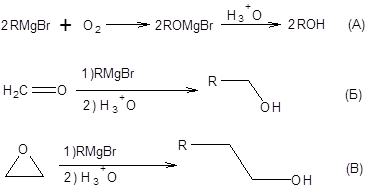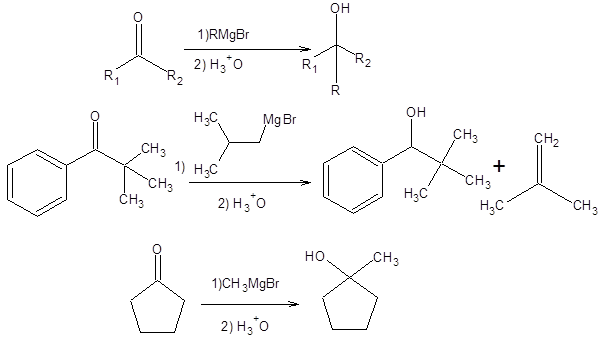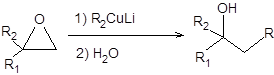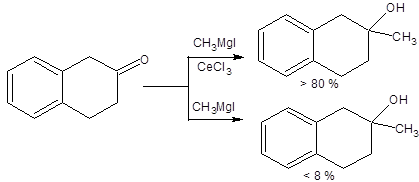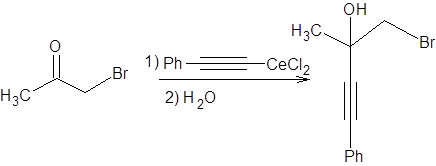Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Синтезы спиртов с участием эквивалентов карбанионовСодержание книги
Поиск на нашем сайте
Широкое применение литийорганических соединений, реактивов Гриньяра и диалкилкупратов в органическом синтезе связано в первую очередь с возможностью синтеза спиртов разнообразного строения [1,2]. Особый интерес в этом отношении представляют реакции реактивов Гриньяра и литийорганических соединений с альдегидами, кетонами и эпоксидами различного строения. Благодаря применению этих реакций могут быть получены первичные, вторичные и третичные спирты. Диалкилкупраты инертны по отношению к кетонам, но активны в реакциях с эпоксидами. А) Первичные спирты Первичные спирты с тем же количеством атомов углерода, что и в эквиваленте карбаниона получают воздействием молекулярного кислорода на реактивы Гриньяра с последующим гидролизом образующихся алкоголятов (схема 4.1 А). Первичные спирты с удлинением углеродной цепи на один атом углерода получают действием реактивов Гриньяра на формальдегид (схема 4.1Б). Также возможен синтез спиртов с удлинением углеродной цепи на два атома углерода, путем действия реактивов Гриньяра на эпоксиды (схема 4.1В).
Схема 4.1 Б) Вторичные спирты Вторичные спирты образуются при действии реактивов Гриньяра на альдегиды, отличные от формальдегида. Другой метод синтеза вторичных спиртов состоит во взаимодействии моноалкилоксиранов с эквивалентами карбанионов. В качестве эквивалентов карбанионов часто с успехом можно применять реактивы Гриньяра или литийорганические соединения. Синтез спиртов по реакции Гриньяра осложняется побочными процессами изомеризации эпоксидов в кетоны, а также образованием аллильных спиртов. Изомеризация эпоксидов в кетоны протекает ввиду высокой льюисовской кислотности катионов лития и магния, а образование аллильных спиртов протекает благодаря высокой основности литийорганических соединений. Эти побочные процессы могут быть сведены к минимуму применением диалкилкупратов в качестве эквивалентов карбанионов, которые наиболее эффективны в раскрытии эпоксидного цикла. Следует отдельно заметить, что эквиваленты карбанионов всегда атакуют эпоксидный цикл с наименее затрудненной пространственно стороны, что приводит к образованию наиболее разветвленного спирта. Такая региоселективность очевидно связана с теми пространственными требованиями, которые предъявляет переходное состояние SN2-типа. Примеры синтеза вторичных спиртов с использованием эквивалентов карбанионов приведены на схеме 4.2.
Схема 4.2
В) Третичные спирты Третичные спирты получают взаимодействием реактивов Гриньяра или литийорганических соединений с кетонами. Однако этот подход встречает определенные затруднения; если кетон или реактив Гриньяра содержат объемные группы, затрудняющие реакцию, тогда основным направлением может стать восстановление кетона по средствам гидридного переноса (схема 4.3).
Схема 4.3
Третичные спирты также получают взаимодействием 1,1-диалкилоксиранов с диалкилкупратами, согласно схеме, представленной ниже:
Схема 4.4
Несмотря на широкие синтетические возможности классической реакции Гриньяра, ее применение неэффективно, если: 1. Кетон проявляет повышенную кислотность и склонен к енолизации. Литийорганические и магнийорганические соединения являются сильными основаниями, поэтому при взаимодействии с карбонильными соединениями, обладающими повышенной С–Н-кислотностью, возможна параллельная енолизация субстрата, которая часто становится основным направлением реакции. Для понижения основности реактивов Гриньяра при сохранении нуклеофильности применяют церийорганическаие соединения, которые получают обработкой реактивов Гриняра одним эквивалентом хлоридом церия (III). Церийорганические реагенты эффективно взаимодействуют по схеме реакции Гриньяра даже с такими сильными С–Н-кислотами, как ацетоуксусный эфир, ввиду их очень низкой основности (схема 4.5) [3].
Схема 4.5
Использование реактивов Гриняра для синтеза третичных спиртов из тетралона приводит к продукту реакции с неприемлемо низким выходом, однако замена магнийорганического соединения на церийорганическое позволила осуществить это превращение с высоким выходом (схема 4.6).
Схема 4.6
2. Имеются пространственные затруднения в кетоне или реактиве Гриньяра. Пространственно затрудненные кетоны в классических условиях реакции Гриньяра дают неприемлемо низкие выходы третичных спиртов, однако использование цериевых производных позволяет решить эту проблему. Так метилмезетилкетон вступает в реакцию Гриньяра в классических условиях с низкими выходами соответствующих спиртов. Переход к церийорганическим соединениям позволяет провести данную реакцию с приемлемым выходом (схема 4.7 А) [4]. Часто использование вторичных магнийорганических соединений также приводит к неприемлемо низким выходам продуктов реакции Гриньяра, однако переход к церийорганическим соединениям позволяет проводить подобные реакции с высоким выходом требуемого спирта. Примеры применения реакции Гриньяра с участием пространственно затрудненных эквивалентов карбанионов приведены на схеме 4.7 Б.
Схема 4.7 3) В реакции участвуют α-галогенкетоны. α-Галогенкетоны в классической реакции Гриньяра также не дают удовлетворительных результатов, однако применение цериевых производных позволяет успешно проводить и эту реакцию (схема 4.8).
Схема 4.8 Применение цериевых производных позволило резко расширить область применения реакции Гриньяра так, что в нее с успехом могут быть вовлечены почти любые кетоны и эквиваленты карбанионов.
|
||||
|
Последнее изменение этой страницы: 2021-05-27; просмотров: 173; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.138.124.123 (0.006 с.) |