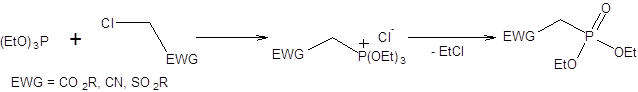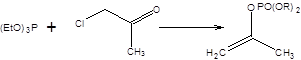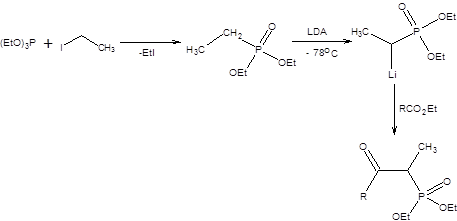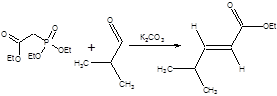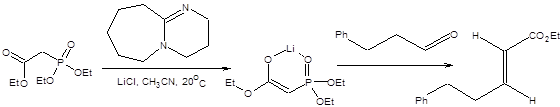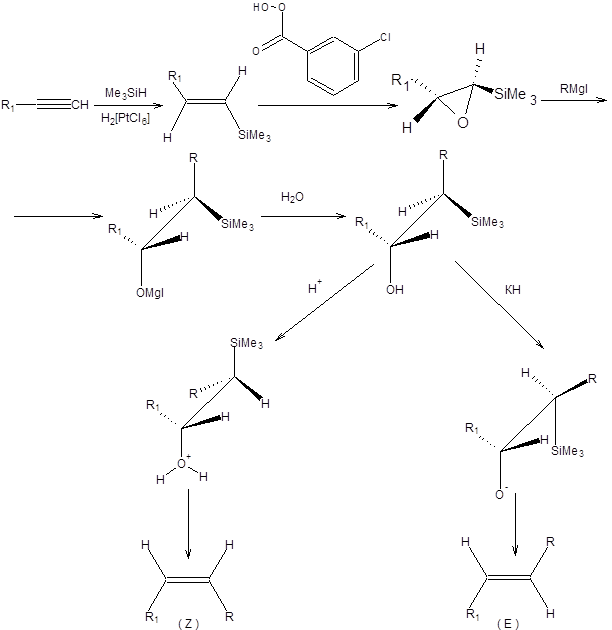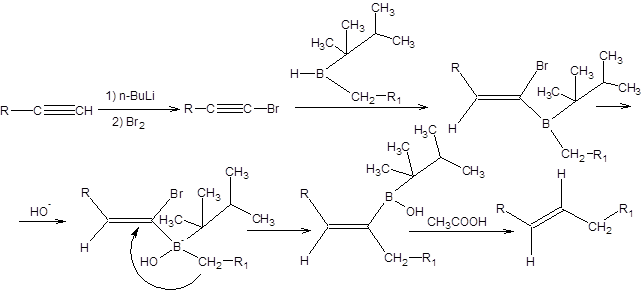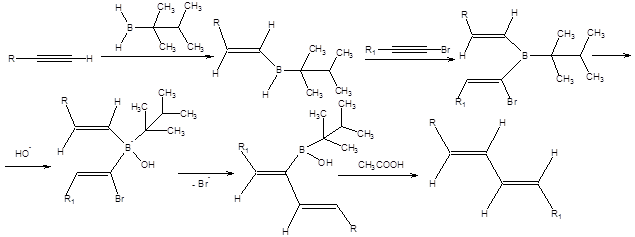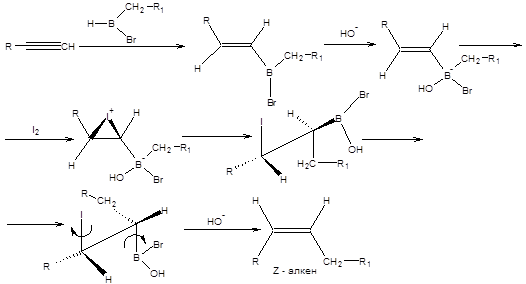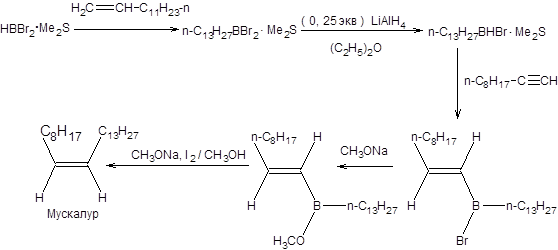Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Реакция Ведсворта – Хорнера – ЭммонсаСодержание книги
Поиск на нашем сайте Реакция Ведсворта – Хорнера – Эммонса представляет модификацию классической реакции Виттига и выгодно отличается заменой илидов фосфора как нуклеофилов фосфонатами в присутствии оснований. Фосфонаты, имеющие заместители, стабилизирующие отрицательный заряд, образуют при взаимодействии с альдегидами преимущественно (Е)-алкены. По мере уменьшения электроноакцепторных свойств заместителя в фосфонате доля (E)-продукта снижается. Селективность в отношении образования алкенов (Е)-конфигурации в условиях реакции Ведсворта – Хорнера – Эммонса превышает селективность, достигаемую в реакции Виттига с участием стабилизированных илидов. Реакция Ведсворта – Хорнера – Эммонса провидится конденсацией фосфонатов с карбонильными соединениями в присутствии оснований. Механизм реакции Ведсворта – Хорнера – Эммонса во многом аналогичен, механизму реакции Виттига с участием стабилизированных илидов и приведен на схеме 2.13 [2-4]:
Схема 2.13
Фосфинаты, содержащие акцепторные группы, получают по реакции Арбузова – Михаэля (схема 2.14):
Схема 2.14
Если α-галогенэфиры, α-галогеннитрилы и α-галогенсульфоны вступают в реакцию Арбузова – Михаэля с образованием фосфонатов с высоким выходом, то α-галогенкетоны в этих условиях вступают в реакцию Перкова (схема 2.15) и не дают приемлемых выходов фосфонатов.
Схема 2.15
Кетофосфонаты получают многостадийным синтезом исходя из триэтилфосфита, как показано на схеме 2.16.
Схема 2.16
Реакция Ведсворта – Хорнера – Эммонса выгодно отличается от реакции Виттига отсутствием необходимости в использовании сильных оснований, так как фосфонаты депротонируются уже под действием таких слабых оснований, как триэтиламин или поташ. Особенно мягкие условия проведения реакции Ведсворта – Хорнера – Эммонса достигаются при использовании пространственно затрудненных третичных аминов в качестве оснований в присутствии хлорида лития [5], причем в этих условиях наблюдается почти исключительная селективность реакции в отношении образования (Е)-изомера. Примеры использования реакции Ведсворта – Хорнера – Эммонса в отсутствии сильных оснований приведены на схеме 2.17.
Схема 2.17
Важной модификацией реакции Ведсворта – Хорнера – Эммонса, позволяющей синтезировать двойные связи (Z)-конфигурации, является реакция Стилла – Дженари, протекающая в условиях кинетического контроля под действием пространственно затрудненных сильных оснований, например (бис)-триметилсилиламида калия в присутствии краун – эфиров (схема 2.18). Альтернативный подход к осуществлению реакции Стилла – Дженари состоит в использовании трифторэтил - или о-толилфосфонатов в присутствии сильных пространственно незатрудненных оснований (схема 2.18) [6,7].
Схема 2.18
Реакция Петерсона Еще одна модификация реакции Виттига – реакция Петерсона – широко применяется в органическом синтезе для метеленирования карбонильных соединений, а также для получения алкенов заданной конфигурации. Реакция Петерсона заключается во взаимодействии карбонильных соединений с эквивалентами a-силилкарбаниона. Эквиваленты α-силилкарбаниона получают исходя из α-галогенсиланов, как показано на схеме 2.19.
Схема 2.19
Механизм реакции Петерсона включает нуклеофильную атаку карбаниона по карбонильному атому углерода с образованием b-силилалкоксида, дальнейшие превращения которого определяются кислотностью среды (схема 2.20) [8, 9].
Схема 2.20
В щелочной среде происходит син-элиминирование силанолят-аниона, тогда как в кислой среде напротив, наблюдается протонирование b-силилалкоксидов и дальнейшее анти-элиминирование силанола, через предварительное образование ониевого иона (схема 2.20). В общем случае в реакции Петерсона образуются неравные количества эритро- и трео-b-силиланолов. Для синтеза алкенов заданной конфигурации необходимо проводить разделение диастереомерных b-силиланолов, что зачастую удается осуществить. Альтернативный вариант проведения реакции Петерсона основан на получении b-силанолов в диастереомерно чистом виде из терминальных алкинов. Дальнейшая обработка силанолов кислотами или основаниями позволяет получать алкены заданной конфигурации (схема 2.21).
Схема 2.21 Последний вариант стереоконтролируемого проведения реакции Петерсона имеет существенное преимущество. Образование только одного диастереомера b-силанола позволяет избегать трудоемкой стадии разделения диастереомеров, необходимой в стереоконтролируемом синтезе алкенов по классической схеме реакции Петерсона (схема 2.20). Хотя синтез алкенов заданной конфигурации возможен в условиях реакции Петерсона, ее применение в этой области ограничено, особенно если учесть наличие других эффективных методов стереоконтролируемого синтеза алкенов, а именно реакций Виттига и Ведсворта – Хорнера – Эммонса. Вместе с тем реакция Петерсона представляет один из лучших методов метеленирования карбонильных соединений. Примеры метеленирования кетонов по реакции Петерсона представлены на схеме 2.22.
Схема 2.22 Синтез Негиши Синтез Негиши позволяет получать (E)-алкены и (E,E)-диены исходя из терминальных алкинов и заключается во взаимодействии 1-галогеналкинов с боранами, с последующей миграцией алкильной группы от атома бора к атому углерода. Миграция алкильной группы от атома бора к электрофильному атому углерода происходит под действием оснований, что определяет условия проведения реакции. На завершающей стадии производят деборирование алкенилборанов в кислой среде, приводящее к образованию (Е)-алкенов (схема 2.23).
Схема 2.23 Для проведения синтеза Негиши применяют диалкилбораны, один из радикалов которых пространственно затруднен и не способен к миграции. В качестве такого радикала часто используют тексильный-радикал. Для получения (E,E)-диенов по методу Негиши используют тексилборан, который последовательно присоединяет молекулы 1-галогеналкина и терминального алкина. Далее продукт присоединения подвергают обработке основаниями, а затем деборированию в среде органических кислот, как показано на схеме 2.24.
Схема 2.24
Синтез Цейфеля
Синтез Цейфеля применяется для получения (Z)-алкенов и (Z,E)-диенов из терминальных алкинов. Синтез алкенов по Цейфелю осуществляют в две стадии. На первой стадии проводят присоединение моноалкилгалогенборанов к алкинам. Далее продукт присоединения обрабатывают щелочным раствором йода, как показано на схеме 2.25 [10].
Схема 2.25 Эффективность синтеза (Z)-алкенов по Цейфелю показана на примере получения полового феромона домашних мух – мускалура (схема 2.26) [10].
Схема 2.26
Синтез (Z,E)-диенов по Цейфелю заключается в последовательном взаимодействии тексилборана с двумя молекулами алкина и дальнейшей обработке полученного продукта щелочным раствором йода, как показано на схеме 2.27.
Схема 2.27 Синтезы Негиши и Цейфеля являются примером реализации общего подхода – миграции алкильной группы от тетракоординационного атома бора к электрофильному углеродному центру с последующим элиминированием из подукта миграции (синтез Цейфеля) или его деборированием (синтез Негиши).
|
||
|
Последнее изменение этой страницы: 2021-05-27; просмотров: 274; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.214 (0.006 с.) |