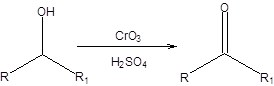Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Лекция 6. Классические методы синтеза карбонильных соединенийСодержание книги
Поиск на нашем сайте
Окисление спиртов
Окисление спиртов открывает удобный путь синтеза карбонильных соединений, а также позволяет свести проблему их получения к синтезу соответствующих спиртов. В настоящее время известно значительное количество систем, предназначенных для селективного окисления спиртов до карбонильных соединений. В случае окисления вторичных спиртов образуются кетоны, при этом возможно использовать достаточно жесткие условия ввиду того, что кетоны не склонны к дальнейшему окислению. Окисление первичных спиртов до альдегидов встречает некоторые трудности, связанные с тем, что альдегиды более склонны к окислению, чем спирты. Третичные спирты окисляются лишь при действии сернокислого раствора перманганата калия при длительном кипячении, причем окисление сопровождается деструкцией углеродного скелета. А. Окисление первичных спиртов Окисление первичных спиртов до альдегидов требует применения особых реагентов и условий во избежание их переокисления до карбоновых кислот.
[Ox] – окислитель, удовлетворяющий данной реакционной схеме. Схема 6.1
В качестве окислительной системы, удовлетворяющей схеме 6.1, широкое распространение нашел реагент Саретта – Коллинза, представляющий один эквивалент триоксида хрома, растворенного в двух эквивалентах пиридина [1,2]. Его выгодно отличающимся аналогом является реагент Кори [3], который образуется при обработке пиридина хромовым ангидридом в присутствии хлороводорода (схема 6.2).
Схема 6.2
Реагенты Кори и Саррета – Коллинза представляют эффективные окислительные системы, обеспечивающие высокие выходы альдегидов, хорошо растворимы в хлороформе и хлористом метилене, которые используются в качестве растворителей в этих реакциях. Реагент Кори обладает важным преимуществом перед реагентом Саррета – Коллинза, не затрагивая двойную углерод-углеродную связь при окислении гидроксильной группы непредельных спиртов. Некоторые примеры применения этих реагентов приведены на схеме 6.3.
Схема 6.3
Также для окисления спиртовой группы в присутствии кратных связей нашел применение диоксид марганца в петролейном эфире. Выход альдегида зависит от способа приготовления диоксида марганца. Наибольшей активностью обладает диоксид марганца, полученный окислением сульфата марганца перманганатом калия в щелочной среде. Однако самой высокой селективностью из всех известных реагентов обладает реагент Десс – Мартина [4], предназначенный для окисления первичной спиртовой группы в полифункциональных соединениях до альдегидной. Реагент Десс – Мартина получают окислением о-йодбензойной кислоты броматом калия в кислой среде с последующей обработкой продукта окисления уксусным ангидридом. Синтез реагента Десс – Мартина, общая схема и механизм окисления спиртов по Десс – Мартину приведены ниже:
Схема 6.4 Эффективный общий подход к окислению спиртов состоит в их взаимодействии с диметилсульфоксидом в присутствии электрофильных частиц. Путем вариации электрофильной частицы можно достигнуть оптимальной «настройки» метода по отношению к окисляемому спирту. Наибольшее значение из реагентов этой группы в синтетической практике имеют реагенты Сверна и Пфицнера – Моффата [5 – 7]. Реагент Сверна представляет комбинацию оксалилхлорида и ДМСО и позволяет получать альдегиды часто с количественным выходом. Реакция проводится при пониженных температурах в хлористом метилене. Реакция Сверна хорошо зарекомендовала себя в окислении сильно функционализированных спиртов и приведена на схеме 6.5.
Схема 6.5
Альтернативой реакции Сверна, приводящей к сопоставимым результатам, является реакция Пфитцнера – Моффата. В качестве электрофильной частицы в реакции Пфитцнера – Моффата используется дициклогексилкарбодиимид (DCC). Реакция Пфитцнера – Моффата катализируется кислотами. Механизм этой реакции аналогичен механизму реакции Сверна и представлен на схеме 6.6.
Схема 6.6
Окисление спиртов по принципиально той же схеме, что и в реакциях Сверна и Пфитцнера – Моффата, можно осуществить предварительным превращением спиртов в алкилтозилаты. Последовательная обработка алкилтозилатов при нагревании ДМСО и гидрокарбонатом натрия (реакция Корнблюма) приводит к образованию соответствующих карбонильных соединений с удовлетворительным выходом. Галогенопроизводные окисляются до альдегидов в тех же условиях, что и алкилтозилаты (схема 6.7).
Схема 6.7 Метод Корнблюма имеет два существенных недостатка по сравнению с реакциями Сверна и Пфитцнера – Моффата, первый из них состоит в необходимости применять повышенные температуры, что накладывает существенные ограничения на область применения реакции. Второй недостаток состоит в необходимости прибегать к лишней стадии, а именно, превращению спиртов в соответствующие тозилаты. Данных недостатков лишен метод Кори – Кима [8], принципиально сохраняющий первоначальный подход, использованный в реакции Корнблюма (схема 6.8).
Б. Окисление вторичных спиртов Для окисления вторичных спиртов до кетонов с успехом применяются те же методы, что и для окисления первичных спиртов, однако необходимость в их применении возникает редко ввиду относительной дороговизны соответствующих реагентов. Для окисления вторичных спиртов широкое распространение получил реагент Джонса, представляющий раствор триоксида хрома в серной кислоте [9]. Реагент Джонса окисляет первичные спирты до карбоновых кислот, а вторичные спирты до кетонов и широко используется в этих целях (схема 6.9).
Схема 6.9
|
||
|
Последнее изменение этой страницы: 2021-05-27; просмотров: 552; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.214 (0.007 с.) |

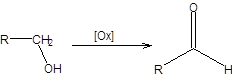
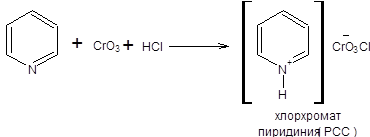
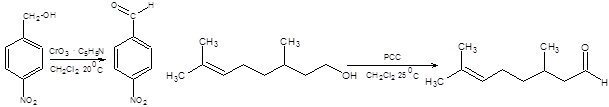
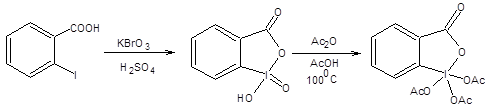
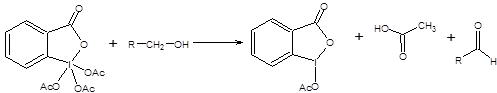
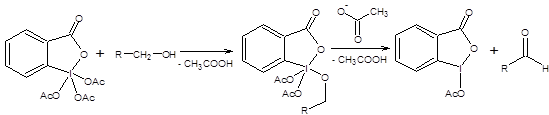
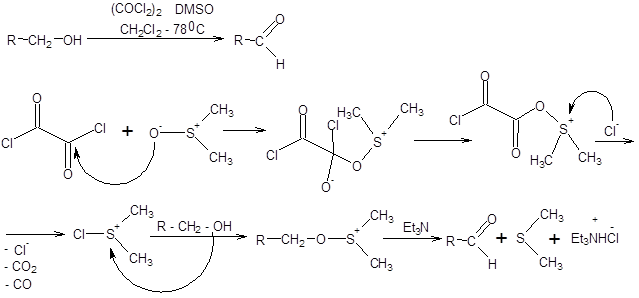
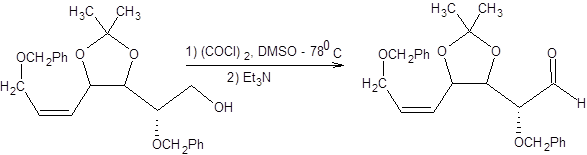
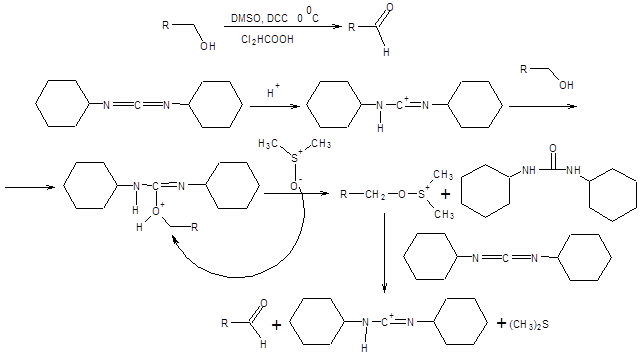
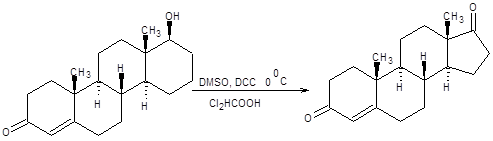
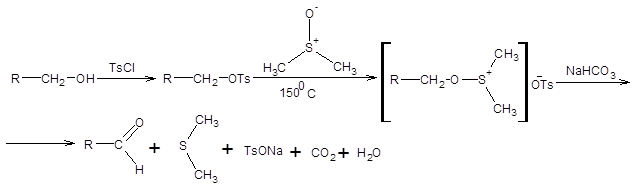
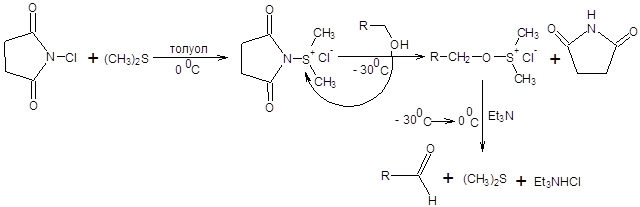 Схема 6.8
Схема 6.8