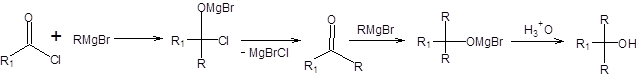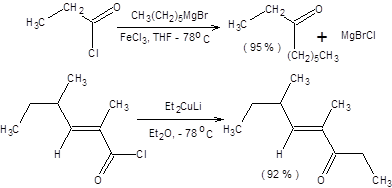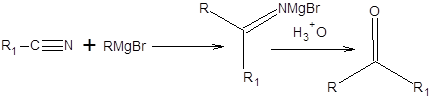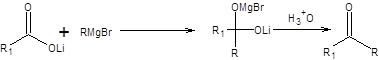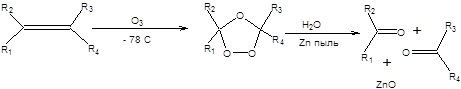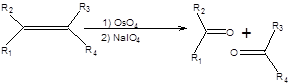Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Взаимодействие галогенангидридов карбоновых кислот с эквивалентами карбанионовСодержание книги
Поиск на нашем сайте
Эквиваленты карбанионов, такие как реактивы Гриньяра, взаимодействуют с ацилгалогенидами с образованием кетонов или третичных спиртов в зависимости от условий проведения реакции. Ранее считалось, что применение этого метода бесперспективно с целью синтеза кетонов, так как реакцию весьма трудно остановить и последовательно реализуются стадии, представленные на схеме 6.23, приводящие к образованию третичных спиртов.
Схема 6.23
Галогенангидриды активнее кетонов в реакциях с реактивами Гриньяра, что позволяет путем применения специальных методик остановить реакцию на стадии образования кетонов. Для подавления дальнейших превращений необходимо стабилизировать первичный продукт присоединения реактива Гриньяра к хлорангидриду. Стабилизация первичного продукта присоединения наблюдается, например, при введении в реакционную смесь хлорида железа(III), который координируется на нуклеофильном кислородном центре. Для достижения высоких выходов кетонов в этой реакции необходимо использовать избыток галогенангидрида и обратный порядок смешения реагентов. Также для синтеза кетонов из галогенангидридов карбоновых кислот некоторое применение нашли кадмийорганические и ртутьорганические соединения, однако наиболее универсальными для достижения указанной цели оказались диалкилкупраты. Галогенангидриды под действием диалкилкупратов превращаются в кетоны с высокой селективностью и часто с почти количественным выходом (схема 6.24).
Схема 6.24 Диалкилкупраты инертны по отношению к кето-группе, сложноэфирной группе, нитрильной и амидной группам, что позволяет проводить данную реакцию в присутствии этих функциональных групп в структуре субстрата.
Взаимодействие реактивов Гриньяра с нитрилами
Взаимодействие нитрилов с реактивами Гриньяра или литийорганическими соединениями используется в синтезе кетонов, согласно общей схеме, приведенной ниже:
Схема 6.25
Взаимодействие реактивов Гриньяра с солями карбоновых кислот
Соли карбоновых кислот представляют очень слабые ацилирующие реагенты и реагируют лишь с такими сильными нуклеофилами, как эквиваленты карбанионов, например, с литийорганическими соединениями или реактивами Гриньяра. Последующий гидролиз диенолята геминального диола приводит к образованию кетонов (схема 6.26).
Схема 6.26
Окисление двойных связей
Озонолиз алкенов открывает путь превращения двойной углерод – углеродной связи в карбонильную группу. Реакция проводится при пониженной температуре в присутствии очень активного окислителя – озона, что может сказаться на других функциональных группах субстрата, поэтому разработаны методы расщепления двойной углерод-углеродной связи в более мягких условиях. Метод Лемье – Джонса эквивалентен озонолизу в смысле образующихся продуктов и заключается в расщеплении двойной углерод-углеродной связи путем последовательной обработки алкена тетраоксидом осмия и перйодатом натрия, как показано на схеме 2.2.27.
Схема 6.27
Окисление диолов
1,2-Диолы возможно окислить до альдегидов или кетонов, причем как в водном растворе под действием HIO4 (метод Малапрада) (схема 6.28), так и в бензоле или уксусной кислоте в присутствии Pb(CH3COO)4 (метод Криге) (схема 6.28)[15].
Схема 6.28 Список литературы 1. Poos G. I., Arth G. E., Beyler R. E., Sarett L. H. // J. Am. Chem. Soc. 1953.V. 75.P. 422. 2. Luzzio F. A. // Org. React. 1998. V. 53. P. 1. 3. Corey E. J., Suggs J. W. // Tetrahedron Lett. 1975. V. 16. P. 2647. 4. Dess P. B., Martin J. С. // J. Am. Chem. Soc. 1991. V. 113. P. 7277. 5. Huang S. L., Omura K., Swern D. // J. Org. Chem. 1976. V. 41. P. 3329. 6. Pfitzner K. E., Moffatt J. G. // J. Am. Chem. Soc. 1963. V. 85. P. 3027. 7. Tidwell T.T. // Org. React. 1990. V. 39. P. 297. 8. Corey E. J., Kim C. U. // J. Am. Chem. Soc. 1972.V. 94. P. 7586. 9. Jones B. H. // J. Chem. Soc. 1953. P. 2548. 10. Реутов О. А., Курц А. Л., Бутин К. П. Органическая химия. М.: Бином. Лаборатория знаний, 2004. Т. 3. С. 1 - 253 11. Nahm S., Weinreb S. M. // Tetrahedron Lett. 1981. V. 22. P. 3815. 12. Nef J. U. // Justus Liebigs Ann. Chem. 1894. V. 280. P. 263. 13. Pinnick H. W. // Org. React. 1990. V. 38. P. 655. 14. Нодзаки Х. Современные направления в органическом синтезе. М.: Мир, 1986. С. 339 – 361. 15. Criegee R. // Ber. Dtsch. Chem. Ges. 1931. V. 64. P. 260.
|
||||
|
Последнее изменение этой страницы: 2021-05-27; просмотров: 181; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.188.219.131 (0.01 с.) |