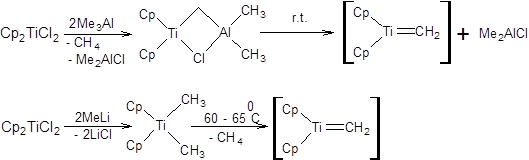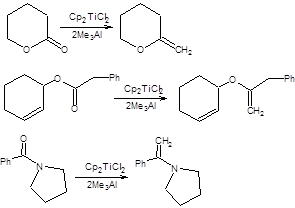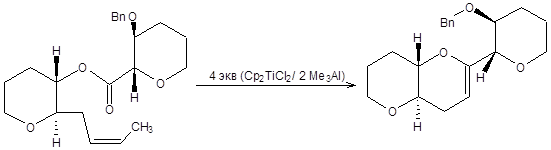Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Реакции метеленирования по тебе
Важное место в синтезе терминальных алкенов занимает реакция метеленирования по Теббе. В отличие от реакции Виттига и Петерсона, позволяющих метеленировать только альдегиды и кетоны, реакция Теббе дает возможность проводить метеленирование также сопряженных енонов, сложных эфиров и амидов. Метеленирование амидов представляет особый интерес, так как образующиеся енамины обладают высокой реакционной способностью по отношению к ряду электрофильных реагентов. В качестве активной частицы в реакции метеленирования по Теббе, как предполагают, выступает метилидентитаноцен. В зависимости от метода генерации активной частицы различают реагенты Теббе и Петасиса. Реагент Теббе получают обработкой дихлортитаноцена двумя эквивалентами триметилалюминия, а реагент Петасиса получают обработкой того же комплекса титана двумя эквивалентами метиллития (схема 3.51).
Схема 3.51
Механизм реакции метеленирования точно не установлен, однако предполагается последовательность стадий, аналогичная реакции метатезиса (схема 3.52).
Схема 3.52 Примеры применения реакции Теббе представлены на схеме 3.53:
Схема 3.53 Существенно расширила область применения реакции метеленирования по Теббе возможность проведения тандема с реакцией метатезиса, при этом метилидентитаноцен является не только активной частицей в реакции Теббе, но и активным центром реакции метатезиса. Тандем реакций Теббе и метатезиса – один из эффективных методов построения циклов, как показано на схеме 3.54.
Схема 3.54 Инверсия конфигурации алкенов Иногда возникает необходимость при проведении многостадийного синтеза в изменении конфигурации двойной С=С-связи. Физические методы изменения конфигурации, например действие УФ-излучения подходящей длины волны не приводят к удовлетворительным результатам ввиду образования смеси геометрических изомеров. Для проведения инверсии конфигурации эффективной оказалась последовательность стадий, включающая эпоксидирование исходного алкена с последующим действием на полученный эпоксид дифенилфосфида лития и метилйодида (схема 3.55). Последовательное действие дифенилфосфида лития и метилиодида с успехом может быть заменено применением трифенилфосфина.
Схема 3.55.
Метод инверсии конфигурации весьма надежен, что часто позволяет предварительно получать двойную связь той конфигурации, которая более доступна в синтетическом отношении, а затем производить инверсию конфигурации двойной связи.
Списоклитературы
1. Смит В. А., Дильман А. Д. Основы современного органического синтеза. М.: Бином. Лаборатория знаний, 2009. С. 72 – 87. 2. Corey E. J., Posner G. H. // J. Am. Chem. Soc. 1967.V. 89. P.3911. 3. Corey E. J., Posner G. H. // J. Am. Chem. Soc. 1968.V. 90. P.5615. 4. McMurry J. E., Scott W. J. // Tetrahedron Lett. 1980. V. 21. P. 4313. 5. Magid R. M. // Tetrahedron, 1980.V. 36. P. 1901. 6. MiyauraN., SuginomeH., SuzukiA. // Tetrahedron. 1983. V. 39. P.3271. 7. Kalinin V. N. // Synthesis. 1992. P. 413. 8. Negishi E. I. // J. Org. Chem. 1977, V. 42, P. 1821. 9. Milstein D., Stille J. K.// J. Am. Chem. Soc. 1978. V. 100. P. 3636. 10. Milstein D., Stille J. K. // J. Am. Chem. Soc. 1979. V. 101. P. 4992. 11. Farina V., Krishnamurphy V., Scott W. // J. Org. React. 1997. V. 50. P. 1. 12. Hiyama T., Hatanaka Y. // Pure. Appl. Cnem. 1994. V. 66. P. 1471. 13. Miyaura N., Suzuki A. // Chem. Rev. 1995. V. 95. P. 2457. 14. Urawa Y., Ogura K. // Tetrahedron Lett. 2003.V. 44. P. 271. 15. Sonogashira K., Tohda Y., Hagihara N. // Tetrahedron Lett.1975. V. 16. P. 4467. 16. Alami M., Ferri F., Linstrumelle G. // Tetrahedron Lett. 1993. V. 34. P. 6403. 17. Heck R. F., Nolley J. P.// J. Am. Chem. Soc. 1968.V. 90. P. 5518. 18. Amatore C., Jutand A. // Acc. Chem. Res. 2000.V. 33. P. 314. 19. Furstner A. // Angew. Chem. Int. Ed. Engl. 2000. V. 39. P. 3013. 20. Grubbs R. H., Chang S. // Tetrahedron. 1998. V. 54. P. 4413. 21. Furstner A., Davies P. W. // Chem. Commun. 2005. P. 2307. 22. Herisson J. L., Chauvin Y. // Macromol. Chem. 1971.V. 141. P.161. 23. Kirkland T. A., Lynn D. M., Grubbs R. H. // J. Org. Chem. 1998.V. 63. P. 9904.
Лекция 4. Синтез спиртов
|
|||||
|
Последнее изменение этой страницы: 2021-05-27; просмотров: 107; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 52.15.57.52 (0.008 с.) |