Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Построение структурных формул. Углеводороды.Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
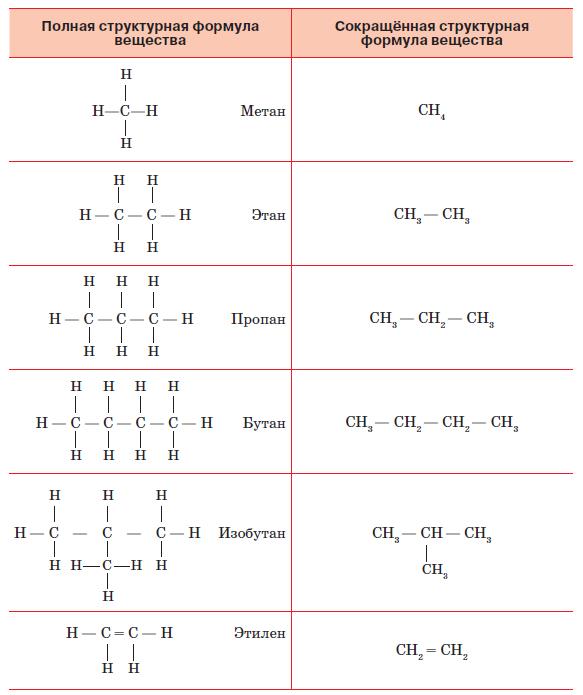
На основе этих идей А. М. Бутлеров разработал принципы построения графических формул химических веществ. Для этого требуется знать валентность каждого элемента, которую изображают на рисунке в виде соответствующего числа чёрточек. Пользуясь этим правилом, легко установить, возможно или невозможно существование вещества с определённой формулой. Так, существует соединение, называемое метаном и имеющее формулу СН4. Соединение с формулой СН5 невозможно, так как для пятого водорода у углерода уже не найдётся свободной валентности. Рассмотрим сначала принципы строения наиболее просто устроенных органических соединений. Их называют углеводородами, так как в их состав входят только атомы углерода и водорода (рис. 138). Самым простым из них является упомянутый метан, в котором есть всего один атом углерода. Прибавим к нему ещё один такой же атом и посмотрим, как будет выглядеть молекула вещества, называемого этаном. У каждого атома углерода одна валентность занята его собратом – другим углеродным атомом. Теперь надо заполнить водородом оставшиеся валентности. У каждого атома осталась по три свободных валентных связи, к которым и присоединим по одному атому водорода. Получилось вещество, имеющее формулу С2Н6. Прибавим к нему ещё один атом углерода.
Рис. 138. Полные и сокращённые структурные формулы органических соединений
Теперь мы видим, что у среднего атома осталось только две свободных валентности. К ним мы присоединим по атому водорода. А к крайним углеродным атомам добавим, как и прежде, по три атома водорода. Получим пропан – соединение с формулой С3Н8. Такую цепочку можно продолжать, получая всё новые и новые углеводороды. Но углеродные атомы необязательно должны располагаться в молекуле в линейном порядке. Допустим, что мы хотим добавить к пропану ещё один углеродный атом. Оказывается, это можно сделать двумя способами: присоединить его либо к крайнему, либо к среднему атому углерода пропана. В первом случае мы получим бутан с формулой С4Н10. Во втором случае общая, так называемая эмпирическая, формула будет такой же, но изображение на рисунке, называемое структурной формулой, будет выглядеть иначе. И название вещества будет несколько иное: не бутан, а изобутан. Вещества, имеющие одну и ту же эмпирическую, но разные структурные формулы, называют изомерами, а способность вещества существовать в виде различных изомеров – изомерией. Мы, например, употребляем в пищу различные вещества, имеющие одну и ту же формулу С6 Н12О6, но структурные формулы они имеют различные и носят разные названия: глюкоза, фруктоза или галактоза. Углеводороды, которые мы рассмотрели, называют предельными. В них все атомы углерода связаны между собой одинарной связью. Но так как атом углерода четырёхвалентен и имеет четыре валентных электрона, то теоретически он может образовывать двойные, тройные и даже четверные связи. Четверные связи между атомами углерода в природе не существуют, тройные встречаются редко, а вот двойные присутствуют во многих органических веществах, в том числе и в углеводородах. Соединения, в которых имеются двойные или тройные связи между атомами углерода, называют непредельными или ненасыщенными углеводородами. Возьмём снова молекулу углеводорода, содержащую два атома углерода, но соединим их с помощью двойной связи (см. рис. 138). Мы видим, что теперь у каждого атома углерода осталось по две свободных связи, к каждой из которых он может присоединить по одному атому водорода. Получаемое соединение имеет формулу С2Н4 и называется этиленом. Этилен, в отличие от этана, имеет меньше атомов водорода при том же числе углеродных атомов. Поэтому углеводороды, имеющие двойную связь, и называют ненасыщенными в том смысле, что они не насыщены водородом. Если углеводород потеряет один атом водорода, у него образуется свободная валентная связь, с помощью которой он может присоединиться к какой-нибудь другой молекуле. Такие остатки углеводородов называют алкилами. Их названия происходят от имени образовавшего их углеводорода с заменой суффикса – ан на – ил (метил, этил, пропил, бутил и т. д.). Зная принципы строения углеводородов, можно легко понять общие закономерности строения других органических веществ.
Углеводы.
Углеводы состоят из атомов углерода, водорода и кислорода. При этом число атомов кислорода в их молекулах практически всегда равно числу атомов углерода, а число атомов водорода – вдвое больше. Таким образом, на один атом углерода приходится как бы одна молекула воды. Отсюда и произошло их название. Углеводы в большом количестве встречаются во всех живых организмах и носят также название сахаров. Простые сахара содержат пять или шесть углеродных атомов и соответственно называются пентозами или гексозами (от греч. pente – пять и hex – шесть). Формулы таких углеводов записывают как С5Н10О5 и С6Н12О6 или С5(Н2О)5 и С6(Н2О)6. Существуют также сложные углеводы, о чём будет подробно рассказано в дальнейшем.
Спирты
Спирты содержат в составе своей молекулы гидроксильную группу (ОН–). Наиболее известен этиловый спирт, который входит в состав алкогольных напитков. Он состоит из алкила этила и присоединённой к нему группы ОН-, т. е. имеет формулу СН3—СН2—ОН. Присоединяя гидроксильную группу к остаткам различных углеводородов можно получать различные спирты: метиловый, пропиловый и др. Все они гораздо более токсичны, чем этиловый спирт, хотя и он тоже не безвреден. Спирты можно рассматривать как производные воды, в которых один из атомов водорода замещён на какой-либо алкил. Если в молекуле спирта содержится одна гидроксильная группа, его называют одноатомным. Однако в состав некоторых спиртов может входить две, три и более ОН--групп. Такие спирты называют многоатомными. Наибольшее значение для жизнедеятельности организмов имеет трёхатомный спирт глицерин, входящий в состав жиров.
Органические кислоты
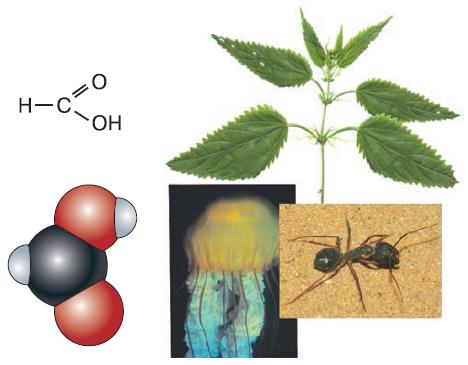
В состав молекул органических кислот входит карбоксильная группа (– СООН–). Кислотами их называют потому, что в процессе электролитической диссоциации от их молекул отщепляется ион водорода. Как правило, органические кислоты являются слабыми кислотами, т. е. плохо диссоциируют в воде. В общем виде формула органической кислоты выглядит как R – COOH, где R – радикал (некая органическая группа со свободной валентной связью). Таким радикалом может быть метил (уксусная кислота), более длинные углеводородные алкилы или сложные органические соединения. В одной из кислот, носящей название муравьиной, вместо органического радикала к карбоксильной группе присоединён атом водорода. Таким образом, её формула – НСООН (рис. 139).
Рис. 139. Муравьиная кислота
Среди органических кислот особую роль играют аминокислоты, из которых строятся белки – основа существования всех живых организмов. Аминокислоты имеют в составе своей молекулы помимо карбоксильной ещё и аминогруппу (—NH2). Чуть позже мы рассмотрим, как образуются белковые молекулы.
Проверьте свои знания
1. Как называются соединения, в состав которых входит только углерод и водород? 2. Что такое алкилы? 3. Какая группа входит в состав органических кислот? 4. Какие соединения называют изомерами?
Задания
1. Подберите эпиграф к данному параграфу. 2. Эмпирическая формула соединения – C2H4O. Изобразите структурные формулы возможных изомеров этого соединения. 3. Исходя из валентности атомов тех или иных элементов, выясните, могут ли в природе существовать вещества с сокращённой структурной формулой CH5; C2H7; C3H6; C4H6; C4H11. Если нет, свой ответ обоснуйте. Если да, изобразите полные структурные формулы этих веществ.
|
||||
|
Последнее изменение этой страницы: 2021-04-05; просмотров: 447; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.15.225.177 (0.008 с.) |