Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Периодический закон и периодическая система химических элементов Д. И. МенделееваСодержание книги
Поиск на нашем сайте
Вероятно, это самый компактный и полный значения сгусток знания, когда-либо изобретённый человеком. Б. Кедров
Периодическому закону не грозит разрушение, а обещаются только надстройка и развитие. Д. Менделеев
В процессе развития химии постепенно складывалось представление о химических элементах, а также о простых и сложных веществах. С современной точки зрения, химический элемент – это вид атома с определённым зарядом ядра. Простые вещества состоят из атомов одного элемента, а сложные – из атомов двух и более элементов. К середине XIX в. было известно уже более шестидесяти элементов, чуть больше – соответствующих им простых веществ, а также и множество сложных веществ: оксидов, гидроксидов, солей. Исследуя реакции, в которых участвуют те или иные простые вещества, химики установили, что некоторые из них обладают схожими химическими свойствами (например, хлор и бром, натрий и калий). В то же время существуют вещества, которые очень сильно различаются по свойствам (например, натрий и хлор). Возникла потребность в приведении всего множества элементов в какую-нибудь систему, которая позволила бы объяснить химические особенности различных веществ, образованных этими элементами. Попыток создания такой системы было предпринято много. Ближе всех к решению этой задачи подошёл в 1864 г. немецкий химик Юлиус Лотар Мейер, но настоящий закон, позволивший не только объяснить, но и предсказать свойства элементов на единой основе, открыл российский химик Дмитрий Иванович Менделеев (1834–1907) (рис. 120).
Открытию Д. И. Менделеевым периодического закона предшествовали годы упорного труда в поиске закономерностей, которые могли бы позволить описать изменение свойств элементов и их соединений на единой основе. Напомним, что в то время ещё ничего не было известно о строении атомов и их связи со свойствами химических элементов, хотя атомную массу, или, как тогда говорили, атомный вес, измерять умели. Именно атомную массу и принял Д. И. Менделеев в качестве главной характеристики при построении периодической системы. Расположив элементы в порядке возрастания атомных масс, Менделеев наблюдал периодическое изменение их свойств. Эту закономерность он сформулировал в виде Периодического закона химических элементов. В марте 1869 г. учёный представил свои результаты Российскому химическому обществу, а через два года опубликовал статью, в которой сформулировал этот закон так:
«Свойства элементов, а потому и свойства образуемых ими простых и сложных тел стоят в периодической зависимости от атомного веса».
Суть открытия, сделанного Менделеевым, заключается в следующем. По мере увеличения атомной массы элементов их свойства постепенно меняются.
Рис. 120. Д. И. Менделеев
Однако в определённый момент после изменения атомной массы ещё на одну единицу свойства следующего элемента меняются резко, скачком, и этот элемент оказывается похож на тот, который уже был в цепочке элементов несколькими позициями ранее. Эта закономерность отражена в Периодической системе химических элементов.
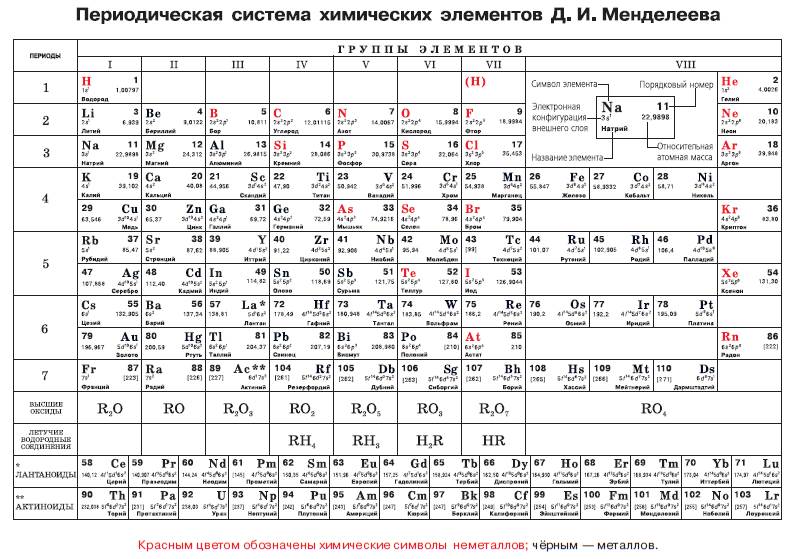
Рис. 121. Периодическая система химических элементов Д. И. Менделеева
Давайте внимательно рассмотрим периодическую систему (рис. 121). В её структуре различают горизонтальные ряды, которые образуют малые и большие периоды. Первый период содержит всего два элемента – водород и гелий. Второй и третий периоды тоже состоят из одного ряда, но содержат уже по восемь элементов. Начинаются они с щелочного металла (лития или натрия) и заканчиваются инертным газом (неоном или аргоном). Во всех периодах с увеличением относительных атомных масс (слева направо) наблюдается ослабление металлических и усиление неметаллических свойств элементов. Четвёртый и пятый периоды также начинаются щелочным металлом и заканчиваются инертным газом, но в каждом из них содержится по восемнадцать элементов. Эти периоды представлены двумя рядами в периодической системе и называются длинными периодами. Шестой период включает в себя 32 элемента, но в периодической системе тоже занимает два ряда с таким же числом ячеек, как и два предыдущих периода. Это возможно потому, что пятнадцать элементов из этого периода, обладающие почти одинаковыми химическими свойствами, помещены в одной ячейке под номером 57. Они называются лантаноидами по наименованию первого из них – лантана и перечислены в дополнительной строке. Аналогично обстоит дело с седьмым периодом, где в ячейке 89 вместе с актинием умещаются ещё четырнадцать элементов, называемых актиноидами. Вертикальные столбцы периодической системы – группы – образованы элементами, обладающими схожими химическими свойствами. Каждая группа делится на две подгруппы, которые раньше называли главной и побочной подгруппами. В настоящее время главную подгруппу обозначают латинской буквой А, а побочную – буквой В. Для примера рассмотрим первую группами. Щелочные металлы литий, натрий, калий, цезий, рубидий и франций образуют IA группу. Это одновалентные металлы, легко вступающие в химические реакции. В III группу входят медь, серебро и золото. Они тоже являются металлами, но их химические свойства отличаются от тех, которыми обладают щелочные металлы. Периодический закон получил всеобщее признание не сразу. Во– первых, во время его открытия ещё ничего не было известно о строении атомов и его связи со свойствами химических элементов. Поэтому казалось, что обнаруженная Менделеевым закономерность не имеет под собой надёжной физической основы. Во-вторых, как оказалось, атомные массы некоторых элементов до этого были определены неправильно, и Менделеев взял на себя смелость изменить их, опираясь только на обнаруженную им периодическую закономерность. Он справедливо полагал, что эти вопросы найдут своё объяснение при выявлении сложной структуры атома. Впоследствии правота его утверждений подтвердилась. В-третьих, в периодической системе оказались пустые ячейки, которым не соответствовал ни один из известных на то время элементов. Менделеев предсказал, что эти элементы существуют, и действительно, в 1875 г. был открыт галлий, в 1879 г. – скандий, а в 1886 г. – германий. С середины 1880-х гг. периодический закон был окончательно признан, но полное своё объяснение он получил только после того, как стало известно строение атома.
Проверьте свои знания
1. Какая закономерность была положена Д. И. Менделеевым в основу открытого им периодического закона? 2. Какие элементы расположены в начале периодов в Периодической системе Д. И. Менделеева, а какие – в их конце? 3. Где в Периодической системе Д. И. Менделеева располагаются элементы со схожими химическими свойствами?
Задания
На основании сведений, полученных вами при изучении предыдущей главы, объясните, что означают числа, помещённые в каждой ячейке периодической системы. Почему многие из них являются дробными?
|
||||
|
Последнее изменение этой страницы: 2021-04-05; просмотров: 159; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.145.59.89 (0.01 с.) |