Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Скорость и энергия химических реакцийСодержание книги
Поиск на нашем сайте
Скорость и энергия химических реакций
Скоростью химической реакции называется изменение концентрации одного из реагирующих веществ за единицу времени. Для того чтобы произошла химическая реакция, атомы или молекулы реагирующих веществ должны прийти в соприкосновение или, попросту говоря, столкнуться. Это необходимое условие для возникновения реакции, но оно не является достаточным. Взаимодействующие частицы должны обладать определённым сродством друг к другу. Это сродство зависит от строения и энергии атомов и молекул, и чем оно больше, тем выше вероятность того, что они образуют соединение. Очевидно, что чем больше частиц содержится в данном объёме реакционной среды, тем чаще они будут сталкиваться. Поэтому скорость реакции пропорциональна произведению концентраций реагирующих веществ. Это правило называют законом действующих масс. Он был сформулирован норвежскими химиками К. Гульдбергом и П. Вааге в 1867 г. Закон действующих масс выражают в виде формулы: V = k [A] a • [B] b, где [A] и [B] – концентрации реагирующих веществ, а и b – их стехиометрические коэффициенты. Величина k называется константой скорости реакции и зависит от степени сродства реагирующих веществ и внешних факторов, влияющих на скорость химической реакции, например температуры.
Факторы, влияющие на скорость химической реакции.
При повышении температуры скорость движения молекул увеличивается и, следовательно, увеличивается не только вероятность, но и, что гораздо важнее, энергия их соударения. Согласно правилу Вант-Гоффа, при повышении температуры на каждые 10 °C скорость реакции возрастает в 2–4 раза. Отношение константы скорости реакции, протекающей при определённой температуре, к константе скорости при температуре в 10 раз меньшей называют температурным коэффициентом химической реакции. Если один из компонентов реакции находится в твёрдом состоянии, а другой – в жидком или газообразном, то на скорость реакции влияет также величина поверхности, которой они соприкасаются между собой. Например, растворение металла в кислоте будет происходить тем быстрее, чем больше степень его измельчения. Если опустить в кислоту большой кусок металла, он может реагировать с ней очень долго, а если то же количество металла растереть в порошок, реакция пройдёт практически мгновенно (рис. 132). Очень важным фактором протекания химической реакции является энергетическая составляющая. Энергию, необходимую для начала реакции, называют энергией активации. Чем меньше энергия активации, тем быстрее протекает реакция. Например, при образовании ионной связи между катионами и анионами энергия активации очень мала, поэтому такие реакции протекают почти мгновенно.
Катализаторы.
Многие химические реакции можно ускорить или замедлить введением в реакционную среду некоторых дополнительных веществ. Эти вещества не участвуют в реакции и не расходуются в ходе её протекания, но оказывают влияние на её скорость. Вещества, ускоряющие реакцию, называют катализаторами, а вещества, оказывающие противоположное действие, – ингибиторами. Процесс ускорения реакций под действием катализатора называют катализом . Катализаторы чаще всего действуют следующим образом. На их поверхности имеются особые участки – активные центры. К этим участкам присоединяются и накапливаются молекулы реагентов. Такое явление называют адсорбцией.
Рис. 132. Зависимость скорости реакции от площади соприкосновения реагирующих веществ
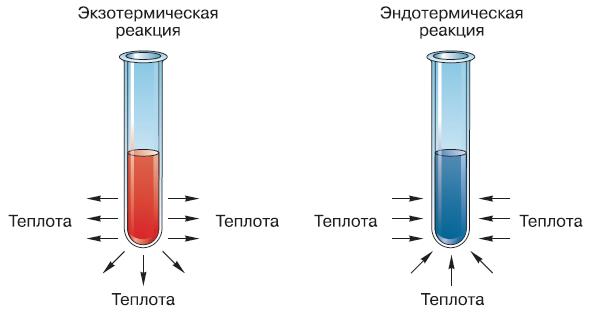
Рис. 133. Схематическое изображение экзотермической и эндотермической реакций
В результате в районе активных центров концентрация взаимодействующих молекул становится очень большой, и это ведёт к ускорению реакции. Кроме того, под действием катализатора у адсорбированных молекул ослабляются связи между атомами.
|
||||
|
Последнее изменение этой страницы: 2021-04-05; просмотров: 68; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.145.170.164 (0.008 с.) |