Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Современные представления о строении атомаСодержание книги
Поиск на нашем сайте
Строение ядра.
Термин «атом» сохранился в современной науке, несмотря на то что уже давно стало понятно, что эта частица не является собственно «атомом», т. е. «неделимым». В настоящее время известно, что атом состоит из ядра и окружающей его электронной оболочки, которую также называют электронным облаком. Ядро обладает положительным электрическим зарядом, а электроны – отрицательным, поэтому они удерживаются около атомного ядра за счёт силы электростатического притяжения. В то же время между электронами действует сила электрического отталкивания. Совокупность этих взаимодействий определяет устойчивость атома. Положительный электрический заряд ядра атома всегда равен по абсолютной величине сумме отрицательных зарядов электронов, окружающих ядро. Поэтому суммарный заряд атома равен нулю, т. е. атом является электрически нейтральным. Если под воздействием внешней энергии один или несколько электронов покидают атом, тот приобретает положительный заряд и становится положительно заряженным ионом. Атомное ядро по размеру составляет менее одной стотысячной части всего атома, однако масса ядра примерно в 4000 раз больше, чем масса всех входящих в него электронов. Так как электронное облако не имеет резкой границы, размеры атомов определяют по расстоянию между их ядрами в молекулах. Радиус самого маленького атома (гелия) составляет тридцать две миллиардных миллиметра, а самого большого (цезия) – приблизительно в семь раз больше. Эти размеры в тысячи раз меньше, чем длина волны видимого света, поэтому атомы невозможно увидеть в обычный световой микроскоп. Отдельные атомы можно наблюдать только с помощью современных микроскопов, использующих квантовые эффекты. Для того чтобы получить представление о размере атомов, надо представить себе, что яблоко увеличилось до размеров Земли. Тогда размеры атомов будут равны размеру первоначального яблока. Масса атома определяется главным образом массой его ядра, которое состоит из двух видов частиц, называемых нуклонами (от лат. nucleus – ядро), имеющих почти одинаковую массу. Нуклоны бывают двух видов: положительно заряженные протоны и нейтральные нейтроны. Вид атома с определённым зарядом ядра называют химическим элементом. Атом каждого элемента отличается от других числом протонов в атомном ядре, которое соответствует его порядковому номеру в Периодической системе элементов Д. И. Менделеева и числу электронов в электронной оболочке. Кроме того, число протонов определяет электрический заряд ядра, так как электрически нейтральные нейтроны не вносят в него вклада. Поэтому число протонов в ядре какого-либо атома называют его зарядовым числом. Самое простое строение имеет атом водорода. Он состоит всего из одного протона и одного электрона. Другие элементы обязательно имеют в составе своего ядра нейтроны. Так, ядро атома гелия состоит из двух протонов и двух нейтронов. Масса ядра определяется суммой масс составляющих его протонов и нейтронов и называется атомной массой. Поскольку масса атомов очень мала, её неудобно измерять непосредственно в граммах. Поэтому в практических целях используют величину, называемую массовым числом, которая равна числу всех входящих в ядро нуклонов. Масса одного протона или нейтрона, таким образом, принимается за единицу.
Изотопы
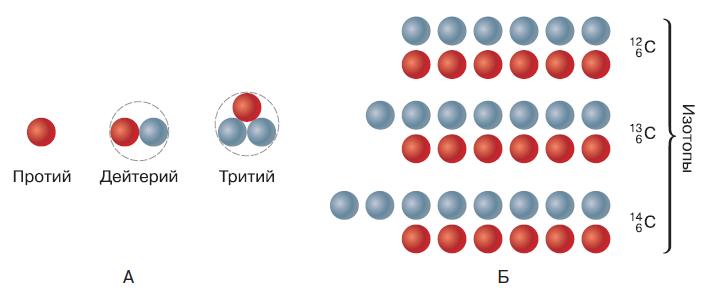
Может показаться, что каждый химический элемент должен всегда иметь определённое зарядовое число и определённую атомную массу. Однако это утверждение верно только в отношении зарядового числа. Ещё в начале XX в. было обнаружено, что некоторые элементы, проявляющие одинаковые свойства в химических реакциях, состоят из атомов, имеющих различную атомную массу. Атомы одного и того же элемента, имеющие различную массу, были названы изотопами. Встречающиеся в природе элементы чаще всего являются смесью нескольких изотопов, один из которых является преобладающим. Атомы всех изотопов одного элемента имеют одинаковый заряд ядра и, соответственно, занимают одно и то же место в периодической системе химических элементов. Различие между ними заключается в числе содержащихся в ядре нейтронов. Ядро атома гелия чаще всего содержит два нейтрона, но встречаются изотопы, число нейтронов в ядре которых равно одному или трём. Кислород в природе может существовать в виде трёх изотопов с восемью, девятью или десятью нейтронами. При этом число протонов в ядре атома кислорода и, следовательно, его зарядовое число и атомный номер всегда равны восьми. Водород является первым элементом периодической системы элементов. Ядро его атома содержит всего один протон и чаще всего вообще не содержит нейтронов. Такой изотоп водорода называют протий. Однако в природном водороде содержится почти 0,02 % изотопа, называемого дейтерием и содержащего один нейтрон (рис. 115, А). Соответственно, атомная масса дейтерия равна двум. Рассмотренные изотопы гелия, кислорода и водорода называют стабильными, так как они устойчивы и не подвергаются самопроизвольному распаду. К настоящему времени в природе обнаружено 270 стабильных изотопов. Кроме них существуют и нестабильные изотопы, ядро которых неустойчиво и подвержено постоянному распаду. Эти изотопы чаще всего встречаются у тяжёлых элементов, т. е. элементов с большой атомной массой. Нестабильные изотопы часто получают искусственно при помощи ядерных реакций. Таким способом можно получить, например, нестабильный изотоп водорода, в ядре которого находятся два нейтрона. Этот изотоп водорода называется тритием из-за того, что его атомная масса равна трём (один протон плюс два нейтрона) (см. рис. 115, А).
Рис. 115. Состав атомных ядер: А – водорода; Б – углерода (красные шарики – протоны, голубые – нейтроны)
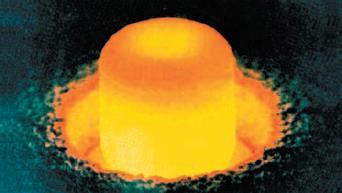
Большинство природных химических элементов существуют в виде нескольких устойчивых изотопов (рис. 115, Б). Например, железо имеет четыре стабильных изотопа, ртуть – семь, а олово – десять. Поэтому атомная масса элементов выражается дробным числом. Так, хлор, встречающийся в природе, на 76,5 % состоит из изотопа с атомной массой, равной 35, и на 24,5 % – из изотопа с массой 37. Поэтому средняя атомная масса хлора равна приблизительно 35,5. Как следует из самого названия, нестабильные изотопы не могут существовать в течение неограниченного периода времени и постоянно распадаются. Скорость распада ядер этих изотопов измеряется их периодом полураспада – временем, за которое первоначальное количество частиц уменьшается вдвое. У большинства нестабильных изотопов этот период составляет не более нескольких секунд, хотя известны изотопы с периодом полураспада в миллионы лет. Во время распада ядра таких атомов испускают радиоактивное излучение. Таким образом, можно сказать, что все неустойчивые изотопы обладают радиоактивностью (рис. 116). Химические свойства элементов, т. е. их способность вступать в химические реакции, не зависят от числа нейтронов в ядре атома, а связаны со строением его электронной оболочки. Поэтому в химическом отношении все изотопы одного элемента являются абсолютно одинаковыми. Эту особенность используют во многих областях науки, техники и медицины. Таким образом можно, например, судить о превращениях какого-либо химического вещества в организме и о местах его включения в клетки и ткани. Можно синтезировать биологически активное вещество, включив в него неустойчивый радиоактивный изотоп какого-либо атома, например углерода или азота. В химическом и биологическом отношении это вещество ничем не будет отличаться от такого же вещества, не содержащего радиоактивного изотопа. В какие бы другие соединения это вещество ни превращалось, как бы ни изменялось строение его молекулы, радиоактивное излучение нестабильного атома всегда будет сохраняться. Если затем ввести это вещество в кровь, то, измеряя испускаемое этим изотопом слабое, безопасное для организма, радиоактивное излучение в различных участках человеческого тела, можно судить о том, где и в каких количествах накапливается в организме это вещество или продукты его обмена. Постепенно эти продукты или само вещество будут выводиться из организма, и по уменьшению радиоактивности можно определить скорость их выведения. Такой метод получил название исследования с применением «меченых атомов».
Рис. 116. Радиоактивный металл кюрий светится в темноте, испуская большое количество ядер гелия
|
||||
|
Последнее изменение этой страницы: 2021-04-05; просмотров: 110; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.216.92.5 (0.009 с.) |