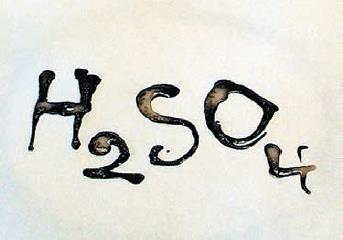Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Сложные неорганические вещества: кислоты и основания.Содержание книги
Поиск на нашем сайте
Среди сложных неорганических веществ большой интерес представляют кислоты и основания (щёлочи). В состав кислот входят атомы водорода, способные в ходе электролитической диссоциации отщепляться в виде ионов Н+ от остальной части молекулы. Наиболее известными кислотами являются серная (H2SO4), азотная (HNO3), фосфорная (H3PO4), угольная (H2CO3), соляная (HCl). При электролитической диссоциации кислот образуются положительно заряженные ионы водорода Н+ (катионы) и отрицательно заряженные анионы (HSO-4 или SO2-4, H2PO4, Cl- и т. д.), которые называют кислотными остатками. Таким образом, в растворах, содержащих кислоты, всегда присутствует большое количество ионов водорода. Чем больше концентрация ионов водорода в растворе, тем большей кислотностью он обладает. При электролитической диссоциации оснований в качестве аниона образуется отрицательно заряженный ион ОН-, который называют гидроксилом или гидроксид-ионом. К основаниям относятся гидроксиды натрия (NaOH), калия (KOH), кальция (Ca(OH)2) и др. Растворимые в воде основания называют щелочами. Одновременно слабой кислотой и слабым основанием является вода. В обычных условиях вода очень слабо диссоциирует с образованием ионов Н+ и ОН-. Содержание ионов в ней мало, поэтому вода плохо проводит электрический ток. В 1 л чистой воды при комнатной температуре содержится 10—7 моль, т. е. 6,02 1016 катионов водорода и такое же количество гидроксид-ионов. Среду, в которой концентрации ионов Н+ и ОН- равны, называют нейтральной. Если концентрация ионов водорода [H+] в растворе превышает концентрацию гидроксид– ионов [OH– ], то раствор имеет кислотную среду, а если больше гидроксид-ионов [OH– ] – щелочную. Степень кислотности или щёлочности раствора характеризуют так называемым водородным показателем – рН. Он представляет собой взятый с обратным знаком показатель степени концентрации ионов водорода в растворе, выраженный в моль/л. В нейтральной среде [H+] = [OH– ], pH = 7,0 (чистая вода). В кислотной среде [H+] > [OH – ], pH < 7,0. В щелочной среде [H+] < [OH– ], pH > 7,0. В желудочном соке человека содержится соляная кислота, которая диссоциирована на ионы H+ и Cl-. Концентрация ионов водорода в желудочном соке равна 0,01 или 10-2 моль/л. Это значительно больше, чем их концентрация в воде. Поэтому желудочный сок является очень кислым, а его рН ≈ 2,0. В щелочных растворах концентрация ионов водорода снижена и соответственно повышено содержание ионов ОН-. Например, кровь человека обладает слабой щелочной реакцией (рН ≈ 7,3–7,5). Большинство употребляемых в пищу продуктов и напитков имеют слабокислую реакцию. Так, рН яблочного сока около 3, кофе – примерно 5, чая – около 6, а молока – чуть меньше 7. Щелочной реакцией обладает раствор питьевой соды, растворы мыла и стиральных порошков. Некоторые вещества способны менять свой цвет в зависимости от кислотности среды. В химии такие вещества используют в качестве индикаторов, с помощью которых можно различить кислые, щелочные и нейтральные растворы. Примерами индикаторов являются фенолфталеин и лакмус. Однако увидеть подобную реакцию можно при помощи обычных продуктов. Возьмите немного вишнёвого, клюквенного или другого красного сока и капните в него немного раствора пищевой соды. Сок немедленно изменит цвет на синий или фиолетовый. Это происходит потому, что при добавлении соды создаётся щелочная реакция, и содержащийся в соке пигмент теряет красную окраску, которой он обладал в кислой среде. Не все кислоты и основания в равной степени способны к диссоциации. Те из них, значительная часть молекул которых распадаются при растворении в воде на ионы, называют сильными кислотами или сильными основаниями соответственно. Те, в которых диссоциирует лишь небольшая часть молекул, называют слабыми кислотами или слабыми основаниями. Так, соляная, серная и азотная кислоты – сильные, а угольная кислота – слабая. Гидроксиды натрия и калия являются сильными основаниями, а нашатырный спирт (раствор аммиака в воде) – слабым основанием. Сильные кислоты и щёлочи обладают очень высокой химической активностью, способны растворять и разрушать многие материалы, а их соприкосновение с кожей или со слизистыми оболочками могут вызвать ожоги (рис. 136).
Рис.135. Обугливание бумаги. концентрированной серной кислотой
Проверьте свои знания
1. На какие ионы диссоциируют кислоты и основания при растворении в воде? 2. Как изменяется значение pH в зависимости от степени кислотности или щёлочности растворов? Чему равен pH чистой воды? 3. Какие из пищевых или бытовых веществ имеют кислую, а какие – щелочную реакцию? 4. Чем различаются сильные и слабые кислоты и основания?
Задания
1. Подберите эпиграф к данному параграфу. 2. Проверьте опытным путём, как изменяется окраска вишнёвого или черничного сока при добавлении к ним слабых растворов уксуса и питьевой соды. Сделайте вывод.
Соли и их применение
Соли.
Кислоты обладают способностью взаимодействовать с металлами. В ходе этих реакций катион Н+ в молекуле кислоты замещается на катион металла. В результате образуются соединения, называемые солями. Если в молекуле кислоты находится не один, а два или три атома водорода, способных отщепляться в виде ионов Н+ в ходе электролитической диссоциации, то такая кислота называется двух– или трёхосновной. В её молекуле может замещаться металлом один, два или все три водородных атома. В качестве примера рассмотрим угольную кислоту. Она имеет формулу Н2СО3 и является двухосновной. Если только один из атомов водорода заменить на катион натрия, то получится соединение NaHCO3 – гидрокарбонат натрия, или пищевая сода. Если же на катион натрия замещаются оба атома водорода, то получается карбонат натрия (Na2CO3), или техническая сода, непригодная для употребления в пищу. Соли образуются также в результате реакции нейтрализации – взаимодействия кислот с основаниями. Так, при взаимодействии соляной кислоты НCI и гидроксида натрия NaОН образуется хлорид натрия (NaCl). В любом случае в состав солей входят катионы металла и анионы кислотных остатков. При обычных условиях соли являются кристаллическими веществами. Многие соли, такие как хлорид калия (KCl) или хлорид натрия (NaCl), хорошо растворяются в воде. Растворимость других солей, например хлорида серебра (AgCl), в воде очень мала – в 1 л воды может раствориться менее 1 мг вещества. В кристаллах солей катионы металлов и анионы кислотных остатков связаны между собой ионной связью. Поэтому при растворении в воде соли диссоциируют на ионы (см. § 48). В результате в растворах солей нет их молекул, а присутствуют только положительно и отрицательно заряженные ионы, окружённые молекулами воды (см. рис. 125). Поскольку ионы заряжены и могут свободно перемещаться в электрическом поле, то растворы солей хорошо проводят электрический ток. Растворы солей называют проводниками второго рода. В отличие от проводников первого рода (например, металлов), где переносчиками электричества являются электроны, в растворах солей происходит перенос ионов, т. е. частиц вещества.
Электролиз.
Если в раствор соли погрузить два разноимённо заряженных электрода, соединённых с источником тока, то отрицательно заряженные анионы будут двигаться к аноду, а положительно заряженные катионы металлов – к катоду. Затем на электродах начинают протекать окислительно-восстановительные процессы. Например, на катоде катионы металла могут принимать электроны, в результате чего будет происходить выделение металла в свободном виде. На аноде анионы, например, Cl- отдают электроны, и выделяется газообразный хлор Cl2. Такой процесс, протекающий при прохождении через растворы солей электрического тока, называется электролизом и широко используется в науке и технике. Происходящие при электролизе процессы зависят от природы растворённой соли. Если проводится электролиз солей активных металлов, например натрия или калия, то на катоде выделяется газообразный водород. Для того чтобы получить эти металлы электролизом, нужно использовать не растворы, а расплавы их солей. На аноде при электролизе солей могут выделяться галогены или кислород. Впервые для химических исследований электролиз применил английский исследователь Гемфри Деви (1778–1829). С помощью электролиза он смог впервые получить в чистом виде такие элементы, как калий, натрий, кальций, стронций, барий и магний, а также предсказал существование алюминия. Электролиз растворов солей используют в электрохимии для получения слоя металла на поверхности какого-либо предмета (серебрение, золочение, хромирование). Эту технологию называют гальванопластикой (рис. 136). С помощью гальванопластики можно получить точные металлические копии предметов. Если после электролиза снять с формы отложенный на ней слой металла, он будет повторять её очертания.
Применение солей.
Соли широко используют в различных областях промышленности и хозяйства (рис. 137). Многие из них незаменимы в качестве минеральных удобрений: соли азотной кислоты (селитры), соли фосфорной кислоты (фосфатные удобрения).
Рис. 136. Чайнокофейный сервиз мануфактуры Кристофля (1875) – одно из первых применений гальванопластического серебрения и золочения
В строительстве и медицине широко используют гипс – сульфат кальция, главным достоинством которого является способность быстро застывать после смешивания с водой, образуя прочное соединение. Другие соли серной кислоты, например железный и медный купоросы, находят своё применение в производстве красителей, фунгицидов, в медицине и строительстве. Главной составной частью известняка, мела и мрамора является соль угольной кислоты и кальция – карбонат кальция (CaCO3). Очищенный от посторонних примесей, карбонат кальция широко используется в строительстве, в бумажной и пищевой промышленности, при производстве красок, пластмасс, продукции бытовой химии.
Проверьте свои знания
1. Какие вещества относят к солям? 2. Что происходит в процессе электролиза? 3. Расскажите, где в быту используют карбонат кальция.
Задания
1. Подберите эпиграф к данному параграфу. 2. Приведите примеры солей, использующихся в промышленности и сельском хозяйстве. 3. Вспомните из курса географии, к какому типу пород относится известняк.
Рис. 137. Многообразие солей (А: синяя – медный купорос, красная – дихромат калия, жёлтая – жёлтая кровяная соль, тёмно-фиолетовая – перманганат калия, белая – хлорид натрия, зелёная – нитрат никеля (II)) и их применение (Б – Ж)
|
||||
|
Последнее изменение этой страницы: 2021-04-05; просмотров: 327; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.217.242.39 (0.01 с.) |