Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Строение атома и свойства химических элементовСодержание книги
Поиск на нашем сайте
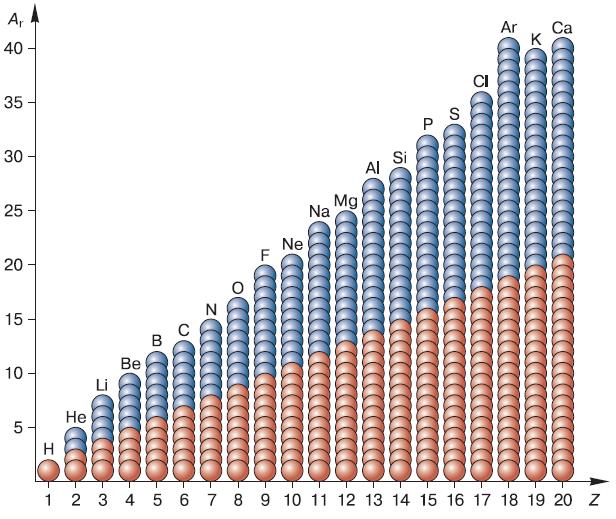
После того как физикам удалось многое узнать о строении атома, стало возможным применить эти знания для объяснения химических свойств элементов и теоретического обоснования Периодического закона Менделеева. Нам известно, что порядковый номер элемента в периодической системе соответствует числу протонов в его ядре (рис. 122). Так как протоны обладают положительным электрическим зарядом, а атом всегда электрически нейтрален, то положительный заряд ядра должен в точности уравновешиваться суммарным зарядом отрицательно заряженных электронов. Следовательно, число электронов в атоме всегда равно числу протонов в его ядре.
Рис. 122. Состав атомных ядер химических элементов № 1—20 таблицы Д. И. Менделеева (красные шарики – протоны; голубые – нейтроны; Z – порядковый номер элемента; Ar – массовое число, равное сумме протонов и нейтронов)
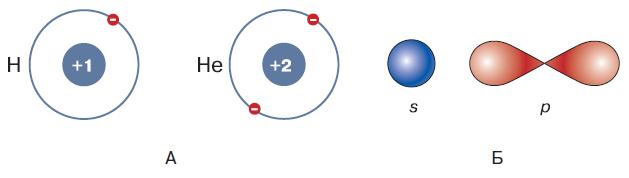
Находящиеся в ядре нейтроны, не имеющие электрического заряда, влияют на массу атома элемента, но не определяют число движущихся вокруг ядра электронов. Химические свойства атомов элементов определяются строением их электронной оболочки. Электроны в атоме, как вы знаете, находятся в определённых областях пространства, называемых орбиталями. Этот термин был введён вместо употреблявшегося ранее понятия «орбита» для того, чтобы не складывалось ощущения, что электрон вращается вокруг ядра по какой-то конкретной линии. В действительности электрон в атоме не имеет определённой траектории движения, более того, он проявляет свойства как частицы, так и волны. Квантовая механика рассматривает вероятность нахождения электрона в пространстве вокруг ядра. Наиболее вероятно нахождение электрона вблизи ядра. По мере удаления от ядра вероятность нахождения электрона в данной точке пространства постепенно снижается. Пространство вокруг ядра, в котором наиболее вероятно нахождение электрона, и называется орбиталью. Орбитали атома имеют разные размеры. Электроны, находящиеся на орбиталях близкого размера, образуют электронные слои. Электронные слои называют также энергетическими уровнями. Их нумеруют, начиная от ядра: 1, 2, 3, 4 и т. д. Энергетические уровни разделяются на подуровни. Подуровни принято обозначать латинскими буквами s, р, d и т. д. На s -подуровне находится только одна орбиталь, её, как и подуровень, называют s -орбиталью. На p-подуровне находятся три p-орбитали. Орбитали имеют разную форму: так, s -орбиталь имеет форму шара, р -орбиталь – форму гантели, или объёмной восьмёрки. Каждая орбиталь обладает своим особенным количеством энергии. Известно, что на одной и той же орбитали может находиться одновременно не более двух электронов. По мере увеличения порядкового номера элемента в периодической системе растёт содержащееся в его ядре число протонов, а вместе с ним и число электронов, находящихся на различных энергетических уровнях. На первом уровне имеется только один s -подуровень, который обозначается как 1s. Он может содержать один или два электрона. У атома водорода на этом уровне находится его единственный электрон (рис. 123, А). В ходе химического взаимодействия атомы могут отдавать или принимать электроны, превращаясь в заряженные частицы – ионы. Атом водорода легко расстаётся со своим электроном, отдавая его другим атомам и превращаясь в положительно заряженный ион Н+. Атом гелия имеет на том же уровне два электрона, поэтому его первая и единственная орбиталь оказывается заполненной (см. рис. 123, А). Новые электроны он присоединить не может, а расставаться с теми, которые находятся на завершённой внешней оболочке, энергетически невыгодно. Поэтому гелий является инертным веществом, которое не способно вступать в химические реакции. Чем больше протонов и электронов в атоме, тем сложнее становится структура его электронной оболочки. Если первый уровень имеет только один подуровень 1s, то второй – уже два (2s и 2р), и с возрастанием номера уровня число содержащихся в нём подуровней продолжает увеличиваться (рис. 123, Б). Химические свойства атомов во многом определяются числом электронов, расположенных на внешних уровнях электронной оболочки.
Рис. 123. Строение атома: А – схемы строения электронных оболочек атомов водорода (Н) и гелия (Не); Б – формы s – и p -орбиталей (электронных облаков)
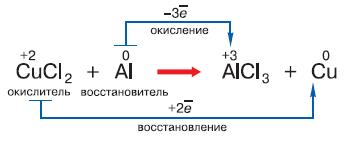
Рис. 124. Процесс обмена электронами при окислительно-восстановительной реакции
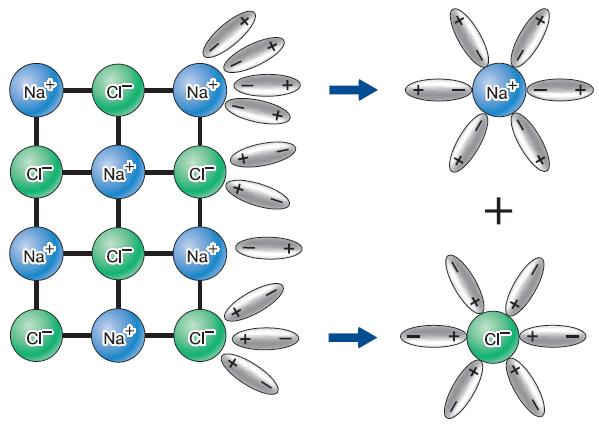
Если эти уровни содержат мало электронов, атом, вступая в химическую реакцию, стремится их отдать, если много – присоединить чужие электроны, чтобы заполнить внешнюю оболочку. Если же эта оболочка заполнена, атом становится инертным и в большинстве случаев вообще не участвует в химических реакциях. Элементы, находящиеся в начале каждого периода, содержат на внешней оболочке мало электронов и поэтому легко их отдают, превращаясь при этом в положительно заряженные ионы. Потеря электронов атомом называется окислением (рис. 124). В конце периодов, непосредственно перед инертными газами, находятся галогены (фтор, хлор, бром, иод), которым для заполнения внешней оболочки не хватает одного электрона. Поэтому они легко присоединяют электроны и становятся при этом отрицательно заряженными ионами. Этот процесс носит название восстановления. Итак, чем меньше электронов находится на внешней оболочке атома, тем активнее он их отдаёт; чем меньше электронов не хватает для заполнения внешней оболочки атома, тем активнее он их принимает. Элементы, которые склонны к отдаче электронов, называют металлами, а те, которые способны их принимать, – неметаллами. Атомы многих элементов, например углерода, серы, примерно с равной вероятностью могут и отдавать, и принимать электроны. Чёткой границы между металлами и неметаллами не существует. Наиболее распространённым и наглядным примером взаимодействия металлов и неметаллов является процесс, который происходит при контакте щелочного металла с галогеном. Металл легко отдаёт свой единственный внешний электрон, а галоген присоединяет его как единственный недостающий. В результате образуется положительно заряженный ион металла (катион ) и отрицательно заряженный ион галогена (анион) [11]. Имея разноимённые заряды, эти ионы притягиваются друг к другу. В результате получаются соли, примером которой является хлорид натрия (поваренная соль). Хлорид натрия состоит из кристаллов, в состав которых входят катионы натрия Na+ и анионы хлора Cl- (рис. 125). При растворении хлорида натрия в воде его кристаллы распадаются на ионы. Процесс распада молекул или ионных кристаллов веществ на ионы при растворении в воде называют электролитической диссоциацией.
Рис. 125. Схема электролитической диссоциации хлорида натрия
Таким образом, в растворе поваренной соли нет молекул хлорида натрия, а присутствуют только ионы натрия и хлора, окружённые молекулами воды (см. рис. 125). Слово «диссоциация» здесь означает распад, разделение. Вещества, способные к электролитической диссоциации, называют электролитами. Их растворы проводят электрический ток. Это становится понятным, если учесть, что ток – это перенос заряженных частиц, которыми в данном случае являются катионы и анионы. Электролитической диссоциации при растворении в воде подвергается не только соли, но также кислоты и основания.
Проверьте свои знания
1. В каких случаях при протекании химических реакций атом чаще отдаёт, а в каких – присоединяет электроны? 2. Почему гелий и другие благородные газы почти не способны вступать в химические реакции? 3. Чем определяются реакции окисления и восстановления?
Задания
Опираясь на рисунок 125, опишите, какую роль играет вода в процессе электролитической диссоциации.
|
||
|
Последнее изменение этой страницы: 2021-04-05; просмотров: 220; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.220 (0.009 с.) |