Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Работа 7. Выделение и количественный учет микроорганизмов почвы на твердых питательных средахСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте Работа 7. Выделение и количественный учет микроорганизмов почвы на твердых питательных средах Общее количество микроорганизмов в почве свидетельствует об интенсивности биохимических процессов, протекающих в почве и определяющих накопление элементов корневого питания растений. Количество микроорганизмов в почве определяют методом посева почвенной суспензии на питательные среды либо прямым микроскопическим счетом клеток на препаратах. Метод посева почвенной суспензии на твердые питательные среды (МПА, КАА, среду Эшби, среду Чапека) позволяет учесть общее количество микроорганизмов и получить на пластинке с агаром изолированные колонии для выделения микроорганизмов в чистую культуру. Микроорганизмы, выделенные в чистую культуру, в дальнейшем могут быть всесторонне изучены и идентифицированы. В этом прежде всего заключается ценность этого метода. Однако в лабораторной практике микробиологии нет универсальной питательной среды, на которой развивались бы все почвенные микроорганизмы. Даже применение наиболее универсальных питательных сред позволяет учесть лишь незначительную часть микронаселения почвы (0,1—1,0%).
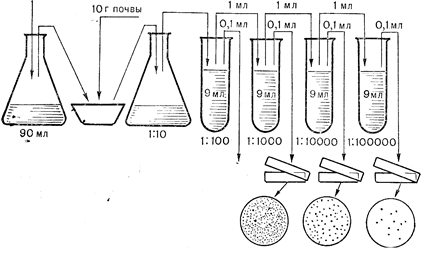
Сущность метода заключается в нанесении почвенной суспензии микроорганизмов на поверхность твердой питательной среды. Количество микроорганизмов определяют по числу развившихся колоний, учитывая, что одна микробная клетка дает начало одной колонии. Таким образом, метод позволяет учесть лишь микроорганизмы, способные развиться на данной питательной среде, результаты же общей численности микроорганизмов получаются заниженные. Материалы и оборудование Весы, разновесы, часовое стекло, скальпель, ступка, резиновая перчатка, колба со стерильной дистиллированной водой, пипетки на 10 мл и 1 мл, микропипетки на 0,1 мл, пробирки, колба объемом 250 мл, колба с питательной средой, чашки Петри, стеклянные шпатели. Ход работы Приготовление почвенной суспензии Для приготовления разведений почвенной суспензий готовят ряд пробирок с 9 мл стерильной дистиллированной воды, колбу, содержащую 90 мл стерильной воды, и вторую колбу, стерильную, сухую, объемом 250 мл. Для диспергирования почвенных агрегатов и десорбции клеток микроорганизмов с поверхности почвенных частиц почву обрабатывают ультразвуком (установка УЗДН-1, 15 кГц,0,ЗА), растирают или встряхивают на пропеллерной мешалке. Такая предварительная обработка почвы позволяет учесть значительно большее количество микроорганизмов (Мишустин, 1975). Наиболее доступным приемом предварительной обработки почвы, дающим хорошие результаты, считается растирание почвенного образца. Исследуемую почву высыпают на стерильное стекло. Стекло заранее протирают спиртом и обжигают на пламени. Почву тщательно перемешивают шпателем, удаляя механические частицы и корни растений. Соблюдая стерильность, на часовом стекле отвешивают 10 г. почвы и переносят ее в стерильную ступку. Навеску почвы в ступке увлажняют до пастообразного состояния, добавляя 2—3 мл воды из первой колбы, содержащей 90 мл стерильной воды, и растирают 5 мин пальцем в резиновой перчатке. После растирания почву из ступки переносят с помощью воды во вторую сухую колбу, получают первое разведение - 1/10. Почвенную суспензию в колбе встряхивают в течение 5 мин, дают отстояться 30 с и далее стерильной пипеткой переносят 1 мл почвенной суспензии из колбы в пробирку ¹ 1 с 9 мл стерильной дистиллированной воды, получают второе разведение—1/100. Подобным образом готовят ряд последующих разведений почвенной суспензии—1/1000, 1/10000, 1/100000 и более в зависимости от предполагаемой численности микроорганизмов, учитывая тип почвы, генетический горизонт, сезон года,
350 колоний 70 колоний 12колоний
Рис. 17. Схема приготовления разведений и высева почвенной суспензии на твердые питательные среды.
влажность почвенной пробы и т.д. Для приготовления каждого нового разведения почвенной суспензии следует пользоваться новой стерильной пипеткой (рис. 17). Посев. Для выделения и количественного учета бактерий почвенную суспензию высевают на одну из питательных сред МПА, КАА, почвенный агар, среду Эшби; для учета актиномицетов используют КАА или среду Чапека; для выделения и количественного учета грибов и дрожжей применяют СА или модифицированную среду Чапека. Питательную среду, расплавленную на водяной бане, соблюдая стерильность, разливают в чашки Петри слоем 0,5—0,8 см. Для высева на каждое разведение почвенной суспензии готовят по 3—5 чашек Петри. После застывания среды для удаления капель воды с крышек и появления муаровой поверхности на агаре чашки Петри подсушивают в термостате при температуре 60—70°С. На крышке чашки Петри пишут этикетку, указывая номер почвенной пробы, дату посева, разведение и повторность. Для выделения почвенных микроорганизмов обычно проводят поверхностный посев почвенной суспензии на питательную среду. Предварительно до посева отбирают пипетки на 1 мл с одинаковым числом капель жидкости, так как размер капель из разных пипеток может отличаться, что приведет к ошибке в подсчете микроорганизмов. На каждое новое разведение почвенной суспензии следует приготовить новую стерильную пипетку и новый стерильный шпатель. Стерильной пипеткой на 1 мл наносят каплю почвенной суспензии из соответствующего разведения по центру питательной среды в чашке Петри и тщательно растирают ее стеклянным шпателем по всей поверхности агаровой пластинки. Для посева почвенной суспензии удобно пользоваться микропипетками на 0,1—0,2 мл. Засеянные чашки Петри переворачивают средой вверх и помещают в термостат при температуре 28—30°С. Колонии бактерий на чашках Петри подсчитывают через 3—5 суток, грибов и дрожжей—через 5—7, актиномицетов— через 7—15. Наиболее точный результат получается при развитии на чашке Петри 50—200 колоний бактерий и актиномицетов и 30—50 колоний грибов. Следует иметь в виду, что при очень большом и очень малом количестве колоний на чашках Петри могут быть значительные ошибки при подсчете микроорганизмов. Обычно почвенную суспензию высевают из 3—4 последовательных разведений на 3—5 чашек Петри из каждого разведения. Для учета грибов почвенную суспензию высевают из разведений на 1—2 порядка ниже, чем для учета бактерий и актиномицетов. Подсчет колоний микроорганизмов на чашках Петри Для удобства подсчета колоний микроорганизмов дно чашки Петри разделяют тушью или чернильной пастой на секторы или сегменты. Если питательная среда прозрачна, колонии подсчитывают в проходящем свете со дна чашки; в случае непрозрачной питательной среды колонии микроорганизмов подсчитывают непосредственно с поверхности агара. Учтенные колонии отмечают точками на стекле. Для подсчета мелких колоний пользуются ручной лупой. Чашки Петри, в которых развилась масса колоний микроорганизмов, обрабатывают специальным прибором для счета микробных колоний, выпускаемым медицинской промышленностью СССР. Подсчитав число колоний микроорганизмов, развившихся на чашках Петри по всем повторностям соответствующего разведения, определяют средние число колоний на чашке и далее пересчитывают количество микроорганизмов на 1 г. воздушно-сухой почвы по формуле: а = б ´ в ´ г д где а — число клеток микроорганизмов в 1 г. воздушно-сухой почвы, б — среднее число колоний микроорганизмов на чашке Петри, в — соответствующее разведение, г — количество капель в 1 мл жидкости в пипетке, д — навеска почвы, взятой для анализа. Для большей точности учета численности микроорганизмов параллельно микробиологическому анализу определяют процент влажности почвенной пробы и окончательное количество микроорганизмов рассчитывают на 1 г абсолютно сухой почвы.
Ход работы Для количественного учета микроорганизмов методом предельных разведений на жидких питательных средах навеску исследуемой почвы подвергают растиранию в ступке, а затем готовят ряд последовательных разведений почвенной суспензии точно так же, как при посеве на твердые питательные среды (см. работу 23). Приготовленную почвенную суспензию высевают в пробирки или колбы с питательной средой, соответствующей данной физиологической группе микроорганизмов. Так, для количественного учета аммонификаторов обычно пользуются пептонной водой, учета нитрификаторов—средой Виноградского, учета денитрификаторов—средой Гильтэя, учета клетчаткоразрушающих аэробов—средой Гетчинсона, учета клетчаткоразрушающих анаэробов—средой Имшенецкого, для учета маслянокислых бактерий—средой Виноградского. Состав и приготовление питательных сред приведены в работах при изучении микроорганизмов отдельных физиологических групп. Для учета микроорганизмов, характеризующихся высокой численностью (аммонификаторы, денитрификаторы, маслянокислые бактерии), почвенную суспензию рекомендуется высевать из разведений 1/1000 и выше; для учета микроорганизмов, сравнительно мало распространенных (нитрификаторы, клетчаткоразрушающие бактерии), посев почвенной суспензии проводят из первых 2—4 разведений—1/10, 1/100, 1/1000, 1/10000. В каждую пробирку или колбу с питательной средой стерильной пипеткой высевают по 1 мл почвенной суспензии из соответствующего разведения. Суспензией каждого разведения засевают 3—5 пробирок или колб. Засеянные пробирки или колбы помещают в термостат для инкубации при температуре, оптимальной для данной физиологической группы микроорганизмов. Количество микроорганизмов, развившихся на питательных средах, определяют по таблице Мак-Креди, составленной на основании методов вариационной статистики. Для определения числа микроорганизмов в засеянных пробирках или колбах составляют так называемую числовую характеристику. Она состоит из трех цифр. Первая цифра соответствует числу пробирок последнего разведения, в котором еще обнаруживается рост микроорганизмов в пробирках всех повторностей. Следующие две цифры обозначают число пробирок с ростом микроорганизмов в двух последующих разведениях. Если рост микроорганизмов обнаружен более чем в двух последующих разведениях, число этих пробирок прибавляют к последней цифре. По трехзначной числовой характеристике в таблице Мак-Креди находят вероятное число микроорганизмов в 1 мл разведения, принятого за первую цифру числовой характеристики. Умножив это вероятное число микроорганизмов на соответствующее разведение, получают количество клеток микроорганизмов в 1 г. исследуемой почвы. Для большей точности получаемых результатов содержание клеток микроорганизмов пересчитывают на 1 г. абсолютно сухой почвы, учитывая процент влажности почвы. Пример 1
Вероятное число микроорганизмов по таблице Мак-Креди — 15,0. Число микроорганизмов в 1 г. воздушно-сухой почвы: 15´100 = 1500.
Пример 2
Вероятное число микроорганизмов по таблице Мак-Креди — 4,0. Число микроорганизмов в 1 г. воздушно-сухой почвы: 4 ´ 1000 =4000. Приводим таблицу Мак-Креди для быстрой обработки результатов учета микробов по методу предельных разведений
Работа 9. Качественно – количественный учет микрофлоры почвы методом Д. М. Новогрудского Микроорганизмы своей жизнедеятельностью в значительной мере влияют на почвообразовательные процессы, создавая условия для развития тех или иных биогеоценозов. Изучение микроорганизмов почвы является составной частью геоботанических исследований. Для определения общего количества микроорганизмов в почве рекомендуется метод высева почвенного мелкозема на агаризованную воду по Д. М. Новогрудскому. Метод успешно используют для получения сравнительных данных о заселенности микроорганизмами различных почв с учетом почвенного горизонта, времени года, растения-эдификатора, ризосферной зоны, а также для выяснения соотношения отдельных групп микроорганизмов: бактерий, плесневых грибов и актиномицетов в почве. Метод основан на высеве строго определенной навески почвенного мелкозема на агаризованную воду. Учетным элементом является почвенная частичка. Она естественный источник выделения микроорганизмов и одновременно природный субстрат. Ввиду крайней бедности среды рост микроорганизмов идет лишь в водной пленке вокруг почвенной частички, исключая плесневые грибы, способные образовывать свои водные пленки и разрастаться на поверхности агара. Материалы и оборудование Чашки Петри, пробирки с голодным агаром, сито с диаметром отверстий 0,25 мм, ступка, спиртовка, скальпель, весы аналитические, предметные стекла, лезвия бритвы, пробирка, микроскоп, исследуемая почва, резиновая перчатка. Ходработы Разогретую агаризованную воду, соблюдая стерильность, разливают в чашки Петри и дают пластинке застыть. Небольшое количество воздушно-сухой исследуемой почвы тщательно растирают в ступке пальцем в резиновой перчатке и насыпают в сито с диаметром отверстий 0,25 мм. Сито с почвой взвешивают на аналитических весах и высевают почвенный мелкозем равномерно по всей поверхности агаровой пластинки. Следует учесть, что меньшая навеска почвы дает более высокие показатели. Наиболее благоприятна навеска до 20 мг. Сито с оставшейся почвой вновь взвешивают и определяют точную навеску высеянной почвы. Одной пробой почвы засевают три чашки Петри, две из них используют для подсчета бактерий и грибов, третью—для подсчета актиномицетов. Засеянные чашки Петри помещают в термостат на проращивание при температуре 25—28 °С. Количество грибов и бактерий подсчитывают через 2—3 суток после посева, актиномицетов—через 5—7 суток. Для учета количества микроорганизмов на агаровой пластинке пробиркой с ровным краем вырезают пять дисков: один—в центре пластинки и четыре—по двум взаимно перпендикулярным диаметрам. Диск переносят на предметное стекло и лезвием бритвы разрезают на полоски так, чтобы ширина полоски умещалась в поле зрения микроскопа при малом увеличении (объектив 8´, 10´, 20´, окуляр 10´, 15´). Каждую полоску систематически просматривают под микроскопом и исследуют каждую почвенную частичку, отмечая, какие микроорганизмы развились в ее сфере. Одна почвенная частичка может дать начало одновременно колонии бактерий, актиномицетов и грибов. Группу слившихся почвенных частичек следует считать за один образовательный центр. Подсчитав количество микроорганизмов в пяти дисках, определяют содержание микроорганизмов в 1 г. исследуемой почвы по формуле: Х = A x C / 5B x D где х— количество микроорганизмов в 1 г. почвы, А — количество колоний в пяти дисках, В — площадь диска, см2 (диаметр диска определяют полоской миллиметровой бумаги), с— площадь чашки Петри, 1 см2 D — навеска почвы, г. Для большей точности результатов следует внести поправку на влажность исследуемой почвы. Наблюдения за бактериями При высеве мелкозема вокруг почвенной частички образуется водная пленка, через 10—15 ч в ней развиваются первичные скопления бактериальных клеток. Нередко таких скоплений может быть два-три и более вокруг одной почвенной частички, что указывает на соответствующее число жизнеспособных зародышей. Через 24—48 ч клетки занимают все пространство водной пленки, формируя микроколонию. Микроколонии бактерий характеризуются крошечными размерами, одно-слойным расположением клеток, нередко меньшими размерами клеток. Далее в микроколонии могут происходить изменения: подвижные формы утрачивают подвижность, а спорообразующие формируют споры и т.д. Микроколонии могут быть сложными, образованными несколькими разными видами бактерий, располагающимися в виде островков, секторов, концентрических зон. Наблюдения за грибами Формы роста грибов вокруг почвенных частичек называют псевдоколониями. Последние отличаются от обычного роста на питательных средах редуцированными размерами (толщина гиф, длина конидиеносцев, размер и число конидиеспор) и упрощенной структурой (образованы из одной или немногих гиф, стерильных, реже с конидиальным плодоношением). В отличие от микроколоний бактерий гифы грибов формируют свои водные пленки, что и обеспечивает им рост по поверхности агара.
Материалы и оборудование. Стерильные предметные и покровные стекла, клей БФ-6, калька, вата, спиртовка, пинцет, садовый нож, карболовый эритрозин, 96%-ный этанол. Ход работы Соблюдая стерильность, клеем БФ-6 склеивают упрощенные капиллярные педоскопы вертикальным или горизонтальным направлением ячеек. На предметное стекло приклеивают тонкие полоски кальки на расстоянии, равном размеру ширины покровных стекол. Полоски кальки осторожно смазывают клеем и накладывают на них стерильные покровные стекла (рис. 18). Клей не должен выходить за пределы полоски кальки, внутрь ячейки, под покровное стекло. Готовые педоскопы закапывают в почву или вегетационные сосуды. Садовым ножом, предварительно простерилизованным, делают разрез в почве и в него вводят педоскоп так, чтобы капилляры располагались вертикально, т. е. в направлении движения почвенного раствора. Время экспозиции педоскопов в почве 1,0—2,5 мес. По окончании срока экспозиции педоскопы вынимают из почвы, наружную поверхность осторожно вытирают ватой и немедленно во избежание подсыхания микроскопируют пейзажи на изучение подвижных форм. Для более детального изучения микробных пейзажей педоскопы помещают в чашки Петри и фиксируют их парами 2%-ной осмиевой кислоты 2—4 мин либо парами 40%-ного формалина несколько секунд. Зафиксированные педоскопы окрашивают, погружая стекла в стаканы с 5%-ным карболовым эритрозином на 12—24 ч, промывают водой, подсушивают, микроскопируют. Задача исследования заключается в детальном описании микробного пейзажа, сформировавшегося в капиллярах педоскопа. При микроскопировании отмечают характер микрофлоры, плотность обрастания, доминирующие формы, отношения, сложившиеся между членами микробного ценоза. Материалы и оборудование. Монолит почвы с растением, пинцет, часовое стекло, ножницы, весы, разновесы, колбы объемом 250 мл, содержащие по 99 мл стерильной дистиллированной воды, крючки из проволоки, микропипетки, шпатели, лупа, микроскоп, чашки Петри, МПА или КАА, прибор для счета микробных колоний, стерильный кварцевый песок, колбы со стерильной дистиллированной водой, пробирки, пипетки на 10 и 1,2 мл, микропипетки на 0,1—0,2 мл. Ход работы Растение выкапывают с монолитом почвы. Стерильным пинцетом корни растения осторожно освобождают от прилипшей к ним почвы. С корневой системы растения стерильными ножницами срезают кусочки молодых корней и отвешивают 1 г на часовом стекле. Пинцетом переносят навеску корней в первую колбу с 99 мл стерильной дистиллированной воды и взбалтывают содержимое колбы 2 мин. Стерильным металлическим крючком переносят корни во вторую колбу с 99 мл стерильной дистиллированной воды и вновь взбалтывают содержимое колбы 2 мин.. Затем корни переносят последовательно в колбы № 3, 4, 5, 6 и 7, отмывая их в каждой колбе по 2 мин. В воду колб № 6 и 7 предварительно перед стерилизацией вносят по 3—5 г хорошо промытого стерильного кварцевого песка. Песком отделяются микроорганизмы, находящиеся в тесном контакте с корнем. Для качественно-количественного анализа ризосферной и корневой микрофлоры из каждой колбы стерильной микропипеткой высевают по 0,05 мл отмывной воды на поверхность пластинки МПА или КАА в чашки Петри. Повторность высева 3—5-кратная. Соблюдая стерильность, каплю высеянной жидкости втирают шпателем в поверхность питательной среды. Для каждого разведения следует иметь отдельную пипетку и отдельный шпатель. Засеянные чашки Петри помещают в термостат при температуре 28—30°С. Через 3—5 дней приступают к анализу колоний, развившихся на агаровых пластинках в чашках Петри. Колонии микроорганизмов изучают при малом увеличении микроскопа (окуляр 10—15х, объектив 8—10х) и делают подробное описание. Из колоний приготовляют мазки и рассматривают их, пользуясь объективом МИ-90. На препаратах обращают внимание на морфологические особенности микроорганизмов и по возможности устанавливают родовой состав ризосферной и корневой микрофлоры. Анализ результатов опыта показывает, что количество микроорганизмов по мере увеличения степени отмыва корней почти не убывает. Наоборот, в двух последних колбах (№ 6, 7) численность микроорганизмов возрастает по сравнению с их численностью в отмывах первых колб. В чашках Петри с посевом из отмывов первых колб встречаются крупные колонии бацилл. По мере увеличения степени отмыва число спороносных бактерий уменьшается, зато возрастает число мелких, точечных колоний бактерий рода Р s еи d отопа s и колоний микобактерий, окрашенных в желтый и оранжевый цвет. В высеве жидкости из отмывов первых и последних колб на пластинках питательной среды часто вырастает слишком много колоний микроорганизмов, которые трудно поддаются счету. Поэтому для более точного количественного определения микроорганизмов ризосферной зоны суспензию отмыва в первой колбе дополнительно взбалтывают 5 мин и из нее готовят ряд разведений. Из разведений делают посевы на пластинки МПА или КАА в чашки Петри, как указано выше. Для количественного учета микроорганизмов корневой зоны используют отмывы остальных шести колб. Содержимое этих колб сливают вместе, из полученной суспензии готовят ряд разведений и делают посевы из них на пластинки питательной среды в чашки Петри. Засеянные чашки Петри выдерживают в термостате 3—5 суток при температуре 28—30°С. По всем параллельным чашкам Петри для каждого разведения подсчитывают число развившихся колоний и вычисляют среднее количество колоний на чашку (см. выше). Число колоний, полученное на чашку Петри, умножают на 20 (пересчет с 0,05 мл на 1 мл), на степень разведения, на 600 (6 смывов по 100 мл) и получают количество микроорганизмов на 1 г корней. Ход работы Небольшое количество исследуемой почвы растирают в течение 10 мин в ступке пальцем в резиновой перчатке. На часовом стекле отвешивают 5 г почвы и переносят ее в колбу, содержащую 45 мл стерильной воды, получают разведение 1/10. Если анализируемая почва характеризуется высокой численностью микроорганизмов, готовят следующее разведение. В колбу № 2, содержащую 90 мл стерильной воды, пипеткой приливают 10 мл почвенной суспензии из колбы № 1, получают разведение 1/100. Содержимое колбы встряхивают в течение 5 мин, затем дают крупным частицам отстояться 3—5 с и стерильной микропипеткой переносят 0,01—0,02 мл почвенной суспензии на обезжиренное предметное стекло, равномерно распределяя ее на площадь 4 см2. Квадрат на стекле вычерчивают заранее алмазом, подложив под стекло миллиметровую бумагу. Приготовленный препарат высушивают на воздухе, фиксируют на пламени либо абсолютным спиртом 5 мин, либо парами 2%-ного раствора осмиевой кислоты 2—4 мин. Далее препарат окрашивают карболовым эритрозином 30—40 мин и более в зависимости от качества красителя. Эритрозин хорошо окрашивает бактериальные к
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-04-05; просмотров: 956; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.137 (0.01 с.) |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||